综合利用两个数据库进行药品不良反应风险信号挖掘方法的探索
王芳,李永辉,郭瑞锋,刘欣欣,张晶晶
目前,我国药品的质量评价所面临的一个难题就是仿制药品众多,同一种药品由多家企业生产,其生物效价、临床疗效和不良反应不尽相同[1],如何选用和比较同种药品的质量、临床疗效以及安全风险是当前所必须面对、亟待解决的问题,也是药学工作者推进合理用药、减少药源性损害发生的一项重要工作[2]。研究[3-9]表明药品不良反应的发生和药品质量具有相关性,通过比较不同厂家生产的同通用名药品不良反应发生率探究药品安全风险与质量的相关性具有一定的挑战性和新颖性。药品不良反应监测数据是做好药品监管工作的技术基础和科学依据,充分分析、有效利用这些数据,检测和质量相关的风险信号,是风险管理和科学监管的重要环节和前提。
国家食品药品监督管理总局发布的《国家药品不良反应监测年度报告》[10-15]中连续六年(2011--2016年)抗感染药不良反应病例报告数量居首位,排名首位的是头孢菌素类抗生素,其严重不良反应以过敏反应为主。
本研究将国家药品不良反应监测系统的不良反应数据库与河北省食品药品监督管理局药品电子检验报告监管部门核查系统中医疗机构药品购进数据相结合进行分析,选取头孢菌素类中的3个品种为样本研究不同药品生产企业间的同通用名药品不良反应报告率的差异,差异有统计学意义的企业及其品种作为风险信号,为进一步的风险信号筛选、分析、确认、分析和风险管理找准方向。
1 资料与方法
1.1研究假设为研究不同企业生产的同通用名药品之间安全性差异,可通过比较不同企业生产的该药品不良反应发生率来实现。药品的不良反应实际发生率可通过如下公式计算:
Ki=νi/ηi
其中Ki代表某企业生产的某类药品的不良反应发生率,νi为该企业该药品的不良反应发生次数,ηi为该企业的药品使用人次。但由于实际工作中,νi与ηi均无法直接获得,故可以考虑利用药品不良反应上报数及药品采购量来反映药品不良反应发生率。
由于用药人次ηi无法直接测量,可采用文献中的办法来估算用药人数[16]。
用药人数≈药品采购量/(用药日数×定义日剂量)
假设病人感染程度不同时对所用药品的生产企业没有倾向性,则可认为用药日数×定义日剂量为一个常数,直接使用采购量来代替用药人数,药品不良反应报告率的绝对数值都会偏小,但ADR的发生强度的比较仍可进行。
不良反应自发报告系统统计数据与药品的真实不良反应发生率之间存在差异,自发报告上报数ν′与真实不良反应发生数ν之间存在如下关系:
ν′=αν{|0≤α≤1}
为应对这种差异,本研究假设医疗机构对于不同企业生产的同类药品的不良反应上报情况不存在倾向性,各企业产品的α值近似相等,使用ν′值计算的不良反应事件差异可以反映产品ν值的差异。
将不良反应上报数与用药频度作为替代指标衡量药品安全性,则:
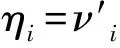
本研究使用药品不良反应上报数与药品采购量的比值作为药品不良反应报告率,通过比较同种药品不同生产企业间的药品不良反应报告率,反映不同企业间药品安全性差异情况。
1.2数据来源及研究方法药品不良反应报告资料来自国家药品不良反应监测系统河北省数据库,不良反应报告时间为2014年1月至2015年12月,根据药品不良反应上报情况,选取抗感染类药品中不良反应报告占比较高的头孢菌素类中三个品种作为研究对象。纳入研究范围的通用名药品包括注射用头孢曲松钠、注射用头孢呋辛钠和注射用头孢哌酮钠舒巴坦钠;对不良反应数据进行标准化处理后,按通用名、生产企业分类做描述统计分析。研究进一步采集河北省食品药品监督管理局药品电子检验报告监管部门核查系统中医疗机构药品采购数据。以研究药品的ADR例数与对应的采购量比值来表示不良反应报告率。对同通用品不同企业的药品不良反应报告率差异进行比较,以χ2检验判别结果,P<0.05为差异有统计学意义,并计算其相对危险度(Relative risk,RR)[17]。
由于无法获得药品实际使用量信息,本研究采用药品采购数量替代药品使用量信息计算不良反应报告率。药品采购数量来源是医疗机构通过河北省食品药品监督管理局药品电子检验报告监管部门核查系统查验购进药品电子检验报告时所产生的购进数量。此系统是由河北省食品药品监督管理局开发并在全省范围内使用的。省内各涉药单位在采购药品时必须索要或查验所购进药品的检验报告并如实填报采购数量。管理人员可通过登录系统查询省内各类涉药单位(包括药品生产企业、经营企业、药品使用单位等)药品供应或采购数量。
2 结果
2.1数据清洗本研究对不良反应数据中生产企业、剂型或给药方式等信息缺失或明显错误的条目进行人工清洗,并与药品采购数据中的生产企业进行匹配,筛除不合格数据及未匹配数据。并以清洗匹配后的不良反应例数(n)与该药品年度报告的不良反应例数(N)的比值计算匹配度。
3种药品连续2年不良反应报告率及供应量匹配情况见表1。
2.2不良反应报告率比较为研究各企业生产的药品与同品种其他企业产品的安全性,本研究按下式计算各企业与其他产品不良反应报告率的相对危险度(RR),并以χ2检验结果判别其统计显著性。
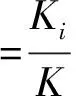
本研究共涉及三种同通用名药品,企业采购量信息180条,其中41条(22.78%)企业不良反应报告率显著高于同品种其他企业;63条(35.00%)企业不良反应报告率显著低于同品种其他企业;34条(18.89%)与同品种其他企业相比差异无统计学意义;42条(23.33%)只有采购量数据,未见不良反应报告,见表2。
3 讨论
3.1不良反应报告率可提示药品生产企业质量安全风险已有研究表明同品种药品的不良反应发生率与不同的药品生产企业存在关联性:阿奇霉素国产较进口合资的不良反应发生率高[3];华兰生物的流感疫苗较葛兰素史克的ADR发生率高[4];国产甲氨蝶呤较进口的致肝损害的发生率高[5]。不同厂家生产的头孢拉定引起血尿的发生率存在差异[6]。
此外有研究表明不良反应发生率与药品质量相关:抗生素的药品不良反应发生率偏高的生产企业其杂质总量的数据偏高[7];头孢拉定中不溶性微粒增多会导致血尿不良反应发生[8]。药品流通环节采取针对性风险管理措施能够显著降低药品的不良发生发生率[9]。
药品不良反应的发生率能够快速反映药品的质量情况,揭示不同企业间的质量差异性,是风险在临床用药安全的一个窗口,可作为药品安全性评价的直接证据。由于实际工作中不良反应发生率难以获得,本研究通过不良反应报告率间接反映不良反应发生率,来快速提取风险信号,识别风险和确认风险,为后续的信号分析评价研究及利用找准方向,适应当前形势、经济、实用、可操作。
3.2两个数据库(不良反应数据与药品采购数据)匹配度较高河北省每年通过国家药品不良反应监测收集的报告数4万余份,但仅能反映发生频数,因没有使用人次数,不能反映不良反应发生率的情况。药品电子检验报告监管部门核查系统仅能提供药品采购量的情况,不能反映不良反应发生频数的情况。综合利用该两个数据库可获得不良反应报告率,可作为挖掘不良反应风险信号的切入点。
国家药品不良反应监测系统的不良反应上报数据与药品电子检验报告监管部门核查系统中药品采购量信息匹配度在73.04%~95.24%之间,总体匹配度为86.39%。总体来看,ADR数据与药品采购数据匹配情况较理想,具有一定的分析利用价值,可综合利用该两个系统进行数据挖掘。
3.3不同企业生产的同种药品不良反应报告率之间存在差异由本研究结果来看,不同企业生产的同品种药品不良反应报告率之间确实存在一定的差异性,22.78%的药品不良反应报告率高于同类其他企业生产的药品,差异有统计学意义,18.89%的药品不良反应报告率低于同类其他企业生产的药品,差异有统计学意义。同品种之间的不良反应报告率差异较大,相对危险度最高达431.10,风险信号指示强烈。不良反应报告率高于同类其他药品,差异有统计学意义的的条目可视为产生一个不良反应风险信号,提示我们该企业生产的该类药品可能存在安全性隐患,应加强监测并结合其他相关方法找出风险原因并判定其风险等级。

表1 目标药品不良反应上报及用量匹配情况
注:采购量=规格×支数

表2 不同生产企业不良反应报告率比较情况/家
3.4综合利用两个数据库进行药品不良反应风险信号挖掘方法的特点
3.4.1快速、准确、经济甄别风险信号 获取准确的不良反应发生率研究成本高,需投入大量的人力、财力、物力,比较众多不同厂家的ADR发生率需要的样本量大、工作量巨大、周期长,难以实现。该方法快速、准确、经济的提取不良反应风险信号,为进一步深入探究找准方向和目标。
使用不良反应报告率替代ADR发生率,有产生偏倚的可能性,为减少假阳性信号的干扰,提高方法准确性,可在差异有统计学意义的前提下为相对危险度设定高阈值,阈值过高会遗漏信号,阈值可根据实际情况进行调整。
3.4.2与既有信号检测方法的不同之处 当前药品不良反应比较经典的信号检测方法有频数法(PRR、ROR、MHRA)和贝叶斯法(BCPNN、MGPS)等,数据来源为单个数据库(如国家药品不良反应监测系统数据库),针对某药品和某特定不良反应提取风险信号。本研究信号检测方法综合利用两个数据库,在确定为同品种一药品的情况下,重在区别企业间差异性,针对药品不良反应的发生情况与企业之间的关联性提取风险信号。
3.4.3信号的应用 提取到的风险信号,可提供给临床加强监测,对风险进行进一步分析评估;可反馈给相关药品生产企业,企业对风险信号进行分析评价,进一步探究其内在原因加强药品生产质量控制;可作为药品安全性风险信号供药品监管部门或相关研究机构做进一步研究与参考。
该方法可进一步拓展应用,如比较同一生产企业同一品种不同生产批次的ADR报告率差异,本研究进行过程中,曾发现某企业A批次的ADR报告率高于其他批次(χ2=6.85,P=0.008 9),差异有统计学意义,在对企业进行药品生产质量管理规范(GMP)认证检查时重点查阅了该两个批次的生产批记录,A批次生产期间悬浮粒子量有1 h超标,信号得到了初步确认。
3.5展望将药品不良反应数据库与药品电子检验报告监管部门核查系统数据进行联合分析,能够快速、准确甄别出同通用名下不同企业生产的药品之间的安全性可能存在的差异,但受限于数据来源的局限性,该研究目前尚不能够作为确定性证据反映药品的安全等级,但可作为风险信号提示,缩小研究范围,锁定目标企业,据此进行药物流行病学研究或相关临床试验研究以对相关药品的安全性差异进行进一步探讨和确认。待药品不良反应监测工作达到较成熟的阶段,不良反应报告数接近甚至近似等于不良反应发生次数和药品电子检验报告电子平台更加全面完善时,不良反应报告率会更接近真实的不良反应发生率,风险信号提取的准确性将大大提升,方法进一步确立。

