不同镉胁迫条件对土壤微生物活性的影响
石松林 雷盈 覃紫其

摘要 通过设计4种镉污染梯度、2种种植条件[有、无百日草(Zinnia elegans)],选择土壤基础呼吸强度、脲酶活性、过氧化氢酶活性等3种反映土壤微生物活性的关键指标,探究了不同镉胁迫条件对土壤微生物活性的影响特征。结果表明,土壤基础呼吸强度、脲酶活性和过氧化氢酶活性与镉胁迫程度均大致成负相关,随着镉浓度增加,土壤脲酶活性呈反比例函数型下降趋势,土壤过氧化氢酶活性呈正弦曲线变化规律;种植百日草能促进土壤基础呼吸强度、脲酶活性和过氧化氢酶活性,提高不同微生物活性指标受镉胁迫影响的相关性;在种植百日草条件下,镉胁迫对土壤微生物活性的影响与不种植百日草条件相似,其中2种条件下的过氧化氢酶受镉胁迫的影响基本无差异。
关键词 镉胁迫;土壤微生物活性;土壤基础呼吸;土壤酶活性;百日草
中图分类号 X53 文献标识码 A
文章编号 1007-5739(2019)23-0153-02 开放科学(资源服务)标识码(OSID)
随着国民经济的快速发展,镉污染已成为我国土壤污染中重大环境问题之一,严重影响着我国粮食安全和居民健康[1]。据报道,我国受镉污染的耕地面积超过1.33万hm2,污染区稻米中镉含量远高于食品安全标准[2]。镉对土壤基础呼吸、酶活性和微生物类群破坏大,可导致土壤生态系统严重失衡、农作物镉含量超标,影响区域生态安全和居民健康[3-6]。因此,开展镉污染区土壤修复工作至关重要。
土壤基础呼吸强度、酶活性是反映镉污染对土壤微生物活性影响的敏感指标[7-9]。土壤基础呼吸反映了土壤微生物、植物根系主要代谢过程,土壤酶在有机物分解、无机物质转化、污染物降解及修复等方面起着重要作用[10-11]。已有研究表明,镉污染对土壤生态系统及其微生物活性具有明显负作用[12-14],对土壤酶活性具有抑制作用[15-17]。也有学者发现,低浓度镉污染对土壤酶活性具有一定的促进作用[18]。
百日草(Zinnia elegans)对重金属镉具有较强的耐性和富集性,可用于镉污染土壤修复[19-22]。目前,利用百日草修复镉污染土壤对土壤微生物活性的影响机理还不清楚。本研究通过设计4种镉污染梯度、2种种植条件(有、无百日草),选择土壤基础呼吸强度、脲酶活性、过氧化氢酶活性3种反映土壤微生物活性的关键指标,探究不同镉胁迫条件对土壤微生物活性的影响特征,旨在解决以下2个关键科学问题:不同镉胁迫水平对土壤微生物活性影响程度如何;镉污染土壤中种植百日草是否会有利于土壤微生物活性。
1 材料与方法
1.1 试验材料
1.1.1 植物材料。百日草(Zinnia elegans)又名百日菊,是菊科百日菊属一年生草本,喜温暖、光照充足环境,耐干旱和贫瘠土壤。试验用百日草均为种子萌发产生,种子为网上采购。
1.1.2 土壤基质。试验土壤采于成都理工大学校园内贫瘠土壤区,采集表层土壤(0~20 cm),经自然风干、磨碎后均匀混合,过2 mm筛,与河沙1∶1充分混合后装盆。混合后土壤基质理化性质为pH值6.67,含水率24.31%,有机碳含量2.04 g/kg,全镉含量1.12 mg/kg。
1.2 试验设计
将配置好的土壤装于口径15.6 cm、盆径11.2 cm、高13.8 cm的塑料盆中,每盆装约2 kg。设置2种种植条件,分别标记为有百日草(A1)和无百日草(A2);A1和A2分别设置4个镉浓度梯度处理,分别标记为对照(不加镉,CK)和加镉30 mg/kg(S1)、60 mg/kg(S2)、120 mg/kg(S3),每种处理3个重复。
1.3 试验实施
在试验之前,为培养、形成均质化的土壤理化條件,将土壤含水量调节至40 %(田间最大持水量),并用透气的薄膜封口,常温下培养7 d后,加入用CdCl2·2.5H2O配置的不同浓度镉溶液,并搅拌均匀。A1组在土壤加入重金属后,每盆移栽3株株高长势一致的百日草。为保持整个试验过程土壤含水量不变,采用称重差减法每隔3 d调节1次土壤水分。整个试验持续27 d,然后取土样测土壤基础呼吸强度、脲酶活性及过氧化氢酶活性。
1.4 测定方法
1.4.1 土壤基础呼吸强度。采用室内密闭碱液吸收法测定[23],以每小时1 kg土壤二氧化碳的释放量(mg)表示。
1.4.2 脲酶。采用苯酚钠比色法测定土壤脲酶活性[24],以培养24 h后1 g土壤中NH3-N的含量(mg)表示。
1.4.3 过氧化氢酶。采用高锰酸钾滴定法测定[25],以振荡30 min后1 g土壤消耗0.002 mol/L高锰酸钾量(mL)表示。
1.5 數据处理与分析
采用SPSS 22.0进行描述性统计和相关性分析,并使用Origin 2019作图。
2 结果与分析
2.1 镉胁迫对土壤基础呼吸的影响
由图1可知,土壤基础呼吸强度与镉污染程度成负相关关系,种植百日草对土壤基础呼吸强度有一定的促进作用。比较不同镉胁迫水平对土壤基础呼吸强度影响发现,S1组(30 mg/kg)明显好于其他组,有、无百日草种植的S1组分别比各自对照组高20.00%和35.29%,说明低浓度镉对土壤基础呼吸具有一定促进作用;有、无百日草种植的S3组均小于各自对照组,说明高镉浓度胁迫条件对土壤基础呼吸有明显抑制作用,抑制率最高可达70%;有百日草种植的S2组>CK,且明显高于无百日草种植的S2组,说明在中低镉浓度(60 mg/kg以下)污染胁迫条件下种植百日草对土壤基础呼吸有一定促进作用。
2.2 镉胁迫对土壤酶活性的影响
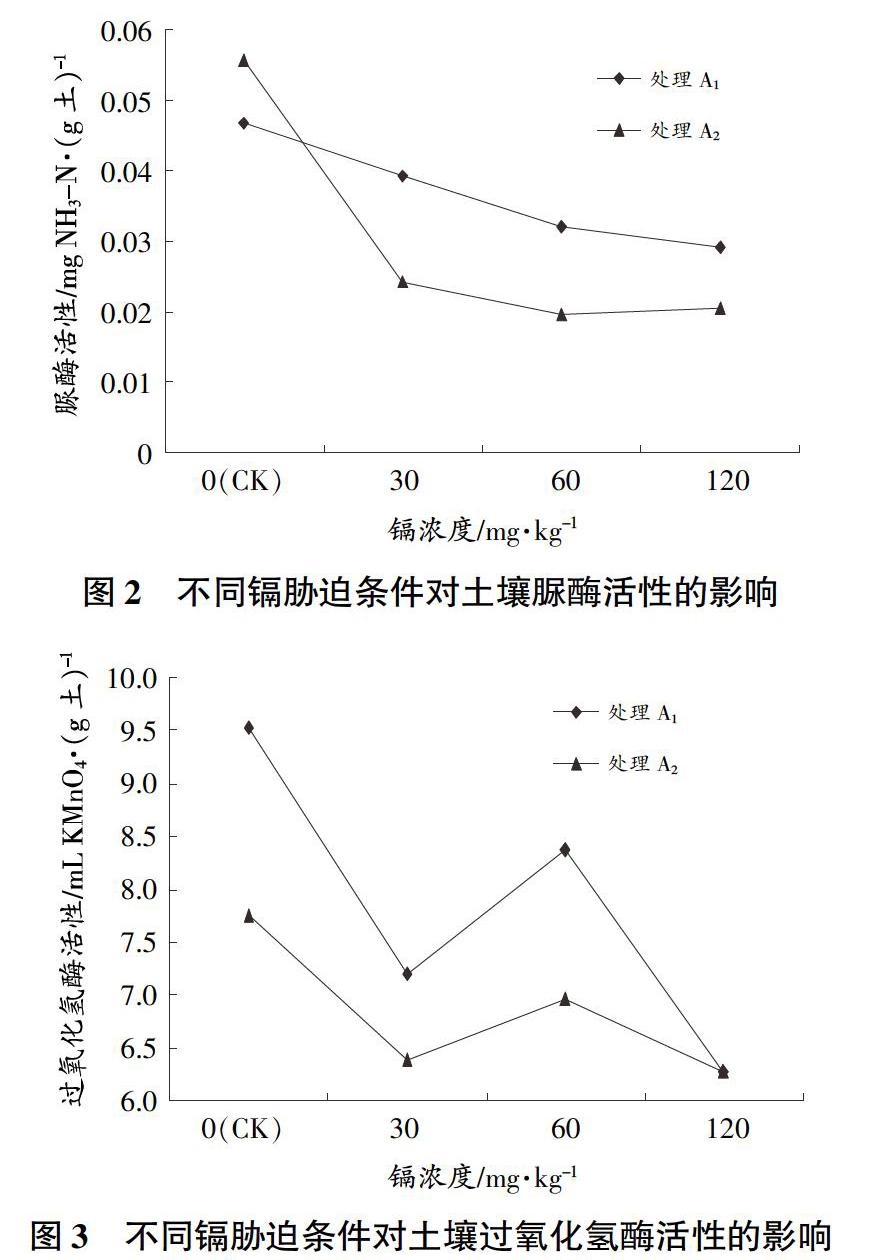
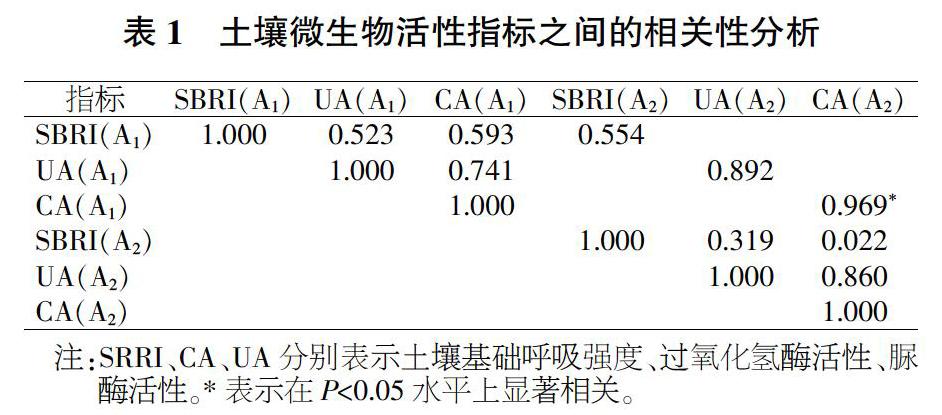
由图2、图3可知,镉胁迫对土壤酶活性具有明显的抑制作用,对不同土壤酶活性影响特征不同,而种植百日草能够提高土壤中的酶活性。比较不同镉胁迫水平对土壤脲酶、过氧化氢酶活性影响发现,镉对2种土壤酶活性抑制程度不同,随着镉浓度增加,土壤脲酶活性呈反比例函数型下降,土壤过氧化氢酶活性表现出正弦曲线变化规律。S1组土壤脲酶和过氧化氢酶活性明显小于CK,随着镉浓度增加,土壤酶活性降低速率减小,说明土壤酶活性对镉胁迫的响应比较敏感(尤其在低浓度条件下)。
2.3 镉胁迫下土壤微生物活性的相关性分析
由表1可知,在无百日草条件下,过氧化氢酶活性(CA)与脲酶活性(UA)相关性最高(r=0.860),其他微生物活性指标之间相关性较差,说明不同微生物活性指标受镉胁迫影响差异性较大,过氧化氢酶与脲酶活性受镉胁迫影响的相关性最高。种植百日草后,三者之间均表现较强相关性,表现为脲酶和过氧化氢酶活性相关性最高(r=0.741),土壤基础呼吸强度(SBRI)与脲酶活性的相关性最低(r=0.523),说明种植百日草后,不同微生物活性指标受镉胁迫影响的相关性会提高,百日草有改善土壤环境的作用。2种条件下的土壤基础呼吸强度、脲酶活性和过氧化氢酶活性的相关程度均较高,SBRI(A1)与SBRI(A2)、UA(A1)与UA(A2)和CA(A1)与CA(A2)的相关系数r分别为0.554、0.892和0.969,说明在有、无种植百日草2种条件下,镉胁迫对土壤微生物活性产生的影响相似。其中,过氧化氢酶活性的相关性达到了显著性水平(P<0.05),说明2种条件下的过氧化氢酶活性受镉胁迫的影响基本无差异。
3 结论与讨论
土壤基础呼吸是土壤生态系统碳循环的一个重要组成部分,对地球碳变化有着重要的影响,其呼吸强度是反应土壤污染程度的重要指标[26-27]。本研究表明,土壤基础呼吸强度、脲酶活性和过氧化氢酶活性与镉胁迫程度均大致成负相关,种植百日草能促进土壤基础呼吸强度、脲酶活性和过氧化氢酶活性。这与方 晰等[28]研究结果一致,可能是百日草通过富集作用降低了土壤中镉的含量,从而减少了镉对土壤基础呼吸强度的抑制作用。随着镉浓度增加,土壤脲酶活性呈反比例函数型下降趋势,土壤过氧化氢酶活性表现出正弦曲线变化规律,这可能与土壤酶类型及其受外界环境干扰强度有关。其中,脲酶是一种能催化土壤中尿素分解的胞外水解酶,其活性与土壤中有机质含量关系密切[29]。本试验中,土壤中的脲酶受到重金属的破坏,因而其活性表现为显著下降趋势。过氧化氢酶为胞内氧化还原酶,可分解土壤中的过氧化氢[30]。当重金属镉浓度过高时,土壤微生物死亡并破裂,将体内的过氧化氢酶释放到土壤中,导致过氧化氢酶活性升高,而释放到土壤中的过氧化氢酶受到高浓度镉毒害后,失去其活性,从而导致活性下降。不同微生物活性指标受镉胁迫影响的差异性较大,在无百日草条件下,过氧化氢酶与脲酶受镉胁迫影响的相关性最高;种植百日草条件下,镉胁迫对土壤微生物活性产生的影响与不种植百日草条件相似,其中2种条件下的过氧化氢酶受镉胁迫的影响基本无差异,这一结果与陈海燕等[31]的结果一致。
4 参考文献
[1] 环境保护部,国土资源部.全国土壤污染状况调查公报[N].中国国土资源报,2014-04-18(002).
[2] 吴训伟,金泰廙,叶葶葶,等.环境镉接触人群停止接触后肾损害预后研究[J].中国公共卫生,2001(10):19-21.
[3] 滕应.重金属污染下红壤微生物生态特征及生物学指标研究[D].杭州:浙江大学,2003.
[4] 陈玲玲.土壤酶活性对土壤重金属污染的指示研究[D].西安:西安科技大学,2012.
[5] 线郁,王美娥,陈卫平.土壤酶和微生物量碳对土壤低浓度重金属污染的响应及其影响因子研究[J].生态毒理学报,2014,9(1):63-70.
[6] 邓霞,崔东,王兴磊,等.伊犁煤矿土壤重金属累积对土壤酶活性的影响[J].环境化学,2018,37(7):1554-1564.
[7] HINOJOSA M B,GARC?魱A-RU?魱Z R,VI?魱EGLA B,et al.Microbiological rates and enzyme activities as indicators of functionality in soils affected by the Aznalcóllar toxic spill[J].Soil Biology & Biochemistry,2004,36(10):1637-1644.
[8] 张妍,崔骁勇,罗维.重金属污染对土壤微生物生态功能的影响[J].生态毒理学报,2010,5(3):305-313.
[9] 毛雪飞,吴羽晨,张家洋.重金属污染对土壤微生物及土壤酶活性影响的研究进展[J].江苏农业科学,2015,43(5):7-12.
[10] GIANFREDA L,SANNINO F,VIOLANTE A.Pesticide effects on the activity of free,immobilized and soil invertase[J].Soil Biology and Biochemistry,1995,27(9):1201-1208.
[11] 孙慧,张建锋,胡颖,等.土壤过氧化氢酶对不同林分覆盖的响应[J].土壤通报,2016,47(3):605-610.
[12] BROOKES P C,MCGRATH S P.Effect of metal toxicity on the size of the soil microbial biomass[J].European Journal of Soil Science,1984,35(2):341-346.
[13] 高焕梅,孙燕,和林涛.重金属污染对土壤微生物种群数量及活性的影响[J].江西农业学报,2007,19(8):83-85.
[14] GAO Y,MIAO C,XIA J,et al.Plant diversity reduces the effect of multiple heavy metal pollution on soil enzyme activities and microbial community structure[J].Frontiers of Environmental Science & Engineer-ing,2012,6(2):213-223.
[15] 杨志新,冯圣东,刘树庆.镉、锌、铅单元素及其复合污染与土壤过氧化氢酶活性关系的研究[J].中国生态农业学报,2005,13(4):138-141.
[16] 高秀丽,邢维芹,冉永亮,等.重金属积累对土壤酶活性的影响[J].生态毒理学报,2012,7(3):331-336.
[17] 牛昌美,杨兰芳,彭小兰,等.土壤加砷对大豆叶绿素、脯氨酸和过氧化氢酶活性的影响[J].湖北大学学报(自然科学版),2013,35(3):283-299.
[18] 于小飞.镉污染对能源植物土壤微生物的影响[D].北京:华北电力大学(北京),2010.
[19] 何淼,周海军,张文霞,等.土壤中镉、铅对百日草种子萌发及生长的影响[J].吉林农业科学,2010,35(3):9-11.
[20] 向涛.草本花卉对镉污染土壤修复研究[D].重庆:重庆大学,2014.
[21] 贾永霞,张春梅,方继宇,等.细叶百日草对镉的生长响应及富集特征研究[J].核农学报,2015,29(8):1577-1582.
[22] 蒋兴一,李景吉,钱美玲.三种菊科草本植物对重金属Cd污染土壤的修复效应实验研究[J].四川环境,2017,36(5):29-33.
[23] 许光辉,郑洪元.土壤微生物分析方法手册[M].上海:上海科技出版社,1986:226-228.
[24] 姚槐应,黄昌勇.土壤微生物生态学及其实验技术[M].北京:科学出版社,2006:188-189.
[25] 李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008:398-399.
[26] BAATH E.Effects of heavy metals in soil on microbial processes and populations(a review)[J].Water,Air & Soil Pollution,1989,47(3-4):335-379.
[27] ZAK D R.Elevated atmospheric CO2 and feedback between carbon and nitrogen cycles[J].Plant Soil,1993,151(1):105-117.
[28] 方晰,田大伦,武丽花,等.植被修复对锰矿渣废弃地土壤微生物数量与酶活性的影响[J].水土保持学报,2009,23(4):221-226.
[29] 刘淑英.不同施肥对西北半干旱区土壤脲酶和土壤氮素的影响及其相关性[J].水土保持学报,2010,24(1):219-223.
[30] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[31] 陈海燕,樊霆,张泽,等.不同植物修复重金属复合污染土壤對土壤中微生物数量与酶活性的影响[J].环境保护,2018,46(1):65-69.

