白及胶的提取及含量测定
徐玲玲, 赵明阳,2, 张 倩, 张 焱
(1.西安文理学院 生物与环境工程学院植物微生物协同研究实验室,西安 710065;2.陕西理工大学 生物科学与工程学院,陕西 汉中 723000)
中药白及(Bletillastriata)为兰科植物的块茎,用药历史久远,主要产地有贵州、广西、安徽、陕西、甘肃等.白及在临床和工业上的广泛应用,使得市场需求量大大增加,但野生白及资源因采挖日趋减少,价格急剧上涨[1-3].
现代研究表明白及的主要药用成分为白及胶[4],又称为白及多糖,白及胶是评估白及品质的重要参考依据[5],不同生长阶段和地区白及球茎白及胶含量不同[6-7].因此,随着白及产业的发展,提取和测定白及胶含量是探究白及品质的必要技术,因此建立白及胶提取和测定方法体系,是白及产业持续稳定发展的基础.
白及胶的提取有多种方法,如传统水提法、超声波法、碱水提法、纤维素酶解法[8-13].其中超声波法提取率最高,且用时最短,是最优选[5,8].超声波提取法与热水提取法相比,白及胶的得率和纯度与热水提取法相近,但是缩短了提取时间,减少了提取液的用量,从而降低了成本.而且加大超声功率更有助于白及胶从细胞中释放、溶出.测定白及胶含量的方法有蒽酮硫酸法和苯酚硫酸法,蒽酮硫酸法较苯酚硫酸法试剂更加简单,所以采用蒽酮硫酸法[14-17].
本研究以非常适合陕西省规模化种植且价格高、市场前景好的兰科中药白及作为研究对象,采用超声波提取的方法,通过对栽培一年和两年的白及块茎中的白及胶进行提取,并用蒽酮-硫酸比色法测定其白及胶含量,建立一套完善的白及胶提取和含量测定方法体系,为白及产业的持续稳定发展打下基础.
1 实验材料和试剂
栽培一年和两年的白及块茎是2016年10月采集于陕西省安康市旬阳县白及驯化基地内.
使用的试剂有85%乙醇、95%乙醇、无水乙醇、重蒸水、氯仿、正丁醇;D-无水葡萄糖对照品、蒽酮、浓硫酸.
2 实验方法与步骤
2.1 白及块茎的预处理
将采集的一年生和两年生白及块茎用自来水冲洗干净,剪掉多余的根只留下块茎.将白及块茎切成厚度约为2~3 mm的薄片,烘箱中烘干至恒重.用研钵分别把烘干的白及碾碎成粉末状,放入离心管中编号保存在干燥器中.准确称取1.0 g白及粉末,加入85%乙醇进行加热回流,乙醇与白及粉末比例为1∶15,温度为100 ℃,每次1 h,重复2次.将加热回流的混合液置于布氏漏斗进行抽滤,弃去提取液,残渣置于烘箱中烘干备用.目的是除去白及块茎中的醇溶性杂质,降低后续醇沉过程中白及胶中的杂质的含量.
2.2 超声波法提取白及胶
将预处理所得白及粉末置于50 mL锥形瓶中,保鲜膜封口,放入超声清洗机中超声提取.提取温度为80 ℃,频率为100 Hz,每次30 min,重复3次.抽滤,合并抽滤得到的滤液.将上步所得的滤液,放入圆底烧瓶中旋转蒸发.温度为80 ℃,转速80 r/min,浓缩至黏稠,得到浓缩液.用Sevag法去除浓缩液中的游离蛋白.加入氯仿-正丁醇混合液(浓缩液∶氯仿∶正丁醇=25∶5∶1),剧烈震荡后静置30 min使反应充分,然后6 000 r/min离心5 min,重复6次,弃沉淀,合并上清液.将上清液置于圆底烧瓶,旋转蒸发至黏稠.温度为40 ℃,转速80 r/min,得到浓缩液.向浓缩液中加入3倍体积的95%乙醇,析出大量白色絮状沉淀,静置过夜,使沉淀完全.抽滤后将沉淀物置于烘干箱60 ℃中真空干燥,即得白及胶.
2.3 标准曲线的绘制
精确称取蒽酮0.2 g,用浓硫酸溶解并于100 mL容量瓶定容,临用时配制.精密称取D-无水葡萄糖对照品17.5 mg,加水溶解并置于100 mL容量瓶定容,摇匀即得葡萄糖对照品溶液.分别于10 mL刻度试管中依次加入精密量取的葡萄糖对照品溶液0,0.05,0.1,0.2,0.4,0.6,0.8,1.0 mL,并加蒸馏水至2 mL.将刻度试管置于冰水浴中,精密加入蒽酮-硫酸试液4.5 mL,混匀后一起置沸水浴中加热3 min,取出后立即置流水中冷却10 min,以葡萄糖浓度为零的试液为空白.在625 nm 波长处测定吸光度.以吸光度为纵坐标,对照品质量为横坐标,绘制标准曲线.
2.4 白及胶换算因子供试品溶液的制备与吸光度测定
精密称取60 ℃干燥至恒重的一年生、两年生白及胶各21.42 mg,分别置于100 mL容量瓶中,加水溶解并稀释至刻度,摇匀.精密量取该液5 mL,置10 mL容量瓶中,加水稀释至刻度,摇匀,作为白及胶供试品溶液.按照2.3标准曲线绘制中标准曲线的制备方法进行吸光度的测定.
2.5 白及胶含量测定供试品溶液的制备与吸光度测定
精密称取白及粉末0.2 g,置于100 mL锥形瓶中,精密加蒸馏水50 mL,称重,加热回流1 h.保鲜膜封口,放入超声清洗机中超声提取.提取温度为80 ℃,频率为100 Hz,每次30 min,重复3次.抽滤,合并抽滤得到的滤液.精密量取续滤液5 mL于50 mL离心管中,加入30 mL无水乙醇,吸打混匀后静置1 h,3 000 r/min离心15 min,弃去上清液,留沉淀.挥散残留乙醇后,沉淀用热水溶解,置于100 mL容量瓶定容,即得供试品溶液.按照2.3绘制标准曲线的制备方法进行吸光度的测定.
3 实验结果
3.1 葡萄糖标准曲线的建立
根据2.3标准曲线绘制项下,每个梯度所加的标准液毫升数,计算出每个梯度中对应的葡萄糖质量数(mg)作为横坐标,以分光光度计测定的吸光度OD值为纵坐标,具体数据如表1所示,用Excel 2010建立葡萄糖标准曲线如图1所示,得到线性回归方程为y=6.737x+0.001 4,R2=0.998接近1,线性关系良好.

表1 葡萄糖标准曲线数据测量
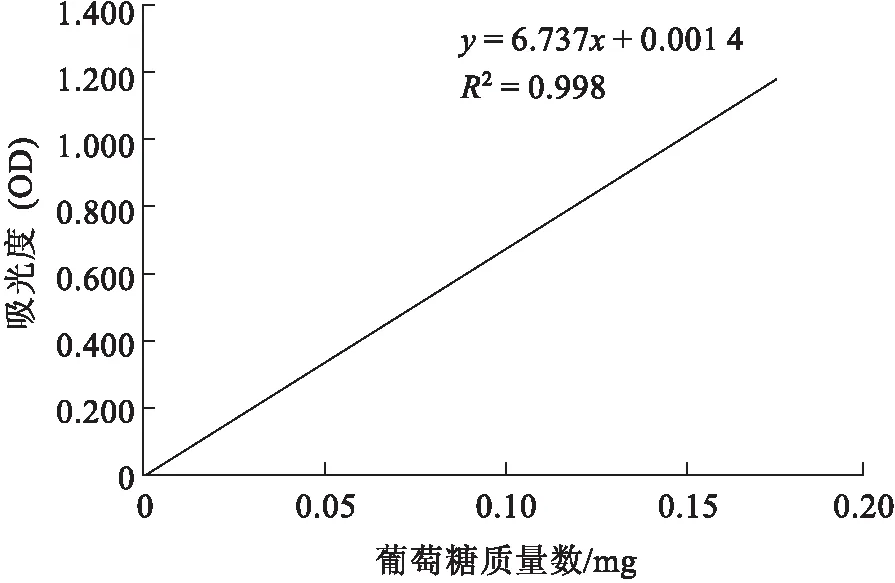
图1 葡萄糖标准曲线
3.2 供试品溶液吸光度
按照2.3标准曲线绘制中标准曲线的制备方法进行吸光度的测定,分别得到一年生、两年生白及换算因子供试品和含量测定供试品溶液的吸光度如表2所示.

表2 供试品溶液吸光度
3.3 计算换算因子f
按照计算换算因子公式:f=W/C,计算换算因子.式中:W为白及胶质量数(mg),C为葡萄糖质量数(mg).从2.4中供试品溶液配制得出W=1.671 mg,按照表2中换算因子供试品溶液测出的吸光度值,代入回归方程中的y值,所计算出的x值即为C;C1=0.09 5,C2=0.060 8(C1为一年生白及,C2为两年生白及).将W值和C值代入f=W/C,得f1=1.789 0,f2=2.748 4(f1为一年生白及换算因子,f2为两年生白及换算因子).
3.4 白及中白及胶含量计算
将表2中的含量测定供试品溶液测出的吸光度值代入回归方程中的y,算出相应葡萄糖质量数为:X1=0.061 6,X2=0.050 7(X1为一年生,X2为两年生).白及胶含量百分比=f×X×100%,一年生白及中白及胶含量为11.02%,两年生白及中白及胶含量为13.93%.
4 讨论
本研究采用超声波提取的方法,通过对一年生,两年生的白及块茎中的白及胶进行超声提取,并用蒽酮-硫酸比色法测定一年生、两年生白及块茎中白及胶含量,其中一年生白及块茎中白及胶含量为11.02%,两年生白及块茎中白及胶含量为13.93%.在一定的生长年限内,随着白及生长年限的增加,块茎中白及胶的含量随之增加,但是随着年限不断增加白及块茎中白及胶的含量是否增加还有待继续研究.
超声法提取粗白及胶之后,抽滤时,黏性较大,黏附在滤纸上的提取液较多,可能造成白及胶损失量大,最终测定白及胶浓度过小的结果.为解决这一问题,应在白及胶含量测定这一部分进行改进.在超声提取之前,可以考虑使用果胶酶对药材进行处理来降低粘度,再进行白及胶的提取.白及胶的含量在不同年限的白及块茎中含量不同,且三年生白及中白及胶含量最高,按含量大小两年生次之,一年生再次,四年生最低[6].本研究中,研究对象白及年限只有一年生和两年生块茎.只能证明一定生长时间内白及块茎中白及胶含量的大体趋势,后续实验可采集三年生、四年生白及块茎探讨白及整个生长阶段中,白及块茎中的白及胶含量与生长时间的关系.

