玉屏风多糖对小鼠肠黏膜免疫应答和免疫损伤的调控作用
邓 桦,杨 鸿,蒋焱平,陈 刚,王少杰,周兆海,梁浩钊,卢玉葵
(佛山科学技术学院生命科学与工程学院,广东 佛山 528231)
黏膜免疫系统是由呼吸道、胃肠道和泌尿生殖道等黏膜相关淋巴组织共同构成的相对独立的免疫体系,是机体免疫系统的重要组成部分。肠黏膜免疫系统具有特殊结构,直接参与和调控肠黏膜的免疫应答,并可由此介导共同黏膜免疫调节和全身免疫反应,具有重要的免疫功能[1-2]。中药多糖可以明显改善和增强肠黏膜免疫功能,保护和修复处于病变和应激状态的肠黏膜免疫屏障[3-4]。玉屏风散由黄芪(Astragalusmembranaceus(Fisch.) Bunge)、白术(Atractylodesmacrocephala)和防风(Saposhnikoviadivaricata(Trucz.) Schischk.)组方而成,是提高机体免疫力的代表方剂。玉屏风多糖(Yupingfeng poly-saccharides,YPF-P)为其有效部位群,是该方剂临床药效的主要物质基础。本项目组前期研究证实,玉屏风多糖对特异性和非特异性免疫功能均有显著的增强作用[5-6],但迄今鲜见其对肠黏膜免疫系统调控作用的研究报道。
肠黏膜免疫反应的诱导部位为肠上皮细胞(intestinal epithelial cell,IEC)和肠黏膜下集合淋巴结(Peyre's Patch,PP结),PP结是诱导免疫应答的主要部位,肠上皮细胞除具有吸收各种抗原的功能外,还具有摄取和释放分泌型IgA(Secretory IgA,SIgA)、提呈抗原、分泌细胞因子等多种功能。肠上皮细胞间淋巴细胞(intraepithelial lymphocytes,IELs)和黏膜固有层淋巴细胞(lamina propria lymphocytes,LPLs)则是肠黏膜免疫的主要效应部位[7]。
SIgA是肠黏膜免疫主要效应因子,是黏膜免疫应答的标志指标[8]。IL-2(interleukin-2,IL-2)是机体正常免疫功能的关键和免疫调节的中心,IL-6能够刺激参与免疫反应的细胞增殖、分化并提高其功能。TGF-β1(transforming growth factor-β1,TGF-β1)可促进B细胞发生IgA类型转换,促进SIgA的分泌,并可通过对IL-6基因转录的调节,促进IL-6的产生。升高IL-2等相关细胞因子可以保护肠黏膜免疫屏障,促进受损肠黏膜免疫屏障的恢复[9]。
试验以黄芪多糖(Astragalus polysaccharides,APS)为对照药物,以正常小鼠和免疫抑制小鼠为动物模型,通过研究口服多糖对肠黏膜诱导部位的激活、效应因子SIgA的分泌、肠黏膜效应部位的反应以及全身免疫应答的联系,探讨玉屏风多糖对小鼠肠黏膜免疫应答和免疫损伤的调控效应,为玉屏风多糖的临床应用提供理论支撑与试验依据。
1 材料与方法
1.1 药物与试剂 玉屏风散配方依据《中国药典》,黄芪、白术和防风按照3∶1∶1质量配方。以L9(34)正交实验优选提取工艺,水提醇沉法提取多糖,使用AB-8大孔树脂纯化精制,旋转蒸发仪浓缩,真空冷冻干燥,高效液相色谱法鉴定。所得玉屏风多糖含量为90.75±2.3%,黄芪多糖的含量为90.68±5.1%。
环磷酰胺(Cyclophosphamide,CY),德国Baxter Oncology GmbH,批号5H072A;Mouse SIgA ELISA Kit(武汉华美公司,批号 B10014455);细胞因子试剂盒为ExCell Biology Inc.公司产品,Mouse/Rat TGF-β1 ELISA Kit(批号21G037),Mouse IL-2 ELISA Kit(批号21F287),Mouse IL-6 ELISA Kit(批号21F361)。
1.2 动物模型分组处理 150只SPF级NIH小鼠由广东省动物实验中心提供,实验动物许可证号SCXK(粤)2013-0002。随机分为5组,每组30只,雌雄各半。空白对照组(blank control,BC组):灌服生理盐水;CY免疫抑制对照(negative control,NC组):生理盐水+CY;YPF-P治疗组(YPF-P treatment,T组):YPF-P+CY;YPF-P对照组(positive control,PC组):仅给药YPF-P;黄芪多糖对照组(APS control,AC):仅给药黄芪多糖。多糖剂量均为200 mg/Kg/d,每天禁水禁食4 h后灌胃给药,连续7 d;CY剂量为80 mg/Kg,隔日腹腔注射。给药剂量和时间参照课题组前期试验结果[5-6]。
1.3 IL-2、IL-6、TGF-β1和SIgA的检测 小鼠摘眼球采血,分离血清,-20 ℃保存,用以检测IL-2、IL-6、TGF-β1。取全段小肠,PBS冲洗,收集冲洗液,离心,取上清,-20 ℃保存,用以检测SIgA。样品均采用双抗体夹心ELISA方法,按试剂盒说明书检测。酶标仪450 nm波长测定吸光度(A)值,绘制标准曲线,根据标准曲线计算各指标浓度。
1.4 小肠及肠黏膜相关淋巴组织形态结构的观察
分离十二指肠、空肠、回肠和PP结,取材,中性福尔马林溶液固定,常规石蜡切片,苏木素-伊红(H.E)染色。采用病理图像分析系统测量各组十二指肠、空肠、回肠的小肠形态结构特征与变化。每组各肠段选取6张切片,每张切片随机选取10个视野,于放大倍数100×,测量小肠绒毛长度和隐窝深度,计算肠绒毛长度与隐窝深度的比值(length villus / intestinal crypt,V/C),于放大倍数400×,计数各段小肠上皮内淋巴细胞和黏膜固有层淋巴细胞数量。
2 结果与分析
2.1 SIgA的变化 由图1可知,PC组和AC组SIgA含量增加最为明显,显著高于其他各组(P<0.01);NC组SIgA含量为所有组别中最低,显著低于BC组(P<0.05);T组与NC组相比,SIgA含量显著增高(P<0.05),回复正常水平。
2.2 TGF-β1的变化 由图1可知,与BC组相比,PC组增高最为显著(P<0.01),AC组也有明显增高(P<0.05),NC组显著降低(P<0.05);与NC组比较,T组显著增高(P<0.05),回复正常水平。
2.3 IL-6的变化 由图2可知,与BC组相比,除NC组呈上升趋势外,其余各组IL-6水平均明显升高(P<0.01)。
2.4 IL-2的变化 见图2。PC组增高最为显著,其次为AC组,与BC组相比均为P<0.01,NC组和T组则显著降低(P<0.05);T组与NC组比较,虽略有上升但未见统计学差异。
2.5 小肠黏膜相关淋巴组织的变化 结果见表1、表2和图3。玉屏风多糖和黄芪多糖给药后,PC组和AC组小鼠十二指肠、空肠和回肠肠壁增厚,肠绒毛长度、宽度和隐窝深度均显著增加(P<0.05);肠上皮细胞增生,杯状细胞增多,中央乳糜管扩张,内有多量淋巴细胞;肠绒毛长度与隐窝深度的比值V/C升高(P<0.05或P<0.01)。隐窝内潘氏细胞(Paneth cell)体积增大,嗜酸性颗粒增多。肠上皮细胞间淋巴细胞IELs和黏膜固有层淋巴细胞LPLs数量明显增多(P<0.05或P<0.01)。PP结显著增生,体积增大,生发中心明显。二者之间比较,玉屏风多糖对小肠黏膜相关淋巴组织的影响较黄芪多糖更为显著。
NC组免疫抑制小鼠肠壁变薄,PP结明显萎缩变小。肠绒毛长度、宽度和隐窝深度下降,V/C下降(P<0.05或P<0.01),IELs和LPLs数量显著减少(P<0.01)。T组上述各项指标均较NC组上升(P<0.05或P<0.01)。

同列数据右上标小写字母不同者表示P<0.05,大写字母不同者表示P<0.01,下同Different lowercases in the same column indicated P<0.05; different cap-ital letters in the same column indicated P<0.01,the same as follows

组别十二指肠/μm空肠/μm回肠/μm绒毛长度隐窝深度V/C绒毛长度隐窝深度V/C绒毛长度隐窝深度V/CBC361.1±33.3Aa67.8±3.2a5.2±0.6a325.4±33.2ADa72.1±5.8a4.5±1.3a218.2±21.5Aa68.7±9.2a3.2±0.4AaNC210.6±20.5B45.5±6.8b4.6±0.5b196.2±26.8B40.7±3.4b4.9±0.6a170.1±16.2B41.2±6.8b4.1±0.2AbT321.1±25.4Ab58.1±5.2c5.5±0.3a289.4±16.3DCb48.9±6.1b5.8±1.2a192.8±19.1B45.3±7.1b4.2±0.3AbPC402.5±17.2C63.6±7.0ac6.5±0.8c415.4±17.2Ab62.7±3.8a6.7±0.4b347.5±21.2C60.8±7.8a5.8±0.5CaAC413.7±32.6C65.8±9.2ac6.6±1.4c395.3±20.2Ab70.1±5.2a5.9±1.1a323.7±20.5C72.4±9.5a4.7±0.6ACb

表2 小鼠小肠IELs和LPLs的变化(n=6)Tab 1 Changes of IELs and LPLs in mice
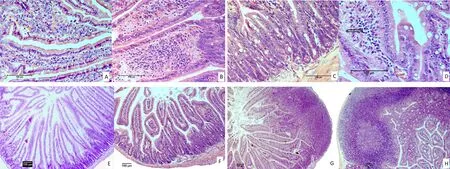
A. AC组回肠;B. PC组回肠;C. PC组隐窝;D. PC组中央乳糜管;NC组空肠;F. T组空肠;G. NC组PP结;H. T组PP结A. AC group ileum;B. PC group ileum;C. PC group crypt;D. PC group central lacteal;E. NC group jejunum;F. T group jejunum;G. NC group Peyre's Patch;H. T group Peyre's Patch图3 小鼠小肠黏膜相关淋巴组织的形态学变化(H.E,标尺100 μm)Fig 3 Histological changes of gut-associated lymphoid tissue in mice(H.E Staining, scale bar: 100 μm)
3 讨论与结论
3.1 玉屏风多糖可增强小鼠肠黏膜SIgA的分泌,缓解环磷酰胺导致的SIgA含量下降 SIgA是肠黏膜免疫主要效应因子,是肠黏膜免疫的重要免疫屏障,因此提高SIgA含量对于维持肠黏膜免疫功能具有重要意义[8-9]。试验结果表明,玉屏风多糖和黄芪多糖均可通过提升SIgA含量来增强正常小鼠的肠黏膜免疫功能,具有明显的免疫促进作用。免疫抑制剂环磷酰胺可导致小鼠肠SIgA含量显著减少,降低肠黏膜免疫功能,玉屏风多糖有效拮抗环磷酰胺的这一作用,恢复并提高小鼠肠SIgA含量。
3.2 玉屏风多糖可影响细胞因子的分泌,调节Th1/Th2平衡漂移 正常机体中辅助性T淋巴细胞亚群Th1/Th2 细胞处于平衡状态,当机体发生免疫功能异常时,Th1/Th2发生漂移,平衡失调。Th1/Th2 的变化影响细胞因子网络的平衡,与诸多疾病的发生、发展和转归关系密切[10]。
试验结果发现,对于正常小鼠,玉屏风多糖作用后,Th1细胞因子IL-2、TGF-β1和Th2细胞因子IL-6水平均显著上升,Th1/Th2 上调,在高水平上达到新的平衡,提示玉屏风多糖可明显增强小鼠T、B淋巴细胞的活化增殖,促进SIgA的分泌。在免疫抑制小鼠,IL-2和TGF-β1显著降低,而IL-6虽未出现显著性变化,但呈现升高的趋势,Th1/Th2向Th2漂移,免疫应答失调。结合文献分析[11-12],提示玉屏风多糖可通过上调IL-2和TGF-β1水平,调节Th1/Th2 漂移状态,缓解环磷酰胺所致的免疫损伤。
3.3 玉屏风多糖可保护肠黏膜免疫屏障的完整性,增强肠黏膜免疫功能 肠上皮细胞、上皮细胞间淋巴细胞(IELs)、黏膜固有层淋巴细胞(LPLs)、肠黏膜下集合淋巴结(PP结)以及黏膜组织内各种单核淋巴细胞共同构成了完整的肠黏膜免疫屏障。肠上皮细胞参与SIgA的分泌,并有效转运SIgA从黏膜固有层进入肠腔,还产生大量参与黏膜免疫调节的细胞因子,肠上皮细胞与杯状上皮细胞分泌的黏液组成机体与外界的第一道屏障。PP结是肠黏膜免疫应答的诱导和活化部位;IELs被激活后可释放IL-2和干扰素-ɑ、γ等多种细胞因子,参与机体免疫监控和免疫防御;LPLs包括B、T淋巴细胞、浆细胞和巨噬细胞等,可分泌IgA和IgM[1,13]。
试验结果证实,玉屏风多糖和黄芪多糖对肠黏膜免疫应答的诱导部位和效应部位作用明显,小鼠肠上皮细胞增生,杯状细胞增多,肠绒毛长度、宽度和隐窝深度均显著增加,肠上皮细胞间淋巴细胞和黏膜固有层淋巴细胞数量明显增多,PP结体积增大,淋巴细胞增生。与黄芪多糖比较,玉屏风多糖对肠黏膜免疫屏障各项指标的影响更为明显。而免疫抑制小鼠肠黏膜免疫屏障的损伤,可被玉屏风多糖有效缓解和改善。
综上所述,玉屏风多糖对肠黏膜诱导部位(IEC和PP结)的激活、效应因子SIgA的分泌、肠黏膜效应部位(IELs和LPLs)的反应以及全身免疫应答(血清IL-2、IL-6和TGF-β1)影响明显,可从多方面调控小鼠肠黏膜的免疫应答,增强肠黏膜免疫功能,并可有效缓解和改善免疫抑制小鼠肠黏膜免疫屏障的损伤。

