儿童牛奶过敏性特应性皮炎全基因组DNA甲基化特点*
谢芸芸 ,曾弘华 ,黄伟 ,刘冬梅 ,邱晓露 ,周顺龙 ,李守明
(1.江西省儿童医院儿童保健科,南昌 330006;2.江西省丰城市剑光医院,丰城 331100;3.江西省儿童医院检验科,南昌330006;4.江西省儿童医院皮肤科,南昌 330006)
特应性皮炎(Atopic Dermatitis,AD)病因复杂,与遗传、环境因素、感染、皮肤屏障功能异常、Th1/Th2失衡及神经免疫异常等多种因素有关[1]。实验和调查证实,至少35%-60%的特异性皮炎是由食物过敏引起的[2],对于食物过敏导致AD的原因已经有足够证据表明与遗传因素有关。研究也发现基因的多态性与AD密切相关,如FLG(Filaggrin gene)。由安徽医科大学张学军教授领衔的皮肤病遗传学研究团队联合上海交通大学附属新华医院、德国基尔大学等国内外30多家单位攻关,采用全基因组关联研究方法,对近2万例特应性皮炎患者和健康对照者进行易感基因研究,在人类基因组2个区域内发现了与该病发病密切相关的4个易感基因,即5号染色体区域的TMEM232和SLC25A46;20号染色体区域的 TNFRSF6B和ZGPAT;同时证实了既往在欧洲和亚洲人群中曾报道的易感基因FLG[3,4]。但单基因似乎不足以完美地解释这类AD产生的深层次原因,另一方面近年发展的表观遗传学为我们提供了一个令人兴奋的方向,表观遗传是一种不改变DNA序列的、可以遗传的基因表达模式,表观遗传学的改变不仅在出生前或后就能发生,而且在以后的发展时期也能出现,在整个生命过程中,都影响基因表达,因此,表观遗传调控为早期暴露后病情发展的相关分子事件提供了一个机制的解释[5]。DNA甲基化和染色体的修饰是两种重要的表观遗传方式,我们检测了儿童牛奶过敏性特应性皮炎的全基因组DNA甲基化情况,现报道如下。
1 材料与方法
1.1 病例收集和分组 在病人知情同意下选择患者及对照组(n=30),AD患者年龄均为<1岁,按照文献[6,7]方法进行临床试验病例的筛查。按临床表现瘙痒、红斑、浮肿、脱皮和结痂程度分为对照组(无症状,n=30),实验组 1(轻度症状,n=30),实验组 2(中度症状,n=30),实验组 3(重度症状,n=30)四个组,抽取静脉血做免疫学检查和甲基化检测。
1.2 AD患儿与食物过敏关系的判断 参照文献[8]方法进行荧光酶标法来检测病人血清中对食物特异性IgE水平,IgE水平0.35kUA/L以上为阳性。
1.3 病例选择和分类 参照文献[9]方法对病例进行选择性分类:牛奶过敏病例:IgE水平>15kUA/L或<1岁儿童IgE水平超过5kUA/L入选本项研究对象。
1.4 方法 病例进行分类后分组后检测外周血的DNA甲基化程度:采用血液DNA提取试剂盒(德国Qiagen公司)提取全血DNA,按照说明书进行。采用整体甲基化定量试剂盒 (P-1014,美国Epigentek公司),该试剂盒基于ELISA的原理,甲基化水平与吸光度(A)值的高低成正比。DNA甲基化的程度采用如下公式计算:相对甲基化水平=A(样本-阴性对照)/2×A(阳性对照-阴性对照)。 其中阴性对照含有50%的胞嘧啶,阳性对照含有50%的5-甲基胞嘧啶。
RT-PCR检测DNMT 1表达:利用淋巴细胞分离液从全血中分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC),Trizol(日本 Takara公司)一步法提取PBMC总RNA,定量后取1 xg进行反转录反应(D6110A试剂盒,日本Takara公司)。DNMT l及GAPDH由上海生物工程有限公司合成。引物序列及反应条件见表1,PCR反应依据北京百泰克生物技术有限公司2 X Power Taq PCR Master Mix试剂盒说明书进行。取扩增产物5μl行1.5%琼脂糖凝胶电泳,凝胶成像系统拍照。
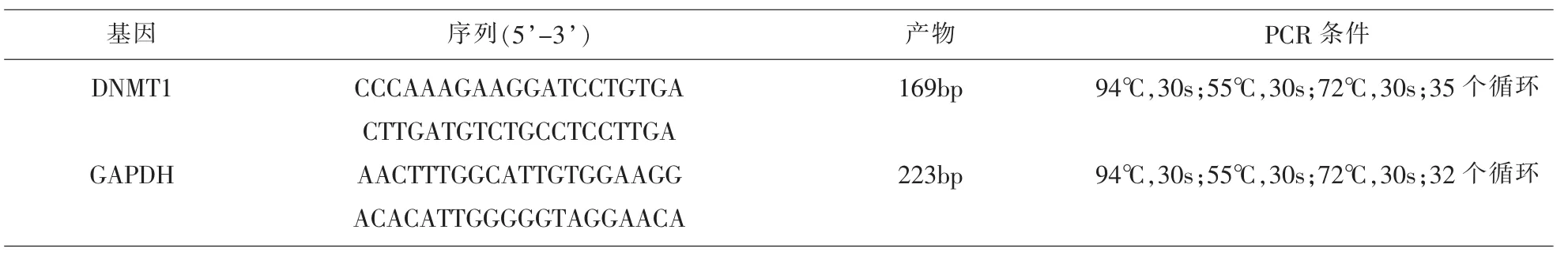
表1 PCR引物及序列
2 结果
2.1 牛奶过敏儿童外周血全基因组DNA甲基化程度 结果见图1。
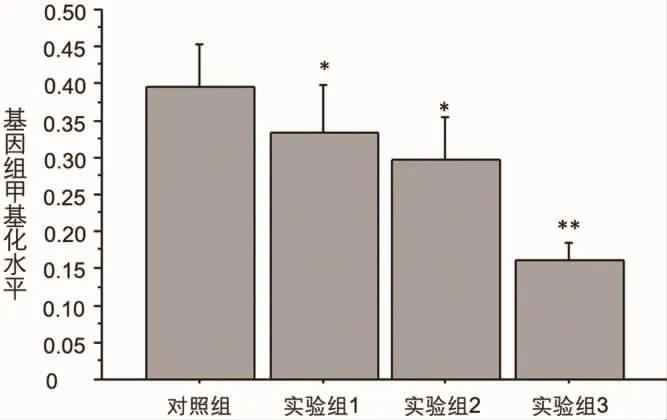
图1 牛奶食物过敏儿童全血基因组DNA甲基化水平
上图可见,牛奶过敏儿童随着症状加重全血基因组DNA甲基化水平逐渐下降,实验组1和实验组2与对照组比较差异显著(P<0.05),实验组3(重症组)与正常对照组比较有极显著差异 (P<0.01)。
2.2 牛奶过敏儿童PBMC中DNMT 1表达变化DNMT 1是甲基化转移酶,牛奶过敏儿童PBMC中DNMT 1表达变化见下图2所示。上述结果可见,特应性皮炎儿童随症状程度的增加,DNMT1表达下降。
3 讨论

图2 牛奶过敏儿童PBMC中DNMT 1表达的变化
特应性皮炎是一种常见的慢性复发性炎症性疾病[12],15%-30%的儿童,2%-10%的成人受到影响,主要症状有剧烈的瘙痒、湿疹样皮损、干皮症等。AD影响12-15%的儿童,对儿童的影响包括使儿童睡不着(restless)/感到沮丧(frustrated)、影响儿童的社会化技能(social skills),导致与其他人交流退缩或缺乏,并带来潜在的心理问题,而且影响患病儿童和家长的关系。另外,AD患儿家长更感到苦恼、疲惫以及承受更大的经济负担,解决这部分患者病痛显得日益紧迫。
环境或其他多种因素会影响本病的发生,目前食物过敏成为本病高发原因[10,11],而近年发现表观遗传是食物过敏的产生机制之一[13,14]。在牛奶过敏(CMA)期间,Th1和Th2细胞因子基因的DNA甲基化发生改变[15]。关于过敏相关表型的表观遗传学研究也在日益增多,主要集中在DNA甲基化上[16]。综上所述,表观遗传学既是食物过敏的重要知识缺口,又是食物过敏研究中有前途的研究领域。由于食物过敏的早期发病,前瞻性的表观遗传学研究有可能更好地理解食物过敏在关键发育窗口(先孕、子宫和儿童早期)期间的基因-环境相互作用和潜在的生物学机制,并可能导致食物过敏诊断、预防和管理方面的新范例,并为食物过敏的未来药物发现和治疗提供新的靶点。我们的研究也发现,过敏程度与全血中DNA甲基化水平下降呈一致性,过敏儿童PBMC中DNMT1的表达显著降低可能是导致血液中全基因组DNA甲基化水平下降的原因。在今后工作中有必要进一步关注患儿血液DNA甲基化的水平,以指导临床诊治。

