瞬时受体电位通道在疼痛中作用的研究进展
张 俊,宋必卫
(1.浙江中医药大学附属第二医院,浙江杭州 310005;2.浙江工业大学药学院,浙江 杭州 310014)
瞬时受体电位(transient receptor potential,TRP)通道由700~2000个氨基酸残基组成,是位于细胞膜或胞内细胞器膜上的一类重要的非选择性阳离子通道。TRP通道最早发现于果蝇的视觉系统,因突变体果蝇对持续的光刺激只产生瞬时而非持续的锋电位而得名[1]。至今已在哺乳动物中发现28个TRP通道家族成员,根据氨基酸序列同源性不同,TRP通道分为TRPA〔锚蛋白(ankyrin)家族,1个成员〕、TRPC〔经典(canonical)家族,7个成员〕、TRPP〔多囊蛋白(polycystin)家族,3个成员〕、TRPM〔前列腺特异性基因黑素抑素(melastatin)家族,8个成员〕、TRPML〔黏脂蛋白(mucolipin)家族,3个成员〕和TRPV〔香草醛类(vanilloid)受体家族,6个成员〕6个亚族[2]。TRP通道参与人体多种重要的生理病理过程,如心血管、神经、炎症、代谢和肿瘤等[3]。近年来,有关TRP通道的研究越来越受到人们的广泛关注,已成为离子通道领域研究的焦点之一。
国际疼痛研究联合会(International Associa⁃tion for the Study of Pain)将疼痛定义为组织损伤或潜在组织损伤所引起的不愉快感觉和情感体验。疼痛的发生是由各种伤害性刺激(热、化学和机械刺激等)通过激活背根神经节(dorsal root ganglion,DRG)和三叉神经节(trigeminal ganglion,TG)中的疼痛感受器,并将其转换为神经冲动,经外周传入神经的Aδ和C纤维传入中枢神经系统,最后在大脑皮质整合而成[4]。近年来,诸如TRP通道、ATP、酸敏感离子通道和压电离子通道等已被证实与疼痛相关[5]。在这些通道中,研究最热门的当属TRP通道。目前已发现6个TRP通道家族的亚型(TRPV1~V4,TRPM8和TRPA1)在疼痛感受器中表达。
1 TRP通道概述
1.1 TRP通道的结构特点
TRP通道由6个跨膜拓扑结构和胞内氨基、羧基残端结构域组成。典型的TRP通道是一个同源或异源四聚体,每个亚基含有6个跨膜片段(S),其中S5与S6跨膜结构域之间形成内嵌的孔道区域,Ca2+等多种阳离子由此通过,两侧的羧基(C)端和氨基(N)端均位于膜内。不同亚家族胞内区的保守结构域差异很大。TRPV1的C端包含一个TRP通道结构域,N端包含3个锚蛋白重复序列结构域(ankyrin repeat domain,ARD);其N端的T116,T114和T370能被蛋白激酶A(protein kinase A,PKA)磷酸化,使其活性改变。其他TRP通道家族成员的N端一般含有3~4个ARD,而TRPA1的N端存在至少14个ARD,且包含2个螺旋的钙结合域。TRPM8的N端具有数个TRP通道结构域,而不包含ARD;其C端含有TRP通道结构域和卷曲螺旋结构域。因各个TRP通道亚家族的结构存在差异,其调控机制及功能也各不相同。
1.2 TRP通道的组织分布
TRP通道家族分布广泛,存在于包括大脑和脊髓等的神经组织以及包括心、肝、肾、肺、胃肠道、前列腺和膀胱等的非神经组织[6]。表达TRP通道的细胞类型亦多种多样,包括神经细胞、血管内皮细胞、上皮细胞和平滑肌细胞等。在与疼痛相关的TRP通道中,TRPV1主要分布于TG和DRG的中、小直径肽能感觉神经元。TRPA1常与TRPV1共表达。TRPV2主要分布于DRG的中、大直径感觉神经元。TRPV3和V4在外周感觉神经元和皮肤角化细胞表达水平较高。TRPM8分布于TG和DRG的小直径神经元,且在TG中的表达比在DRG中高。
1.3 TRP通道的离子通透性
离子通道是位于细胞膜上、能调节和转运特异离子穿膜的通道。TRP通道为非选择性阳离子通道,允许Na+,K+,Ca2+和Mg2+等多种阳离子通过,其中Ca2+通透性最高。不同的TRP通道对Ca2+的通透性存在差异[7-8]。TRPV5和V6对Ca2+具有高通透性(PCa2+/PNa+>100),相比之下,TRPV1~V4 对Ca2+的通透性相对较弱(PCa2+/PNa+≤10)。而TRPA1对Ca2+和Mg2+的通透性相同(PCa2+/PMg2+=1.4)。TRPM8的PCa2+/PNa+为1~3。TRP通道的这种Ca2+高通透性被认为与位于孔道中的带负电荷的天冬氨酸残基(Asp621)有关,具体机制尚待进一步研究[9]。
2 TRP通道在疼痛中的作用
2.1 TRP通道与疼痛感受器
在伤害性刺激存在的情况下,疼痛相关TRP通道能通过多种机制被激活,继而影响疼痛感受器对伤害性刺激信号的传导。关于TRP通道影响疼痛感受器的机制,有学者进行了总结[10]:①在生理温度、轻度至中度酸性和氧化应激条件下,TRP通道被局部激活;②减少TRP通道脱敏,使活化时间延长;③由于TRP通道蛋白的表达增加和运输到膜表面的蛋白增多,通道活化增强;④Ca2+和其他细胞内信号转导分子使通道活化,发生交叉致敏;⑤增强TRP通道蛋白的基因表达和相关mRNA翻译。总之,以上过程导致疼痛感受器兴奋和放电时间的延长。
这些复杂的过程是外周疼痛转导机制的基础,抑制疼痛相关TRP通道的激活是新型镇痛药物研发的新策略。
2.2 TRP通道与病理性疼痛
病理性疼痛按起因可分为炎症性疼痛、神经病理性疼痛和功能性疼痛[11]。功能性疼痛更多的是患者精神因素或心理障碍所导致,无明确的病变。但目前尚未有研究报道TRP通道参与功能性疼痛的发生。
2.2.1 TRP通道与炎症性疼痛
炎症以红、肿、热、痛和功能障碍为主要症候。炎症性疼痛主要指炎症部位受到机械性刺激所引起的疼痛,而这种刺激诱导的疼痛特指炎性痛觉过敏。炎症介质(如缓激肽、组胺、花生四烯酸、白细胞介素1、肿瘤坏死因子α和神经生长因子等)直接或间接激活TRP通道,使其敏化,疼痛感受器的兴奋阈值下调,对刺激反应性增加,引发痛觉过敏[12]。
大量研究证明,炎症性疼痛的发生很大程度上与辣椒素受体TRPV1有关。在完全弗氏佐剂诱导的炎症性疼痛模型中,脊髓背角和DRG中的TRPV1表达显著增加[13]。炎症介质能通过多种途径调控TRPV1的活性,其中Gq蛋白/G蛋白偶联受体(Gq/G protein-coupled receptors,Gq/GPCR)途径是炎症介质激活TRPV1后产生炎症性疼痛的关键途径。Kumar等[14]使用膜片钳和钙成像技术进行了剖析,发现TRPV1激活下游的Gq/GPCR途径后只产生了比较微小的电流,这与典型的外源性刺激TRPV1后产生强电流明显不同。此外,他们还证明了Gq/GPCR信号下游的2条途径,即蛋白激酶C介导的通道磷酸化途径和脂氧合酶介导的内源性TRPV1激活剂产生,只有当这些途径都作用于TRPV1时,炎症介导的疼痛反应才会发生。最近Jo等[15]研究发现,P物质能增强TRPV1的活动,而来源于ω-3多不饱和脂肪酸的消退素(resolvin E1,RvE1)能通过GPCR信号通路完全抑制这种现象。RvE1能强烈抑制TRPV1的活动与外周炎症,是治疗炎症性疼痛的新靶点。
此外,TRPA1也是参与炎症性疼痛的重要离子通道之一[16-17]。TRPA1通道能被炎症介质所激活,同时TRPA激活后又能促进相关炎症肽的释放,研究者将 TRPA1 称作炎症的“守门员”[18]。Fischer等[19]对TRPA1、P物质、组胺和5-羟色胺(5-hydroxy⁃tryptamine,5-HT)在体内炎症性疼痛发生中的相互关系进行了研究,发现TRPA1激动剂异硫氰酸丙烯酯(allyl isothiocyanate,AITC)所产生的疼痛能被P物质、组胺和5-HT的选择性拮抗剂明显减少。使用TRPA1的反义寡核苷酸后,组胺或5-HT引起的疼痛也发生降低。据此推测AITC产生疼痛依赖于P物质、组胺和5-HT,而组胺或5-HT产生的疼痛依赖于TRPA1。进一步发现,P物质、组胺或5-HT和AITC(致痛剂量以下)协同产生的疼痛比它们各自单独产生的疼痛要强烈。Liu等[20]研究发现,TRPA1是氧化磷脂的分子靶点,氧化磷脂通过激活TRPA1导致慢性炎性疼痛。
其他疼痛相关TRP通道与炎症性疼痛的关系也逐渐得到揭示。TRPV3除了与皮肤疾病关系密切外,研究者也越来越关注其在炎症性疼痛和神经病理性疼痛中的作用,研究发现,TRPV3拮抗剂能够减轻关节炎性疼痛[21]。TRPV4能增强炎症性疼痛的敏感性[22]。Kanju等[23]发现,小分子新型双通道阻滞剂GSK205除了能抑制TRPV4外,还能抑制TRPA1,对急性胰腺炎模型中的炎症和疼痛有很好的缓解作用。
2.2.2 TRP通道与神经病理性疼痛
神经病理性疼痛是指由躯体感觉神经系统的损伤或疾病而直接造成的疼痛[4]。临床上很多慢性、顽固性疼痛都属于神经病理性疼痛,如三叉神经痛、截肢后幻肢痛、脑卒中后疼痛、带状疱疹后遗神经痛和糖尿病周围神经病变等。神经病理性疼痛的机制十分复杂,涉及外周水平的外周敏化,中枢水平的中枢敏化、去抑制机制和离子通道的改变等[24]。Marwaha等[25]认为,TRP通道主要通过介导Ca2+内流导致内质网内Ca2+升高,从而引起神经递质的释放,进而激活PKA/PKC和环磷酸鸟苷/一氧化氮(cyclic guanosine monophosphate/nitric oxide,cGMP/NO)信号通路,产生疼痛。
目前,众多研究证实,TRPV1,TRPA1和TRPM8参与神经病理性疼痛的发生。TRPA1可被活性氧/活性氮(reactive oxygen species/reactive nitrogen species,ROS/RNS)激活,而糖尿病伴随着高水平的ROS[26]。据此认为TRPA1参与糖尿病周围神经病变导致的疼痛,并发现使用TRPA1拮抗剂能降低糖尿病大鼠的疼痛敏感性[27]。化疗药物在治疗肿瘤的同时,常常伴有外周神经毒性,导致神经病理性疼痛。TRP通道可能与化疗痛的产生相关。Huang 等[28]发现,Wistar大鼠在使用多西紫杉醇(多西他赛,docetaxel)后,TRPA1蛋白表达水平上调,并且其导致的神经病理性疼痛能被TRPA1抑制剂Ap18所逆转。Salat等[29]通过建立紫杉醇诱导的小鼠神经病理性疼痛模型对TRPV1,TRPA1和TRPM8拮抗剂的镇痛作用进行研究,发现TRP通道拮抗剂能减轻神经病理性疼痛。De Caro等[30]发现,TRPM8基因敲除的小鼠对痛觉刺激的反应更小,并证明TRPM8的2种选择性拮抗剂DFL23693和DFL23448能有效减少甲醛导致的口面部疼痛和氯化钙导致的神经病理性疼痛。
3 TRP通道调节剂
关于TRP通道调节剂在疼痛中的研究日益增多,这类调节剂根据作用的不同可分为激动剂和拮抗剂2类,而激动剂根据来源不同又可分为外源性和内源性激动剂(表1)。目前已知的外源性激动剂多为植物或动物提取物中的辛辣、芳香或刺激性成分,如辣椒素、大蒜素、姜黄素、薄荷醇和吴茱萸碱等;内源性激动剂大多为炎性相关介质,如前列腺素和缓激肽。许多具有热辣感觉的物质往往能激活TRPV1等热敏感性通道,而TRPA1和TRPM8等冷敏感性通道能被薄荷醇和留兰香等具有清凉感觉的物质所激活。由于痛觉的产生往往伴随着TRP通道的激活,所以其拮抗剂可作为潜在的镇痛药物进行研究。TRP通道拮抗剂数量繁多,但除个别外,绝大多数拮抗剂还处于临床前研究阶段。
TRP通道调节剂的不断发现不仅为研究TRP通道与疾病的关系提供了更多的研究工具,同时也为临床药物的使用提供了参考。但值得注意的是,TRP通道的众多调节剂存在明显的交叉性,特异性较差,如龙脑和樟脑在TRPV3中表现为激活作用,在TRPA1中为拮抗作用,且部分物质对某些TRP通道亚型还具有双向调节作用,即低浓度表现为激活作用,高浓度表现为抑制作用,如阿扑吗啡、薄荷醇和尼古丁等。因此,开发TRP通道的高效选择性小分子调节剂将会为设计针对TRP通道的靶向性治疗药物提供巨大助力。
4 TRP通道在疼痛治疗中的应用
目前,以吗啡为代表的麻醉性镇痛药和以阿司匹林为代表的非甾体抗炎镇痛药是临床治疗疼痛的主要药物,但它们都有着严重的不良反应。阿片类药物虽是目前镇痛作用最强的一类药物,但其具有成瘾性和呼吸抑制等不良反应;而非甾体抗炎镇痛药往往会带来严重的胃肠道副作用和心血管疾病风险。为此,迫切需要寻找安全有效、成瘾性低的新型镇痛药物。
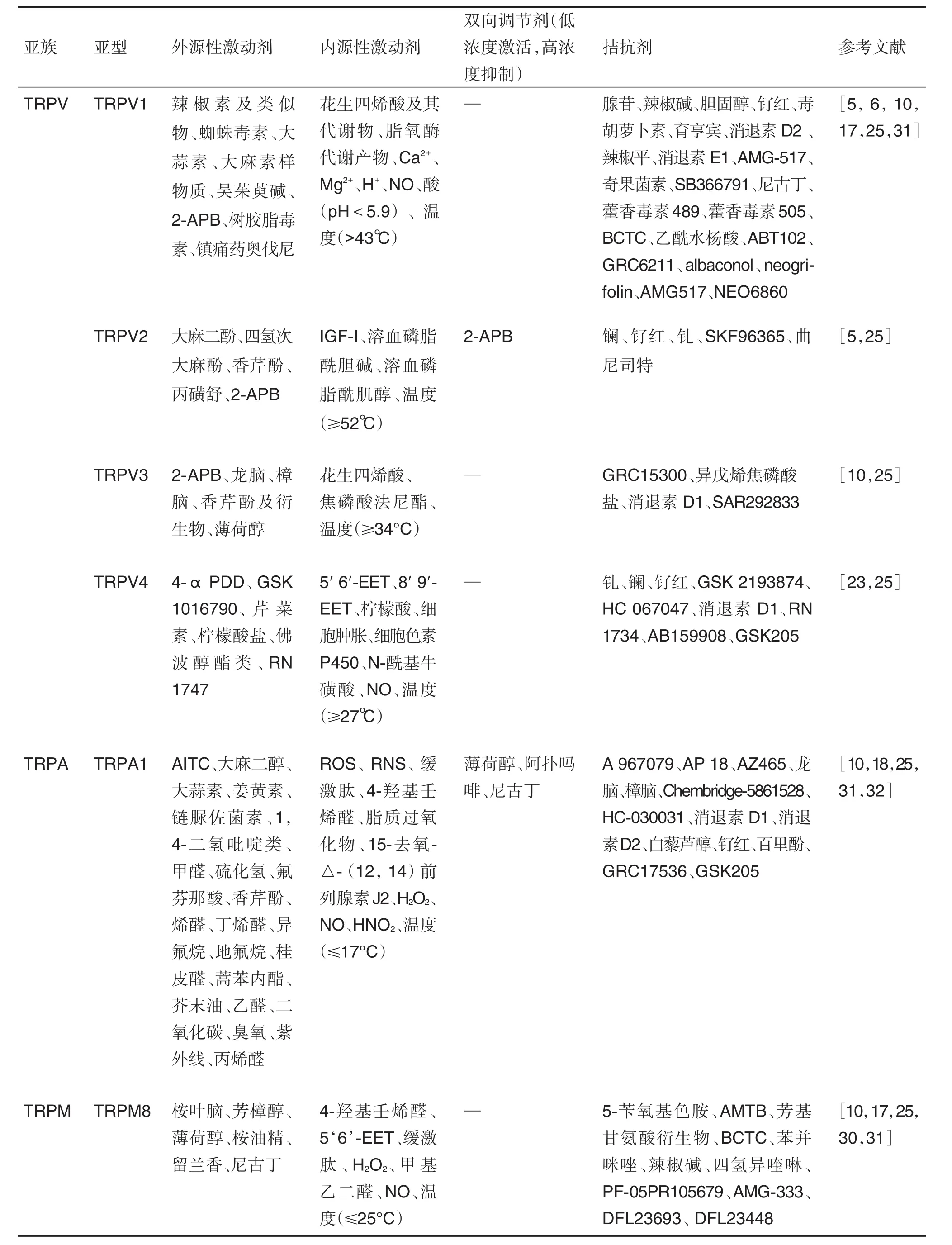
表1 瞬时受体电位(TRP)通道调节剂
近年来,随着对TRP通道研究的不断深入,以此为靶点研发的镇痛药物正不断取得新进展。目前,TRPV1激动剂辣椒碱(capsaicin)和珠卡赛辛(zucapsaicin)已获批上市,分别用于治疗神经痛和骨关节炎。众多的小分子化合物也正处于临床前或临床研究。美国国立卫生研究院(National Institutes of Health,NIH)研发的TRPV1激动剂树胶脂毒素(resiniferatoxin,RTX)因用于治疗终末期疾病的顽固性疼痛而获得孤儿药资格,目前正在进行临床Ⅱ期试验。值得注意的是,TRPV1拮抗剂曾因为引起体温过高的副作用而限制了其临床应用,不过最近 Brown 等[31]对新型TRPV1 拮抗剂NEO6860进行安全性、药代动力学和药效学研究,发现其不伴有体温过高的副作用并具有更好的药效。格兰泰公司研发的TRPV1拮抗剂axomadol用于治疗慢性腰痛,目前已完成Ⅱ期临床试验。安进公司研发的用于治疗偏头痛的TRPM8拮抗剂AMG-333正在进行临床Ⅰ期。而GRC-17536是迄今唯一一个完成Ⅱ期临床的TRPA1抑制剂[32]。该药除对哮喘和神经痛有治疗作用外,最近还发现其对多种原因引起的慢性咳嗽也有较好疗效[32]。
除化学药物之外,天然产物中也存在着具有调控TRP通道活性的物质,以天然产物为导向进行的药物研发也是当前的热点之一。De等[33]对植物Amphilophium crucigerum进行研究,发现其种子的醇提取物和二氯甲烷部分能够抑制TRPV1活性,并在慢性炎症痛模型中显示出良好的抗炎和镇痛作用。中药独活具有祛风除湿,痛痹止痛的功效。Li等[34]研究发现,独活能治疗神经病理性疼痛是由于其含有的香豆素类化合物,该类物质能抑制炎症介质的释放,降低TRPV1的表达。
5 展望
TRP通道的发现为疼痛治疗开辟了一个崭新的领域。与以往的镇痛药物不同,以TRP通道为靶点的新型镇痛药物能从源头上消除疼痛的产生。但我们应清楚地认识到,TRP通道组织分布广泛,生理功能多样,以此为靶点的药物在发挥镇痛作用的同时往往伴随着副作用。TRPV1拮抗剂正是因为具有体温过高的不良反应而阻碍了其在临床上的应用。因此,减少此类药物的不良反应将是研发的难点。进一步研究TRP通道在疼痛中的作用对于阐明疼痛的发生机制、治疗及相关药物研发具有重要意义。

