胚胎植入前遗传学筛查在复发性流产及高龄患者中的应用
韩慧敏,舒明明,揣云海,陈梦楠,郝镁娟,商 微,封志纯
胚胎植入前遗传学筛查(preimplantation genetic screening, PGS)也称胚胎植入前非整倍性筛查即对行体外受精(invitrofertilization, IVF)发育到第 3天或第 5天的胚胎进行染色体非整倍性筛查,选择整倍性染色体胚胎移植,以提高临床妊娠率(clinical pregnancy rate,CPR),降低早期流产率。育龄妇女初次妊娠的自然流产率约为5%~13%,而2次自然流产后再次流产的发生率约为24%~29%[1]。美国生殖医学学会(ASRM)[2]和美国妇产科医师学会(ACOG)[3]将复发性流产(recurrent spontaneous abortion,RSA)定义为2次或者2次以上的妊娠丢失。RSA的病因复杂,包括遗传学因素、解剖学因素、内分泌因素、感染因素、免疫功能异常、抗磷脂综合征及获得性血栓前状态等,其中大部分RSA的发生都与胚胎的非整倍体状态相关,有研究[4]显示RSA中胚胎非整倍体率超过50%。该文通过分析行PGS的高龄和RSA患者染色体的异常发生率及其临床结局,一是提高上述两种情况的活产率;二是为PGS技术的进一步推广提供临床数据支持。
1 材料与方法
1.1试剂和仪器G1、G2培养基购自瑞典Vitrolife公司;Covaris S2系统超声购自美国Covaris公司;Qiagen纯化试剂盒购自德国Qiagen公司;DNA建库试剂盒购自美国New England Biolabs公司;HiSeq2500系统购自美国Illumina公司。
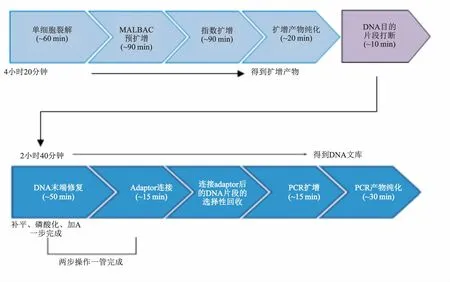
图1 单细胞染色体高通量测序检测流程
1.2研究对象和方法
1.2.1病例资料 回顾性分析2014年12月~2017年3月在中国人民解放军海军总医院生殖医学中心行PGS 91例患者125个周期的临床资料,患者年龄25~45(34.06±5.20)岁,体质指数(21.34±3.0)kg/m2,基础促卵泡生成素(7.95±4.1)mIU/ml。其中RSA患者54例,均有2次或2次以上的自然流产史;高龄患者47例(>35岁),最大年龄为45岁;其中高龄的RSA患者10例。所有患者行PGS前签署知情同意书。
1.2.2胚胎培养、活检 MII(Metaphase II)期卵母细胞采用单精子胞浆内注射(intracytoplasmic sperm injection ,ICSI)方式进行体外受精,G1培养基中进行培养, 48 h后卵裂胚转移至G2培养基中继续培养48~72 h。对卵裂期或囊胚期的胚胎进行活检。一般活检单个卵裂球细胞或4~8个囊胚滋养层细胞,活检后的胚胎行玻璃化冷冻,液氮中长期保存。
1.2.3全基因组扩增及测序 所有活检标本的单细胞全基因组扩增均采用多次退火环状循环扩增技术(multiple annealing and looping-basedamplification cycle, MALBAC)。首先,扩增是通过将DNA退火到一个随机引物库中,与由27个通用核苷酸序列和8个简并碱基组成的随机引物结合,然后进行线性预扩增和指数扩增,最终产生2 μg的全基因组DNA用于高通量测序。用Covaris S2系统超声将400 ng纯化好的DNA扩增产物打断成150~250 bp片段,再用Qiagen纯化试剂盒进行纯化,DNA建库试剂盒进行建库(图1),HiSeq2500系统进行上机测序。
1.2.4数据分析 HiSeq 2500平台全基因组扩增后的每个样本产生约2 Mb reads的数据量,高质量的reads与hg19参考基因组进行比对。染色体拷贝数分析按以下方法进行:整个参考基因组分为若干个1 Mb大小不重叠的窗口,计算每个窗口的Reads数目,通过R语言对每个窗口GC含量矫正后的Reads 数目进行作图,使拷贝数变异可视化。
1.2.5胚胎移植 活检后的胚胎行玻璃化冻存,PGS检测结果正常的胚胎将在复苏周期中移植入宫腔,并进行个体化黄体支持。
1.3分析指标及判定标准本研究的主要观测指标为胚胎染色体异常率、CPR,持续妊娠率(ongoing pregnancy rate,OPR),流产率(miscarriage rate,MR)。异常胚胎率(%)=检测回报异常的胚胎数目/送检胚胎数×100%,CPR(%)=B超下可见孕囊的周期数/移植周期数×100%,OPR(%)=持续妊娠周期数/移植周期数×100%,MR(%)=流产周期数/妊娠周期数×100%。
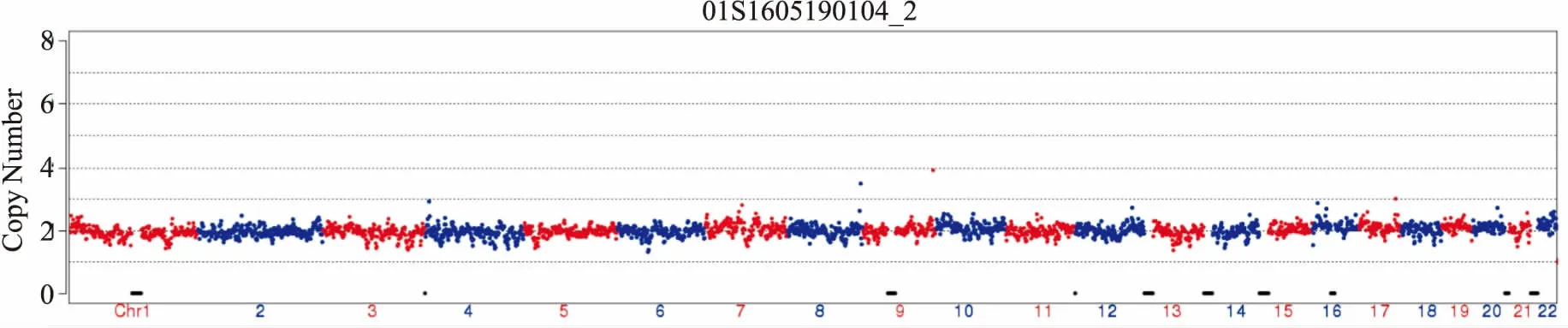
图2 染色体整倍性胚胎(46,XN)

图3 多条染色体异常的胚胎[46,XN,-4(×1,mos*),13(×1,mos*),-21(×1,mos*),-22(×1,mos*)]
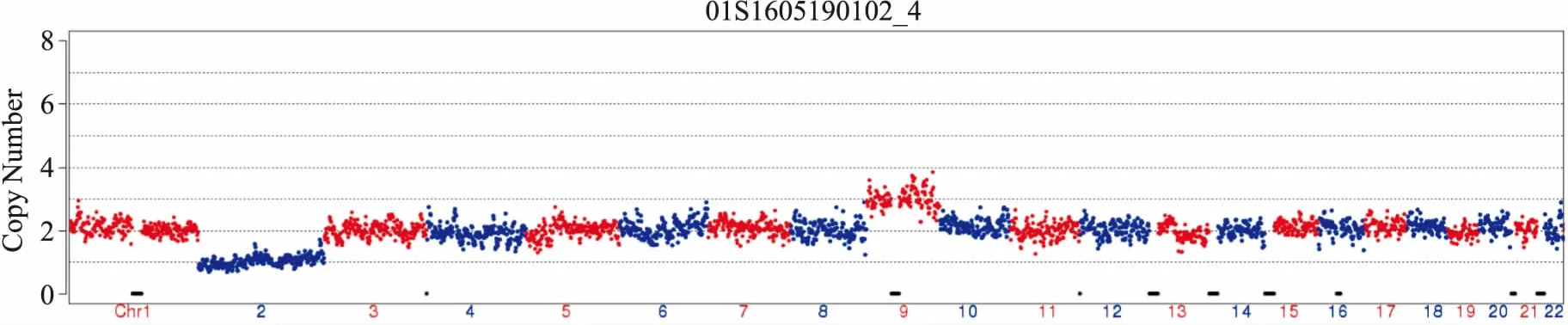
图4 2号染色体单体,9号染色体三体的胚胎[46,XN,-2(×1),+9(×3)]
2 结果
2.1胚胎异常率本研究共对91例患者125个取卵周期的526枚胚胎进行PGS,其中卵裂胚74枚,囊胚452枚,526枚胚胎检测结果显示有355枚胚胎为染色体异常,胚胎染色体异常率为67.49%(355/526)。RSA患者83个PGS周期共检测胚胎329枚,217枚胚胎为染色体异常,染色体异常率为65.96%(217/329);高龄患者79个PGS周期数共检测胚胎243枚,177枚胚胎为染色体异常,染色体异常率为72.84%(177/243),合并RSA和高龄的患者10例,共37个取卵周期。见表1。本研究主要筛查出的染色体异常包括微小缺失、与重复(10 Mb以上的片段缺失和重复)和非整倍体 (mosaic, mos)表示嵌合疑似,图2~4分别为其中3类染色体拷贝数检测结果图,其中图2为整倍体胚胎,可用于移植,图3为多条染色体异常的胚胎,图4为2号染色体单体、9号染色体三体的异常胚胎,这两类胚胎均不可用于移植。
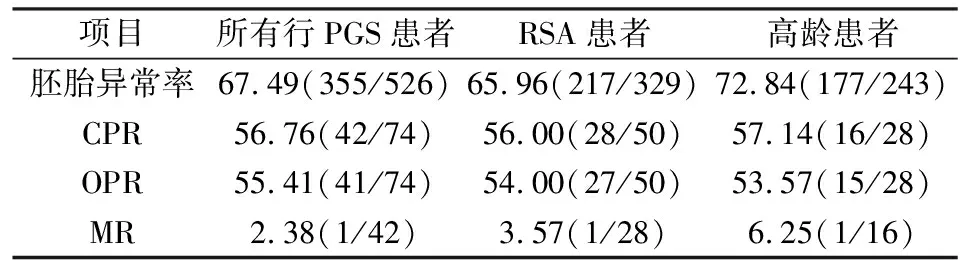
表1 患者的染色体异常率与临床妊娠结局[%(n/n)]
2.2PGS的妊娠结局本研究91例行PGS助孕患者共实施74个单胚胎冻融移植周期,临床妊娠42例,CPR为56.76%(42/74);自然流产发生1例,MR为2.38%(1/42);持续妊娠41例,OPR为 55.41%(41/74)。其中符合RSA患者共进行了50个解冻移植周期,临床妊娠28例,其CPR为56.00%(28/50);持续妊娠27例,OPR为 54.00%(27/50);自然流产发生1例,MR为3.57%(1/28)。高龄患者共进行了28个解冻移植周期,高龄患者的临床妊娠16例,CPR为57.14%(16/28);持续妊娠15例,OPR为 53.57%(15/28);自然流产1例,MR为6.25%(1/16)。其中有10例患者合并有高龄和RSA,共行4次解冻移植周期,其中2例患者在持续妊娠中,1例流产,1例未孕。两组分组中均纳入了这10例患者。见表1。将高龄患者进一步分为35~40岁组和>40岁组观察其临床结局。35~40岁组患者送检胚胎145枚,其中胚胎染色体异常95枚,胚胎异常率为65.51%(95/145)。35~40岁组患者共进行了22个解冻移植周期,临床妊娠14例,CPR为63.63%(14/22);自然流产1例,MR为7.14%(1/14)。>40岁组患者送检胚胎98枚,其中胚胎染色体异常82枚,>40岁组的胚胎异常率为83.67%(82/98)。>40岁组患者共进行了6个解冻移植周期,临床妊娠2例,CPR为33.33%(2/6),其中>40岁组胚胎异常率明显高于35~40岁组,差异有统计学意义(P<0.05),>40岁组的CPR和MR均低于35~40岁组,但差异无统计学意义(P>0.05),见表2。
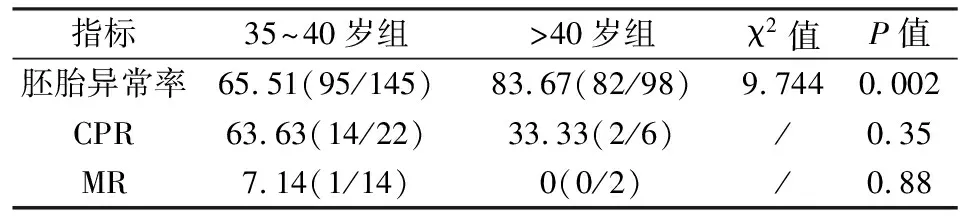
表2 两组高龄患者临床结局[%(n/n)]
3 讨论
人类胚胎的染色体异常率在40%~60%,40岁以上女性染色体异常率可达80%。有报道表明<35岁的女性胚胎着床率约为30%,而40岁以上女性胚胎着床率仅为6%[5],患者高龄及移植了非整倍体胚胎是导致IVF过程中胚胎着床率降低的主要原因。PGS 是早于产前筛查及产前诊断的遗传学筛查方式,可通过筛查出染色体正常的胚胎改善IVF妊娠结局,在我国主要用于高龄、反复种植失败、RSA及携带异常染色体的不孕患者[6]。
近年来随着全基因组扩增技术的应用和发展,比较基因组杂交(comparative genomic hybridization, CGH),第二代基因测序技术(next generation sequencing,NGS)因可进行全基因组的染色体筛查,渐取代了早前的荧光原位杂交技术,本研究中对所采取的MALBAC-NGS-PGS技术是一种新的PGS技术,具有均一性好、等位基因脱口率低、扩增成功率高等特点,已经成功应用于单细胞全基因组扩扩增,及单个卵母细胞和精子测序[7],与CGH相比在检测异常染色体敏感性和准确性上并无差别,但只需要0.04 x的测序深度就可以进行全染色体筛查,且通量高,速度快, 成本低,利于PGS在临床推广使用[8]。
本研究采用MALBAC-NGS-PGS技术对高龄及RSA患者125个周期526枚胚胎进行PGS检测,结果显示,RSA和高龄患者(>35岁)胚胎染色体异常率分别达65.96%和 72.84%,其中40岁以上患者的胚胎异常率高达83.67%。 RSA及高龄患者行PGS后,选择染色体正常的单胚胎移植CPR可达56.76%,MR仅为2.38%,进一步证实通过PGS可以有效筛查出高龄和RSA患者的非整倍体胚胎,降低因胚胎染色体数量异常导致的流产的风险,有效改善这两类患者的妊娠结局。另外,还进一步将高龄人群以年龄40岁为界分为两组进行比较。结果表明40岁以上组的患者非整倍体胚胎率明显高于35~40组(P<0.05),进一步验证了Kuliev et al[9]和Pellestor et al[10]之前的研究,即认为女性年龄与胚胎染色体异常发生率成正相关的观点。但是本研究中35~40岁组和>40组之间的CPR和MR差异均无统计学意义,这可能是由于本研究中>40岁组患者的移植周期数相对较少有关,因此还需进一步扩充样本量,完善研究。
但PGS的临床应用仍存在许多局限性,如 PGS检测是一种侵入性检查,可能会在一定程度上降低胚胎质量和发育潜能[11];人类胚胎活检的长期生物安全性尚未得到证实,有研究[12-13]表明胚胎活检可对动物胚胎神经和肾上腺发育产生负面影响;此外PGS需具备昂贵的仪器设备以及受过特殊训练和经验丰富的胚胎学家,增加患者的经济成本[14],但随PGS技术的进一步完善和经济成本的下降,将在改善高龄、RSA患者及染色体异常携带者IVF结局方面发挥更大的作用。

