干酪乳杆菌11MZ-5-1发酵酸菜化学成分及细菌多样性分析
赵 丹,杜仁鹏,宋 刚,孙 健,平文祥,葛菁萍,*
(1.黑龙江大学生命科学学院,微生物黑龙江省高校重点实验室,黑龙江 哈尔滨 150080;2.黑龙江大学 农业微生物技术教育部工程研究中心,黑龙江 哈尔滨 150500)
酸菜是酸渍大白菜的简称,指在低浓度食盐条件下,经过乳酸发酵而形成的蔬菜发酵制品,是我国东北地区特色传统发酵食品的典型代表之一[1-2]。酸菜腌制时,原材料不需要灭菌,微生物种群和化学组分多样,生物因素与非生物因素内部及之间的相互作用十分复杂[3-4]。酸菜发酵体系是一种微生态系统,其中含有乳酸菌(lactic acid bacteria,LAB)、酵母菌、霉菌等多种微生物[5-6]。随着人们对酸菜的关注和酸菜工业的发展,越来越多的学者对酸菜的微生物菌群进行研究,证实LAB是酸菜发酵系统中的优势菌种[7-8]。20世纪30年代,Pederson[9]研究了蔬菜发酵过程中微生物,第一次指出了Leuconostoc mesenteroides启动蔬菜发酵。张鲁冀等[10]利用生理生化实验和16S rDNA测序鉴定法从东北自然酸菜发酵液中分离得到Lactobacillus brevis、Lactobacillus plantarum、Lactobacillus reuteri。张先琴[11]对四川自然泡菜发酵过程中的菌体多样性进行研究,发现Lactobacillus是泡菜发酵过程中的优势菌群,且发酵的过程中存在Pediococcus、Lactococcus以及Aspergillus、Candida albicans等,但真菌的菌群密度较低。
近年来,益生菌LAB在发酵食品中的过程和功能研究日益引人关注。尤其是LAB作为发酵剂参与发酵食品生产过程,如乳制品、豆制品、饮料和腌渍食品等[12]。LAB代谢物特征与发酵食品的口味、香味、结构、颜色以及菌群分布密切相关[13]。不同发酵阶段,发酵系统中菌群发生演替,其中以LAB作为发酵剂加入酸菜当中,不仅可以显著缩短发酵周期,而且能够降低发酵系统的菌群多样性,从而为酸菜的风味、品质提供更高的保障[14-15]。Jung等[16]采用核磁共振氢谱结合高通量测序技术,研究L. mesenteroides作为发酵剂,对韩国泡菜发酵过程中微生物菌群和代谢物组的影响,结果表明,Weissella和Lactobacillus是发酵过程中的优势菌属,主要风味物质是单糖类的葡萄糖和果糖,有机酸类的乳酸和乙酸。然而很多研究者认为,接种LAB(如:L. plantarum、L. mesenteroides等)发酵酸菜具有发酵时间短、受季节影响小、品质易于控制的特点,但风味不如自然发酵的酸菜自然、醇厚[17]。采用接入发酵剂的方式进行发酵,使其风味逐步接近自然酸菜是大规模生产需要不断努力的目标。
课题组前期着重研究自然酸菜发酵生态系统中的菌群演替情况,并对菌体进行分离鉴定[18]。本研究以此作为基础,以分离自自然酸菜发酵液中高产乳酸的L. casei 11MZ-5-1为发酵剂[19],构建酸菜发酵微生物生态系统研究模型,对比分析L. casei 11MZ-5-1酸菜发酵过程中有机酸、总酸、亚硝酸盐、VC、甘油、乙醇、甘露醇、2,3-丁二醇等关键代谢产物,挥发性风味物质及细菌多样性的差异。研究结果有助于酸菜工艺的监控和质量标准的建立,对加菌酸菜质量稳定性的提高和产业发展水平的提升具有实践指导意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及材料
L. casei 11MZ-5-1保藏于黑龙江大学微生物重点实验室。
中国大白菜 哈尔滨哈达蔬菜批发市场;食用盐中国盐业总公司;180 L自制发酵罐由课题组自行设计研制。
1.1.2 试剂盒
M2023细菌基因组DNA提取试剂盒、L9014琼脂糖凝胶DNA回收试剂盒、M1603质粒小提试剂盒 天根生化科技有限公司;S004细菌微量生化鉴定管、S022嗜热链球菌生化鉴定套装、S021乳酸杆菌生化鉴定套装、S001肠杆菌科细菌生化编码鉴定管 北京路桥技术有限责任公司。
1.2 培养基
MRS培养基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,K2HPO42 g,柠檬酸铵2 g,CH3COONa·3H2O 5 g,葡萄糖20 g,吐温80 1 mL,MgSO4·7H2O 0.58 g,MnSO4·4H2O 0.25 g,琼脂20 g,蒸馏水1 000 mL,pH 5.5,121 ℃高压蒸汽灭菌15 min。用于LAB的分离与培养。
YPD培养基:葡萄糖20 g,酵母粉10 g,蛋白胨20 g,琼脂20 g,蒸馏水1 000 mL,108 ℃高压蒸汽灭菌20 min。用于酵母菌和霉菌的分离与培养。
LB培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,pH 7.0~7.2,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌15 min。用于Enterobacteria的分离与培养。
KAA培养基:胰蛋白胨17.0 g,牛肉膏3.0 g,酵母浸膏5.0 g,牛胆粉10.0 g,氯化钠5.0 g,柠檬酸钠1.0 g,七叶苷1.0 g,柠檬酸铁铵0.5 g,叠氮化钠0.25 g,琼脂13.5 g,1 000 mL蒸馏水,pH 7.0~7.2,121 ℃高压蒸汽灭菌15 min。用于Enterococcus的分离与培养。
VRBA培养基:乳糖10 g,酵母浸粉3 g,中性红0.03 g,结晶紫0.002 g,蛋白胨7 g,氯化钠5 g,胆盐1.5 g,琼脂20 g,1 000 mL蒸馏水,煮沸2 min。用于Escherichia coli的分离与培养。
PCA培养基:胰蛋白胨5.0 g,酵母浸粉2.5 g,葡萄糖1.0 g,琼脂20 g,蒸馏水1 000 mL,pH 6.8~7.2,121 ℃高压蒸汽灭菌15 min。用于好氧细菌的分离与培养。
BP培养基:牛肉膏粉5 g,胰蛋白胨10 g,酵母膏粉1 g,丙酮酸钠10 g,甘氨酸12 g,氯化锂5 g,琼脂15 g,pH 6.8~7.2,蒸馏水1000 mL。用于Staphyloccocus aureus的分离与培养。
BCS培养基:氯化钠10.0 g,胰酪蛋白胨10.0 g,牛肉浸粉1.0 g,苯酚红0.025 g,D-甘露醇10.0 g,琼脂12.0 g,pH 6.8~7.2。用于Bacillus cereus的分离与培养。
SPS培养基:酵母浸粉10.0 g,胰酪蛋白胨15.0 g,亚硫酸钠0.5 g,柠檬酸铁0.5 g,琼脂15.0 g,蒸馏水1 000 mL,pH 6.8~7.2。用于Clostridium的分离与培养。
FB培养基:胰蛋白胨10.0 g,酵母浸粉5.0 g,氯化钠10.0 g,蒸馏水1 000 mL,pH 6.9~7.1。用于Listeria monocytogenes的分离与培养。
PALCAM培养基:酵母浸粉3.0 g,D-葡萄糖0.5 g,氯化锂15.0 g,蛋白胨23.0 g,可溶性淀粉1.0 g,D-甘露醇10.0 g,七叶苷0.8 g,柠檬酸铁铵0.5 g,氯化钠5.0 g,酚红0.08 g,琼脂13.0 g,蒸馏水1 L,pH 7.0~7.4。用于Salmonella的分离与培养。
1.3 方法
1.3.1 酸菜发酵系统构建
自然发酵酸菜系统(以下简称CK):选取优质实心白菜,晾晒2 d后去除坏叶,用自来水清洗干净,90 kg白菜逐层放置于发酵罐中压实,加入1.35 kg食盐,并用70 L水浸泡白菜,于15~20 ℃密封静置发酵。L. casei 11MZ-5-1发酵酸菜系统(以下简称BA):取90 mL对数生长期的L. casei 11MZ-5-1作为发酵剂,接入到酸菜发酵生态系统。发酵时间为25 d,从第1天开始按奇数天取样,测定各项指标,至发酵结束。
1.3.2 pH值及总酸的测定
用TOLEDO FE20型pH计测定发酵液pH值。参照GB/T 12456—2008《食品中总酸的测定》[20]测定酸菜样品中总酸的含量(以乳酸计)。
1.3.3 亚硝酸盐及VC含量的测定
采用食品中亚硝酸盐测试试剂盒测定酸菜发酵液中亚硝酸盐的含量,具体实验方法按照试剂盒说明书进行。参照李军[21]的方法测定酸菜发酵液中VC的含量。
1.3.4 风味物质含量的测定
甘露醇含量测定参照蒋华等[22]的方法;乳酸、乙酸、柠檬酸、琥珀酸、苹果酸、甘油、甘露醇、乙醇、2,3-丁二醇含量利用高效液相色谱(high performance liquid chromatography,HPLC)检测。依照赵丹等[4]的方法,利用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)检测酯类、烷类、萜类、醛类、酮类、醚类、醇类、苯及衍生物类、萘及衍生物类、含硫化合物和杂环化合物挥发性风味物质的含量。1.3.5 酸菜感官评价
邀请10 名经过感官品评培训的人员组成评定小组,依据韩德权等[23]的方法从色泽、香气、口味、脆度及整体评价这5 项指标对酸菜进行品评。
1.3.6 BA酸菜中不同种属细菌的分离纯化与计数
在整个发酵过程中,取奇数天发酵液样品10 mL,按10-1、10-2、10-3、10-4、10-5、10-6进行梯度稀释,将稀释液分别涂布于MRS、YPD、VRBA、BP、KAA、PCA等平板上,每个稀释度平行涂布3 个平板,在各自适宜的温度下,培养24~48 h,分别检测LAB、酵母菌、霉菌、好氧细菌、E. coli、Enterobacteria、Enterococcus、Staphyloccocus aureus、Bacillus cereus、Clostridium、Listeria monocytogenes、Salmonella,并进行活菌计数。分析随着发酵时间的延长,酸菜发酵系统中菌体的多样性及演替情况。
1.3.7 BA酸菜发酵过程中菌体形态学、生理生化及16S rDNA鉴定
将培养基中分离得到的菌种,反复于新鲜的平板上进行三区划线,直至得到单菌落。分别对这些纯化的菌株进行个体显微形态(大小、形状、革兰氏染色)观察和群体形态(菌落大小、直径、光泽、形态、边缘、中央突起情况等)观察。将显微结构和菌体形态相似的菌株归为一类。菌株生理生化实验采用试剂盒进行鉴定,方法详见说明书。
取3 mL菌株发酵液,离心后收集菌体,用菌体基因组DNA提取试剂盒提取菌株基因组DNA,根据细菌的16S rDNA基因序列的保守区域,采用细菌通用引物(P1:5’-AGA GTT TGA TCM TGG CTC AG-3’;P2:5’-TAC GGY TAC CTT GTT ACG ACT T-3’),对分离纯化菌株进行16S rDNA部分序列的扩增。聚合酶链式反应(polymerase chain raction,PCR)条件为95 ℃、2 min;94 ℃、60 s,56 ℃、50 s,72 ℃、1 min,30 个循环。将扩增产物进行琼脂糖凝胶DNA回收,并与质粒载体pMD18-T vector进行连接,将连接产物转入100 μL E. coli DH5α感受态细胞,蓝白筛选之后,挑取单菌落在含有氨苄青霉素(50 mg/mL)的5 mL LB液体培养基中37 ℃、170 r/min振荡培养过夜,提取质粒(30 μL),并送交博仕生物技术有限公司进行测序。将测序得到的序列提交GenBank数据库,应用BLAST程序与数据库中已有的细菌16S rDNA序列进行同源性比较分析。综合分析分离纯化菌株的形态、生理生化和16S rDNA测序结果,判断菌株的种属分类地位。
1.4 数据统计分析
每项实验均重复进行3 次,数据以 ±s表示。运用SPSS Statistics19软件对数据进行统计学分析,P<0.05,差异显著。
2 结果与分析
2.1 pH值和总酸含量变化结果
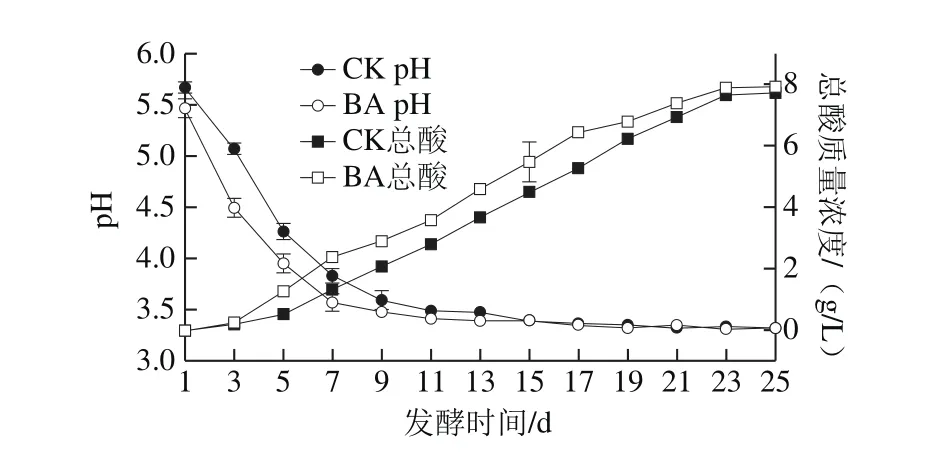
图1 酸菜发酵过程中pH值和总酸含量的变化Fig. 1 Changes in pH value and acidity during fermentation of pickled Chinese cabbage
由图1可知,在发酵起始阶段(1 d),pH 5.5~5.7,随着发酵时间的延长,pH值呈现先急速下降后趋于稳定的趋势,且BA中pH值下降速率快于CK。在发酵末期,BA的pH值略低于CK,分别为3.32±0.02和3.37±0.04。一般来说,酸菜发酵液的pH值达到3.5~3.8,认为酸菜已成熟,风味品质最佳,即可食用。
总酸含量随发酵时间的延长不断增加,且BA总酸含量增加速率快于CK。这是因为发酵初期,BA中L. casei 11MZ-5-1繁殖速率快,进行同型乳酸发酵产生大量乳酸,CK中LAB含量较少,繁殖周期较长,产酸量低于BA。同时,有机酸的大量积累,能够抑制LAB菌群生长,而L. casei 11MZ-5-1耐酸性较强,导致BA总酸含量持续增加。在发酵末期,总酸质量浓度分别为(7.59±0.11)g/L(CK)和(7.88±0.09)g/L(BA)。
2.2 亚硝酸盐含量和VC含量的变化
如图2所示,CK中亚硝酸盐的含量呈先升高后降低的趋势,在发酵第7天时出现一个明显的亚硝酸盐峰,峰值为(18.35±0.27)mg/kg,直至第17天几乎消失。因为发酵初期,LAB含量较少,杂菌含量较多,尤其是含硝酸盐还原酶的杂菌能够将硝酸盐还原成亚硝酸盐,导致形成亚硝酸盐峰[24]。而BA中始终没有出现亚硝酸盐峰,含量维持在1.00 mg/kg以下,在发酵末期为(0.27±0.04)mg/kg,远低于国家卫生标准(20.00 mg/kg)。这是因为发酵初期L. casei 11MZ-5-1产生大量乳酸,有效抑制其他杂菌的活动。
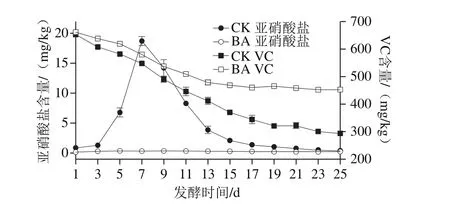
图2 酸菜发酵过程中亚硝酸盐含量和VC含量的变化Fig. 2 Changes in nitrite and VC content during fermentation of pickled Chinese cabbage
VC的含量随着发酵时间的延长,呈现明显的下降趋势,在发酵末期趋于稳定,且CK中VC含量下降速率快于BA。这是由于VC是己糖衍生物,易溶于水,在酸性环境中稳定[17]。L. casei 11MZ-5-1在BA中大量繁殖,迅速产酸,减慢VC的降解速率,在发酵15 d稳定在438~445 mg/kg。CK中,发酵初期总酸含量较低,微生物种类比较复杂,更多地利用VC,使得VC含量下降较快,最终为(287.76±5.81)mg/kg,少于BA。因此可以看出,L. casei 11MZ-5-1作为发酵剂,不仅可以迅速降低发酵系统的pH值,还可以防止VC的降解,显著改善酸菜的品质。
2.3 风味物质的含量变化
由表1可知,乳酸在2 个发酵系统中都随着发酵时间的延长,呈现先急速上升后缓慢上升最后趋于平稳的趋势,在发酵末期质量浓度达到最高,分别为(7.02±0.11)g/L(CK)和(8.98±0.46)g/L(BA)。乳酸是代表酸菜营养程度的指标,一般在乳酸含量不明显增加的时间结束发酵,获取酸菜产品[25]。本研究发现BA中乳酸的含量始终高于CK并先于CK达到最高值趋于稳定。此趋势与崔松林等[26]研究酸菜发酵过程中乳酸变化情况相同。乙酸在两种发酵系统中的变化趋势与乳酸相一致,在发酵末期,质量浓度分别为(0.53±0.02)g/L(CK)和(0.50±0.03)g/L(BA)。柠檬酸、琥珀酸和苹果酸含量呈现先上升后下降最终趋于稳定的趋势。柠檬酸可以为酸菜提供温和爽快、有新鲜感的感官品质,也是酸菜发酵过程中风味形成的重要参考指标。发酵末期,BA中有机酸的含量高于CK。出现这种情况可能是因为CK中的细菌种类较多,影响或阻止了发酵过程的正向发展,而BA中由于外源的接入L. casei 11MZ-5-1,导致发酵环境相对较早的形成,菌体通过代谢产生大量的有机酸,迅速降低发酵系统的pH值,缩短发酵周期。
随着发酵时间的延长,甘油含量呈现先升高后下降的趋势,且BA高于CK,在发酵末期分别为(0.36±0.02)g/L和(0.31±0.03)g/L(P<0.05)。甘露醇含量也呈现先升高后降低的趋势,BA峰值出现早,在发酵末期,质量浓度分别为(12.28±0.30)g/L(CK)和(13.82±0.42)g/L(BA)。乙醇含量变化趋势同乳酸,随着发酵时间的延长,含量不断上升,在发酵末期保持稳定,两体系相差较小。2,3-丁二醇含量变化与甘油含量的变化趋势一致,呈现先升高后降低的趋势,且BA始终高于CK,在发酵末期分别为(0.13±0.02)g/L(CK)和(0.22±0.02)g/L(BA)(P<0.05)。由上可知,在酸菜发酵末期,甘油、甘露醇、2,3-丁二醇在BA内的含量高于CK。因此,L. casei 11MZ-5-1能够显著地改善酸菜的品质,为酸菜带来更丰富的风味、口味。

表1 酸菜发酵过程中9 种代谢产物的含量Table 1 Contents of 9 metabolites during fermentation of pickled Chinese cabbage
如图3所示,BA中挥发性化合物的总相对含量为(91.13±4.29)%,显著高于CK((78.44±2.61)%)(P<0.05)。在BA样品中,除烷类的含量显著低于CK((19.31±1.87)%)(P<0.05),酯类、萜类、醛类、酮类、醚类、醇类、苯及衍生物类、萘及衍生物类、含硫化合物和杂环化合物的含量均高于CK。大量研究发现,烷类对酸菜风味的贡献较小[27];醛类可以赋予酸菜清香、坚果香和果香[28];酮类赋予酸菜奶油的香味;醇类赋予酸菜水果香、甜香以及酒香味[29]。L. casei 11MZ-5-1发酵酸菜中各挥发性化合物均处于较高水平,因此风味浓郁。
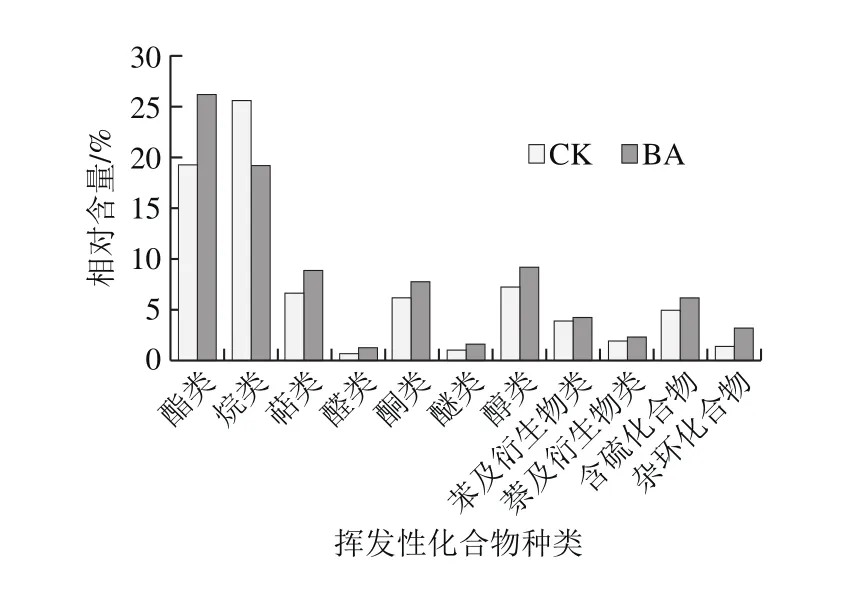
图3 酸菜样品挥发性化合物相对含量Fig. 3 Relative contents of flavor compounds in pickled Chinese cabbage
2.4 酸菜感官评价结果
对比2 种酸菜样品,BA样品整体感官评分为(2.33±0.12)分,高于CK样品((1.87±0.06)分)。从色泽、香气、口味、脆度等指标进行评价,BA的分数均高于CK(P<0.05)。由此看出,L. casei 11MZ-5-1作为发酵剂可显著改善酸菜的感官品质。
2.5 L. casei 11MZ-5-1酸菜发酵过程中菌体的多样性及演替分析
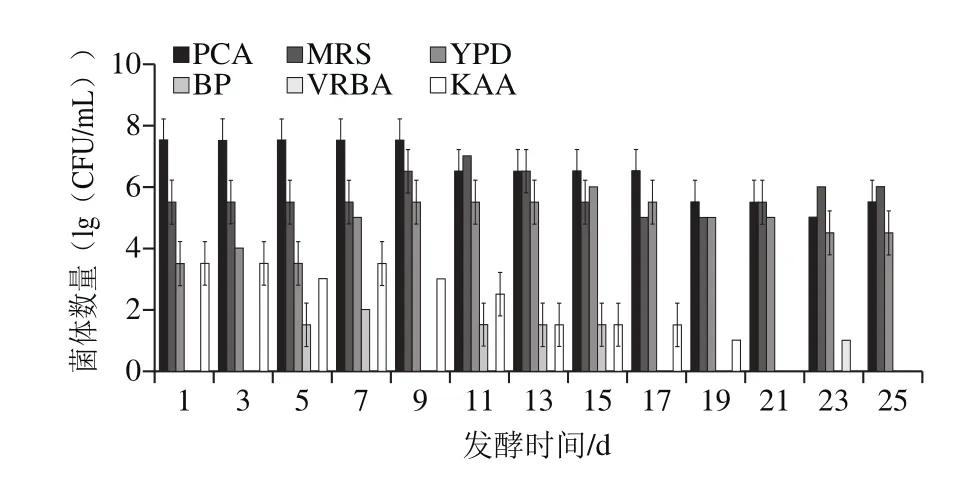
图4 L. casei11MZ-5-1酸菜发酵过程中菌体数量变化Fig. 4 Change in bacterial number during L. casei 11MZ-5-1 fermentation of pickled Chinese cabbage
利用不同种类选择培养基,分离酸菜发酵过程中的菌体,结果如图4所示。在整个发酵过程中共分离得到6 类菌体,分别为LAB、好氧菌、Saccharomyces、Enterobacter、Enterococcus和E. coli,并未分离得到S. aureus、B. cereus、Clostridium difficile、L. monocytogenes和Salmonella。LAB作为优势菌在数量上呈现先增加后保持不变的趋势,好氧菌则呈平稳生长趋势;Saccharomycetes、Enterobacter、Enterococcus和E. coli的菌体数量则呈现不断降低的趋势。在发酵末期,未检测到Enterobacter、Enterococcus和E. coli。因此,可以看出,随着发酵时间的延长,LAB逐渐成为发酵系统的优势菌,主导整个发酵过程,而Enterobacter等菌体因为耐酸能力较低,不能在较酸的环境下生存,因此随着LAB数量的增加逐渐减少。
2.6 L. casei 11MZ-5-1酸菜发酵过程中菌体种类鉴定结果
本研究从L. casei 11MZ-5-1酸菜发酵液中共分离得到14 株细菌,少于自然酸菜发酵液(18 株)[18],分别编号1~14。14 株细菌的显微形态及菌落形态统计如表2所示。其中MRS培养基中共分离出5 株LAB,多于其他种类菌体,菌体直径均小于1 mm,呈乳白色、杆状,革兰氏阳性(G+);PCA培养基中分离出的菌体,菌落大小不一,表面光滑,菌体形态为球状。从BP、YPD、VRBA和KAA培养基中分别分离出2、2、1 种和2 种菌体,其中9号菌为红色,显著有别于其他菌体。
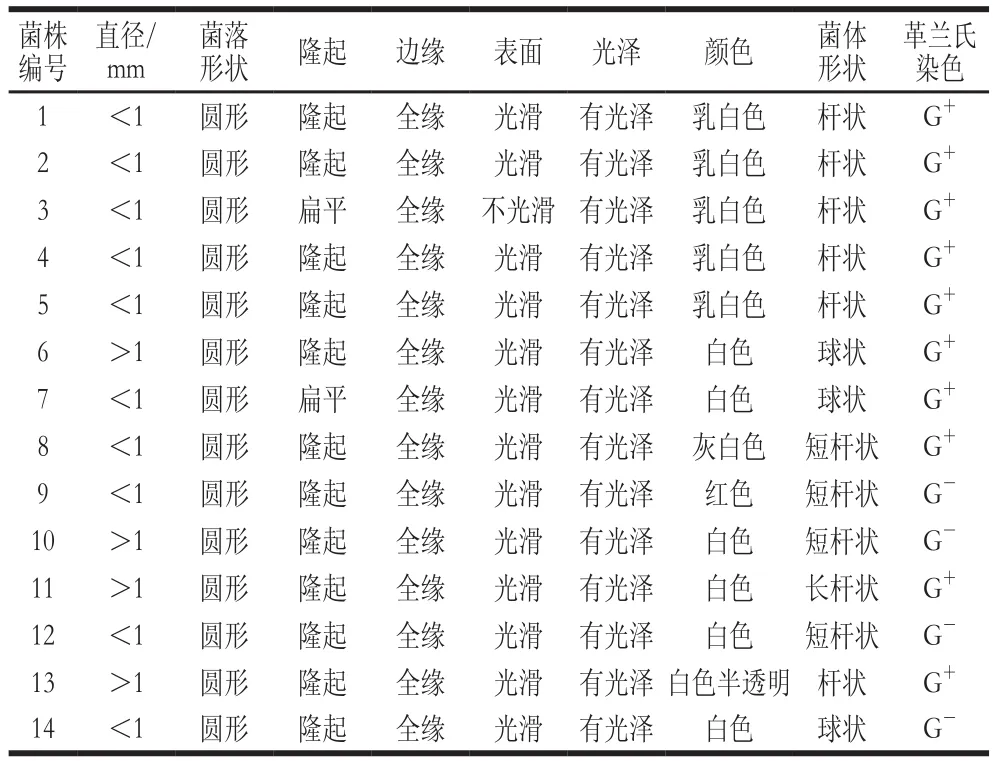
表2 L. casei 11MZ-5-1酸菜发酵系统中菌株菌落形态及显微形态特征Table 2 Colony and microscopic morphology of bacteria isolated from L.casei 11MZ-5-1 fermented Chinese cabbage samples
经生理生化鉴定及16S rDNA鉴定(表3),结果显示1号为L. casei,NCBI序列比对结果与菌株NC014334.1具有较高的相似度,且结果与先前的研究一致[19];3、4号为L. brevis,且NCBI序列比对结果与菌株AP012167.1具有较高的相似度,因此将这2 株菌统一分类为同一株L. brevis;7和13号为未培养细菌;2号为Lactobacillus;5号为L. plantarum;6号为Acinetobacter sp.,8号为Enterobacter sp.,9号为Klebsiella pneumoniae,10号为C. albicaus;11号为Saccharomyces,12号为E. coli,14号为Staphylococcus sp.。贺稚非等[30]通过对酸菜发酵过程中微生物群落进行分析得出,在酸菜发酵过程中,原料表面上的微生物生长繁殖,主要有Saccharomyces、Lactococcus、Pseudomonas、Enterobacter等;同时,LAB也有所增加,主要为Lactococcus、Leuconostoc和Pediococcus等,但产酸量低;当发酵进入中期时,Lactobacillus大量繁殖,产生较强的酸性、缺氧环境,使得不耐酸的Enterobacter等细菌以及霉菌受到抑制;随着发酵的不断进行,发酵液中的微生物主要是Lactobacillus、Lactococcus和Saccharomyces。本研究BA中菌群的演替情况与前者的研究较为相似。因此可以看出L. casei 11MZ-5-1作为发酵剂,不仅可以防止腐败菌的生成,减少发酵系统中菌群的种类及数量,还可以缩短发酵周期,使发酵系统向正向快速发展。
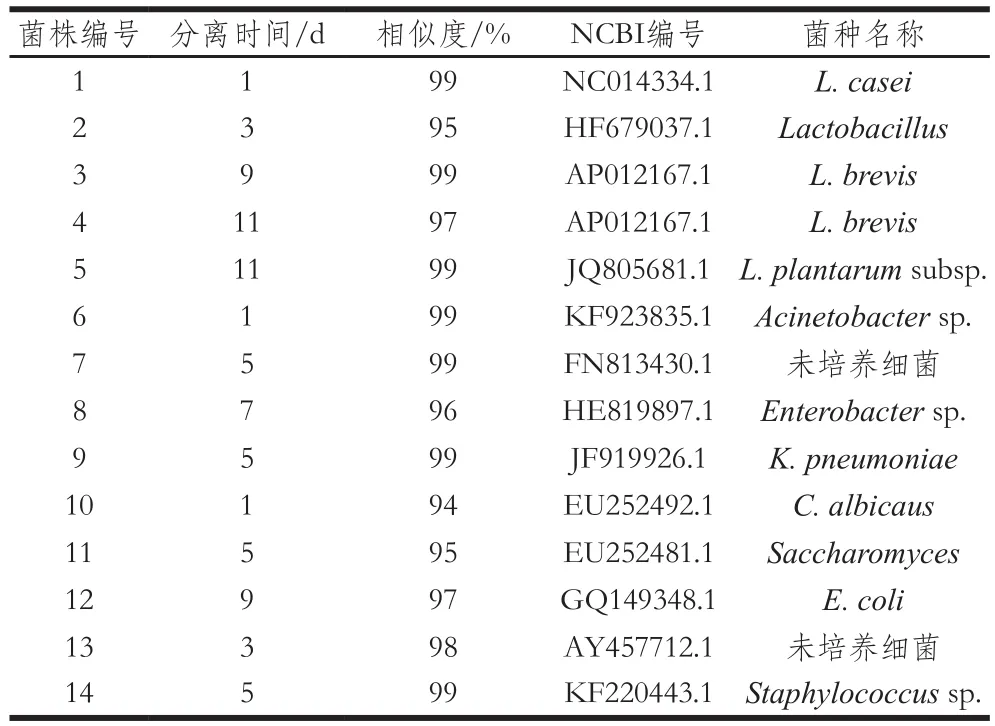
表3 L. casei11MZ-5-1酸菜发酵过程中分离菌株16S rDNA BLAST比对结果Table 3 16S rDNA sequence analysis by BLAST of strains isolated from L.casei11MZ-5-1 fermented Chinese cabbage pickle
3 结 论
本研究以分离自酸菜发酵液的L. casei 11MZ-5-1为发酵剂,对比分析L. casei 11MZ-5-1发酵酸菜和自然发酵酸菜样品重要代谢物、挥发性风味物质的含量及菌群分布情况。总酸含量与VC含量呈正相关,与亚硝酸盐含量呈负相关。其中L. casei 11MZ-5-1发酵酸菜中,总酸含量较高,VC含量最大,亚硝酸盐含量最低,甘油、甘露醇、2,3-丁二醇等有益代谢产物及挥发性风味物质的含量高于自然酸菜发酵微生物生态系统。此外,随着发酵的进行,两体系中细菌大量繁殖。自然酸菜发酵微生物生态系统微生物种类高于L. casei 11MZ-5-1发酵酸菜微生物生态系统,且在整个发酵过程中,L. casei始终保持优势地位。由此可以看出,L. casei 11MZ-5-1作为酸菜发酵剂,可以增加酸菜的总酸含量,降低亚硝酸盐含量,防止VC降解,加强风味物质含量,防止腐败菌的生长,从而提高酸菜安全性和营养价值。

