斑马鱼ints12的CRISPR/Cas9敲除及其对UsnRNA剪接的调控
黄思雨 何牡丹 王厚鹏 孙永华
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072;2. 中国科学院大学现代农业科学学院, 北京 100049)
在生物体中, 前体mRNA(pre-mRNA)经过一系列加工得到成熟的mRNA, 其中包括前体mRNA中内含子的剪切, 这一过程主要由剪接体完成[1]。U-snRNAs (U-rich small nuclear RNAs)是剪接体中的主要核酸组分[2,3]。UsnRNAs是一些富含尿嘧啶的小核RNA, 主要包括有U1-U6等6种UsnRNA。除U6 snRNA由RNA聚合酶Ⅲ转录外, 其余的UsnRNAs都由RNA聚合酶Ⅱ转录, 并产生带有3′延伸端的RNA前体[4], 这些RNA前体被进一步加工, 剪切掉3′延伸端, 产生成熟的UsnRNAs, 成熟的UsnRNAs被运送到细胞质中与RNA剪切相关蛋白结合组成UsnRNPs[5,6], 发挥剪接复合体的功能。
UsnRNAs由特定的启动子转录, 形成UsnRNA-3′box前体, 其3′box将被剪切形成成熟的UsnRNA。研究表明, UsnRNA特定的启动子及其剪切位点下游的3′box元件都是通过剪切形成成熟UsnRNAs所必需的[7—9]。近年的研究发现, 在UsnRNAs的转录过程中, 整合因子(Integrator)复合体对UsnRNAs的3′端加工至关重要。整合因子复合体在进化上非常保守, 其直接与RNA聚合酶Ⅱ的C端结构域相互作用[10,11]。在转录起始时, 整合因子复合体便结合在RNA聚合酶Ⅱ的C端结构域上[12], 随着转录的进行,当UsnRNAs前体的3′box元件被转录出来后, 整合因子复合体便结合在3′box元件上, 对3′ box元件进行剪切, 从而产生成熟的UsnRNAs。
整合因子复合体包含有14个亚基, 理论上破坏任何一个亚基都会导致UsnRNAs的3′端剪切出现错误[13]。INTS12 (Integrator subunit 12)是整合因子复合体的第12个亚基, 也是其中最小的一个亚基,其分子量约为53 kD[14]。INTS12由N端结构域、PHD结构域和富含丝氨酸的C端结构域组成, 在整合因子复合体中INTS12与INTS1直接作用在一起[14,15]。斑马鱼是研究发育生物学和模拟人类疾病的良好模型[16,17]。利用斑马鱼模型的研究发现, ints5通过调节Smad/BMP信号通路影响胚胎的造血作用[18],ints6通过某种未知的机制限制胚胎的背侧组织发育[19]。但是, 人们对整合因子复合体其他成员在胚胎和个体发育中的功能仍知之甚少。特别是关于INTS12的功能研究, 主要集中于体外培养的细胞水平进行[20]。
基因敲除是研究基因功能的重要技术手段之一, 第三代人工核酸内切酶技术CRISPR/Cas9近年来已被广泛运用于各种模式生物的基因功能研究中。我们在前期研究中发现nanog的母源合子突变体(MZnanog)中ints12的表达水平显著降低(另文发表)。在本研究中, 我们利用CRISPR/Cas9技术构建了ints12的基因敲除品系, 发现ints12对斑马鱼UsnRNA的剪切、个体发育和性别分化有着重要作用。
1 材料与方法
1.1 实验材料
本研究所用AB品系的野生型斑马鱼来自于国家斑马鱼资源中心(武汉, http://zfish.cn)。斑马鱼饲养于28.5℃恒温及14h∶10h光暗周期条件下。用于显微注射的胚胎由雌鱼和雄鱼自然产卵而得。胚胎发育阶段定义参照文献[21]。
1.2 方法
基因克隆利用原肠期斑马鱼胚胎cDNA为模板, 参考Ensembl网站上的推导的ints12编码序列(ENSDARG00000091678)设计特异引物(F: 5′-CGGGATCCATGGCTGGGACAGTAAGTCT-3′; R:5′-CCATCGATTCATTTCTTCAGTTTTTTCT-3′),PCR扩增斑马鱼ints12基因编码序列, 用PCR产物纯化试剂盒(Thermo, 美国)回收, 克隆入体外转录载体pCS2+, 测序鉴定。将测序正确的重组质粒对应的菌液扩大培养, 用质粒提取试剂盒(Omega, 美国)提取质粒。
原位杂交将pCS2-ints12克隆载体用限制性内切酶BamHⅠ线性化, 电泳检测酶切效率, 用DNA纯化试剂盒(Thermo, 美国)回收模板。按以下反应体系合成反义RNA探针: DNA模板1 μg, 5× transcription buffer 2 μL, DIG-RNA labeling mix 1 μL,DTT 0.5 μL, RNAsin 0.5 μL, T7 RNA聚合酶1 μL,补水至10 μL, 在37℃反应2h, 加入2 μL不含RNA酶的DNaseI和18 μL无酶水, 37℃孵育15min。加入1 μL EDTA (1 mol/L, pH 8.0)终止反应, 用Sigma Spin reaction clean-up Kit回收探针。
取发育到实验所需时期的胚胎, 置于4%多聚甲醛(PFA)中在4℃固定过夜, 第二天将胚胎脱水保存至甲醇中。按照文献中的方法进行原位杂交实验[22]。
反转录定量PCR(qRT-PCR)取发育至特定时期的不同样品的斑马鱼胚胎, 用Trizol法提取总RNA, 使用微量分光光度计(Nanodrop 2000,Thermo Scientific, 美国)测定RNA的浓度和纯度。使用RevertAid First Strand cDNA Synthesis Kit(Thermo, 美国)逆转录试剂盒逆转录cDNA。配制反应体系: 2× SYBR Green mix 10 μL, 基因特定的定量PCR正反向引物各0.5 μL, 纯水8 μL, 在Bio-Rad CFX96定量PCR仪中进行扩增反应, 反应条件:95℃ 3min, 94℃ 15s, 60℃ 15s, 72℃ 45s, 40个循环。实验结果采用2-△△Ct法进行分析[23]。内参采用U6或者β-actin。
gRNA设计和制备针对ints12基因组上编码Ints12 PHD功能域的第3号外显子, 利用CRISPR-scan设计gRNA靶点, 靶点序列为GGAAATGGG TCTTGCTTGTGtgg, 其中小写字母为PAM序列。以质粒pT7-gRNA骨架为模板, 利用含有T7启动子和gRNA靶点序列的特异性上游引物和通用下游引物gRNA-RP(表 1)扩增gRNA模板[24]。反应体系:2×EsTaqMasterMix(康为世纪, 北京)25 μL, 上下游引物各2 μL, pT7-gRNA模板1 μL, 补水至20 μL。反应条件: 94℃ 5min, 94℃ 30s, 60℃ 30s, 72℃ 30s,30个循环; 最后72℃ 2min。用PCR产物纯化试剂盒回收模板, MAXIscript T7 Kit (Ambion, 美国)试剂盒体外转录gRNA, 用 DNase Ⅰ(NEB, 英国)去除DNA模板, 再用Post-reaction clean up Kit (Sigma, 美国)试剂盒纯化回收gRNA, 琼脂糖凝胶电泳检测gRNA质量并测定浓度。
Cas9 mRNA的合成体外转录斑马鱼密码子优化的Cas9 mRNA[25]。用限制性内切酶线性化载体, 回收酶切产物, 使用mMessage mMachine sp6 UltraKit (Ambion, 美国)体外转录试剂盒进行转录mRNA, 用微量分光光度计测浓度和纯度, 用琼脂糖凝胶电泳检测mRNA的质量。
显微注射及突变体的筛选将gRNA和Cas9 mRNA同时注射到1细胞期的胚胎中, 然后使用0.3×Danieau's Buffer于28.5℃生化培养箱中培养至24h, 随机取30颗胚胎, 用斑马鱼快速裂解试剂盒(成都福际生物技术有限公司)提取基因组DNA, 用靶点上下游的扩增引物ints12-cas9-F、ints12-cas9-R(表 1)扩增靶点区域片段。对PCR产物进行Sanger测序, 通过读取测序峰图, 判断靶点是否有效[25]。将靶点有效的胚胎养至性成熟, 与野生型测交, 取30颗所产F1代胚胎, 提基因组DNA并测序。选取F1代胚胎发生突变的P0代测交, 大量饲养F1代至性成熟。取F1代剪尾鳍提基因组DNA、PCR扩增、测序, 筛选发生有效突变的阳性F1代, 与野生型杂交获得F2代杂合子。同时, 利用野生型和突变体基因组序列的差异, 设计、筛选出能够PCR鉴定突变型的引物对ints12-wt-F、ints12-mu-F、ints12-R(表 1), 用于批量筛选突变体。将同一基因型的性成熟F2代杂合子自交, 获得包含纯合子的F3代群体。通过PCR筛选结合克隆测序, 鉴定F3代纯合子个体。

表 1 实验所用引物及其序列Tab. 1 Primers used in this study
2 结果
2.1 ints12在斑马鱼中广泛表达并在物种间高度保守
斑马鱼Ints12由N端结构域、PHD结构域和富含丝氨酸的C端结构域组成, 包含479个氨基酸(图 1a)。我们比对人(Homo sapiens)、小鼠(Mus musculus)和斑马鱼INTS12的氨基酸序列, 发现INTS12负责核酸蛋白互作的PHD结构域在各物种间高度保守, 提示ints12的主要功能在各个物种间也应该十分保守;同时, 其N端和C端存在较大的序列差异, 提示斑马鱼Ints12蛋白与哺乳动物相比, 在结构和蛋白互作上具有一定的种属特异性(图 1b)。
为了研究ints12在斑马鱼中的表达情况, 我们通过原位杂交和定量PCR的方法检测ints12在野生型早期胚胎中的表达量, 发现ints12在受精卵时期的胚胎中表达量最高, 在2h、4h和6h的胚胎中, 表达量随着胚胎的发育而减少; 当胚胎发育至受精后1d (1 day-post-fertilization, 1dpf)时,ints12的表达区域广泛, 但在中枢神经的表达量相对较高(图 2a、2b)。通过定量PCR检测野生型各组织中ints12的表达量, 发现ints12在各组织中都有表达, 但在卵巢中的表达量最高(图 2c)。以上结果提示Ints12可能作为母源因子发挥作用。
2.2 利用CRISPR/Cas9技术构建ints12基因敲除品系
为了尽可能破坏ints12的结构和功能, 我们将gRNA靶点选择在PHD结构域的起始处, 即ints12的第3号外显子末端(图 3a)。取30颗敲除后胚胎, 提取基因组, 扩增包含靶点的检测序列, 使用PCR产物的直接Sanger测序法判断靶点有效性(图 3b)。通过P0代与野生型测交, 筛选产生有效突变的F1代杂合子, 得到缺失8个碱基和缺失13个碱基的两个突变品系(图 3c)。野生型斑马鱼编码的Ints12蛋白含有479个氨基酸, 而缺失8个碱基的突变品系编码的Ints12蛋白在第164个氨基酸处出现错误翻译, 并在第182个氨基酸处提前终止翻译; 缺失13个碱基的突变品系编码的Ints12蛋白在第161个氨基酸处出现错误翻译, 并在第165个氨基酸处提前终止翻译(图 3d)。
因为2个突变品系的纯合子突变体的表型一致,所以后续实验我们统一使用缺失13个碱基的突变品系。为了更方便能直接使用PCR的方法鉴定突变品系, 我们在突变位点分别针对野生型序列和突变型序列设计两条不同的上游引物, 再使用同样的下游引物分别扩增。野生型引物能扩增出条带而突变型引物不能扩增出条带的模板为野生型; 野生型引物和突变型引物都能扩增出条带的模板为杂合子突变体; 野生型引物不能扩增出条带而突变型引物能扩增出条带的模板则为纯合子突变体(图 3e)。利用上述引物对非常方便地筛选出足够数目的F2代ints12突变杂合子及F3代合子型突变纯合子(Zints12), 以供进一步研究。
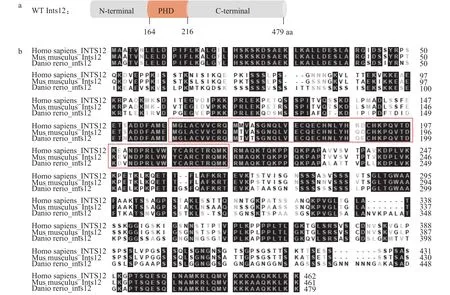
图 1 Ints12的PHD功能域在物种间高度保守Fig. 1 The PHD domain of Ints12 is highly conserved among species
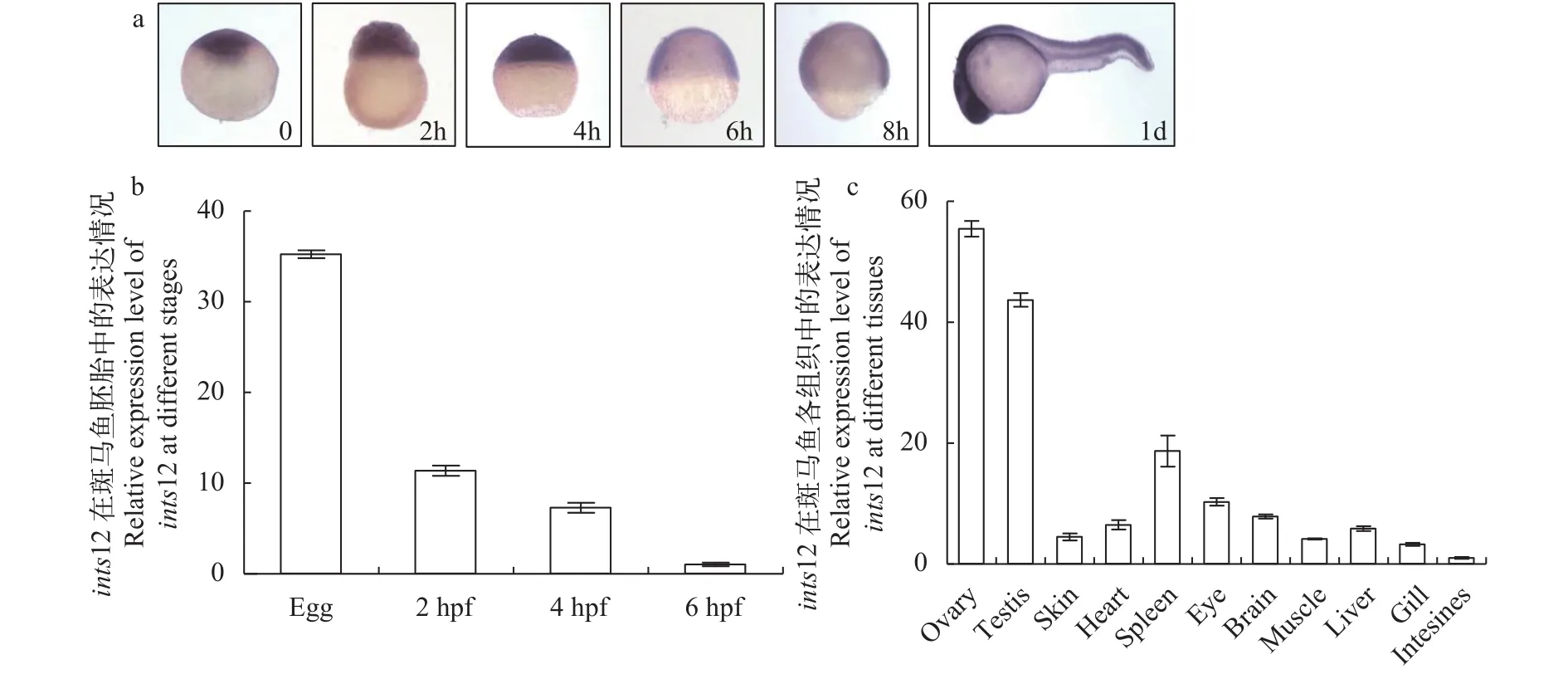
图 2 ints12在斑马鱼胚胎和各组织中的表达情况Fig. 2 Relative expression levels of ints12 in different embryonic stages and different tissues
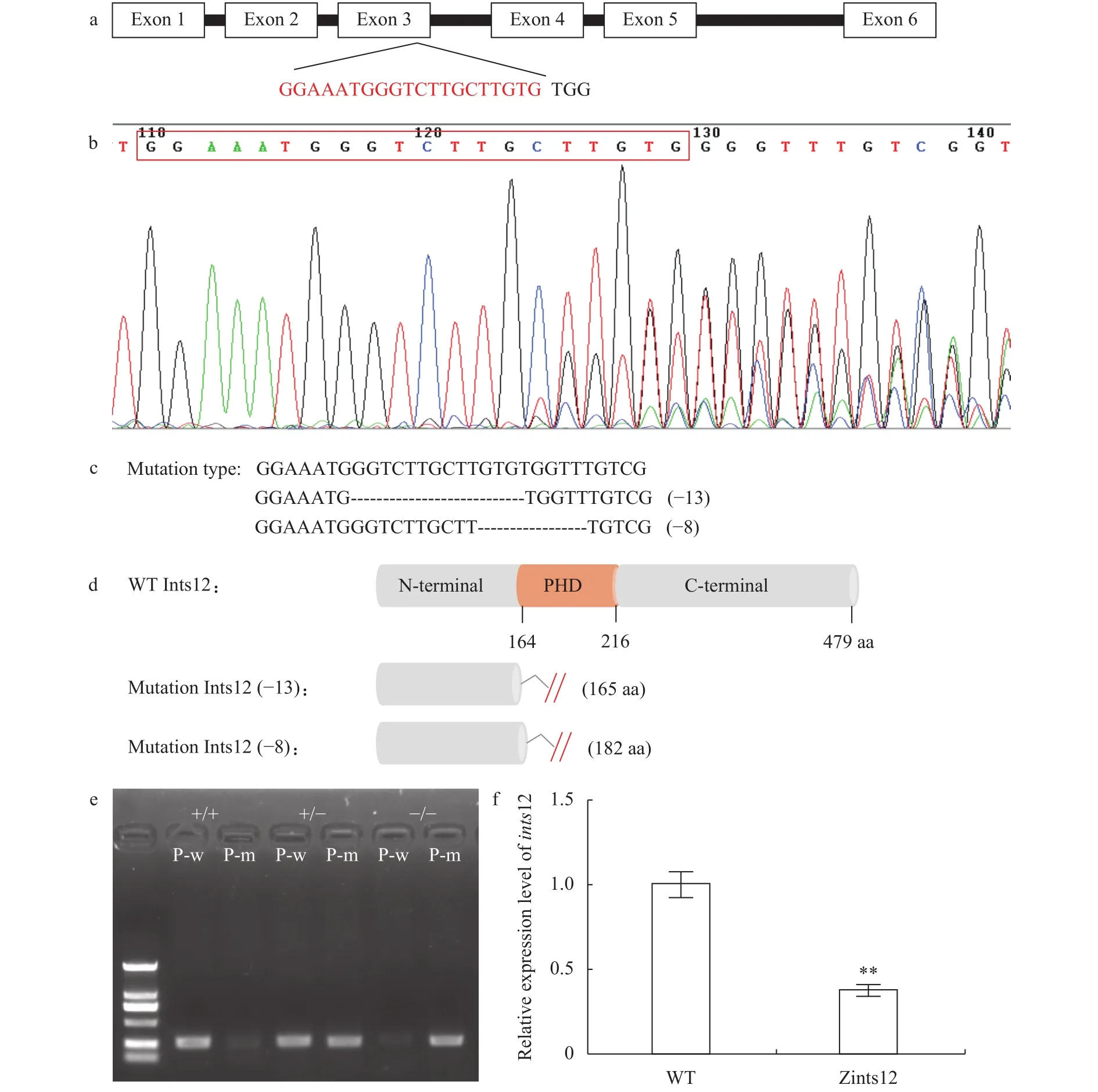
图 3 运用CRISPR/Cas9技术敲除斑马鱼ints12Fig. 3 Knockout of zebrafish ints12 by CRISPR/Cas9
为了证实合子型纯合突变体Zints12中ints12基因被有效敲除了, 我们通过qRT-PCR的方法检测Zints12中ints12的表达量, 与野生型相比, Zints12中ints12的表达量显著减少, 表明Zints12中ints12的敲除导致其自身mRNA水平的降低有效(图 3f)。
2.3 ints12基因敲除品系中的UsnRNA剪切障碍和细胞增殖缺陷
将同一基因型的F2代杂合子自交, 获得包含纯合子的F3代群体, 利用尾鳍DNA PCR鉴定, 并通过Sanger测序进一步确认, 鉴定F3代纯合子。有趣的是, 我们发现纯合子的比例仅为9.5% (9/95), 而杂合子比例为58.9% (56/95), 野生型比例为31.6%(30/95)。纯合子的比例明显低于理论值1/4, 并且筛到的纯合子全为雄性, 个体尺寸相对于野生型(WT)普遍偏小, 而杂合子则没有明显的生长缺陷。
我们观察同年龄3个月大的雄性WT和Zints12,发现Zints12个体大小明显小于野生型(图 4a)。持续观察记录以体长为标志的雄性Zints12的生长, 发现Zints12的生长比野生型显著缓慢(图 4b)。我们分别测量20条3月龄时WT和Zints12的体重, 发现Zints12的体重相比野生型显著偏轻(图 4c)。
我们通过qRT-PCR检测Zints12中细胞增殖相关基因ccnd1[26]、pcna[27]、mki67[28]的表达水平, 发现ccnd1、pcna、mki67在Zints12中都显著性下调表达, 因此推测Zints12个体偏小应与Zints12中细胞增殖缺陷相关(图 4d)。
为了研究斑马鱼中ints12对UsnRNA剪切的作用, 我们运用qRT-PCR检测Zints12中没有被正确剪切的UsnRNA的3′box段[29], 结果发现在Zints12中存在大量未被正确剪切的UsnRNA, 且与野生型具有显著性差异(图 4e)。这说明在Zints12中UsnRNA的剪切存在明显障碍,ints12的缺失造成UsnRNA的剪切异常。
因为成熟的UsnRNA在编码基因pre-mRNA的内含子剪切过程中有重要作用, 我们猜想Zints12中成熟UsnRNA的缺失, 是否会进一步影响Zints12中pre-mRNA的内含子加工呢? 我们利用ints12第2、4号内含子特异的引物(表 1), 检测ints12基因的内含子滞留水平, 相较于外显子特异引物的结果(图 3f),结果发现Zints12中ints12存在显著更高水平的内含子滞留, 这表明Zints12中UsnRNA的剪切障碍使得ints12自身pre-mRNA的加工也出现异常(图 4f)。
3 讨论
本文利用CRISPR/Cas9技术构建了ints12的基因敲除品系, 得到2种突变类型的纯合突变品系。在纯合突变体Zints12中UsnRNA的3′box剪切存在明显的障碍, 这说明斑马鱼中ints12对UsnRNA的3′box剪切有重要的作用。Zints12中UsnRNA的3′box剪切缺陷, 造成Zints12体内缺少成熟的Usn-RNA, 使得pre-mRNA的内含子剪切过程也受阻, 导致Zints12中ints12 mRNA出现大量内含子滞留。
同时,Zints12出现生长缓慢, 体型偏小的现象,并且细胞增殖相关基因的表达水平出现显著性下调。我们推测, 这也是由于Zints12中UsnRNA的3′box剪切缺陷, 影响细胞增殖相关基因的pre-mRNA的正常加工。我们得到的Zints12全为雄性极有可能是由生殖细胞增殖缺陷所导致, 因为早期生殖细胞的数目直接影响到斑马鱼的性别发育[30]。
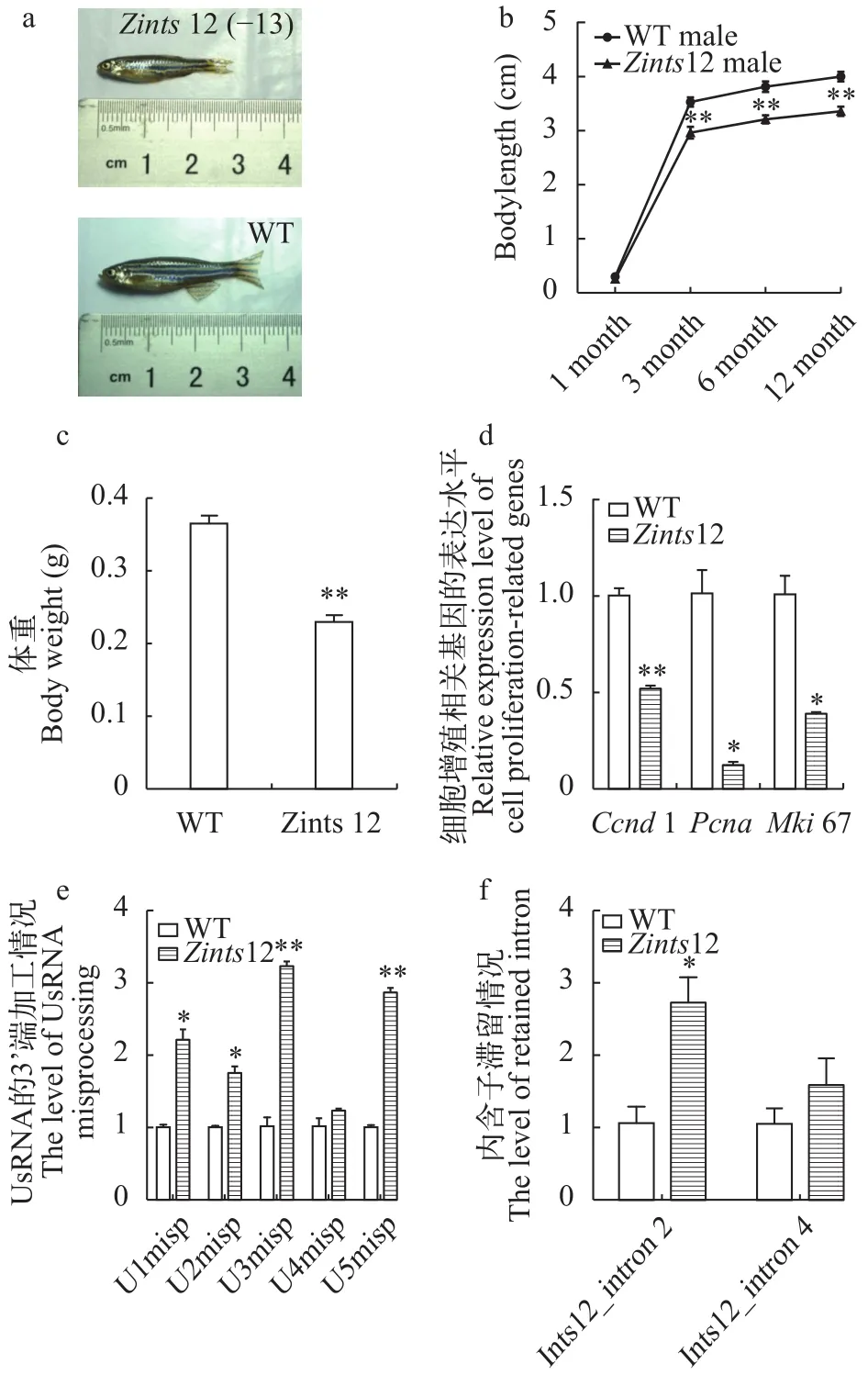
图 4 Zints12中UsnRNA的3′端剪切障碍及细胞增殖缺陷Fig. 4 The misprocessing of UsnRNA 3′ ends and cell proliferation defects in Zints12
由于现阶段有关整合因子复合体的功能研究还不全面, 在脊椎动物体内有关整合因子复合体的研究更少, 我们不清楚整合因子复合体在其他方面的功能以及整合因子复合体各亚基间的联系。根据Zints12体型偏小的表型, 以及Zints12中细胞增殖相关基因表达水平偏低的现象, 我们猜想ints12除了通过UsnRNA影响到编码基因的mRNA加工之外,ints12还可能直接在编码基因的转录和加工过程中发挥作用。近来有研究发现, 整合因子复合体也参与到编码基因转录的暂停及延伸过程[31,32]。由于整合因子复合体各亚基的结构和功能在物种间都十分保守, 我们推测整合因子复合体也可能会直接影响斑马鱼编码基因的转录过程。
由于本研究所获得的Zints12表现为全雄性的表型, 在接下来的研究中, 需要通过生殖细胞替换(借腹怀胎)技术[33], 利用野生型的成鱼批量产生ints12的突变雌雄配子, 以获得ints12的母源合子突变体MZints12, 从而更好地刻画和研究ints12的发育功能。

