禽腺病毒Hexon蛋白多克隆抗体制备及特异性鉴定
牛玉娟,孙芹芹*,赵君,孙伟,张会霞 张桂华,肖一红,商营利,刘思当**
禽腺病毒Hexon蛋白多克隆抗体制备及特异性鉴定
牛玉娟1,2,3,孙芹芹1,2,3*,赵君1,2,3,孙伟4,张会霞1,2,3张桂华1,2,3,肖一红1,2,3,商营利1,2,3,刘思当1,2,3**
1. 山东农业大学 动物科技学院, 山东 泰安 271018 2. 山东省动物生物工程与疾病防治重点实验室, 山东 泰安 271018 3. 山东省畜禽疫病防制工程技术研究中心, 山东 泰安 271018 4. 蓬莱市小门家兽医站, 山东 烟台 265603
本研究旨在制备禽腺病毒(FAdV)Hexon蛋白多克隆抗体并对其特异性进行分析鉴定。通过构建重组的原核表达载体pET-28a-Hexon,转入表达菌BL21 (DE3),IPTG诱导,并运用SDS-PAGE进行重组蛋白的鉴定,最后纯化蛋白。利用纯化的融合蛋白进行常规新西兰大白兔免疫,以制备Hexon蛋白的多克隆抗体。采用间接免疫荧光、免疫组织化学和Western blot的方法鉴定多克隆抗体的特异性。结果表明,Hexon蛋白的原核表达量较高,并且是以包涵体的形式存在,分子质量大小约为43 kDa;免疫兔后获得能与FAdV发生特异性反应且高效价的多克隆抗体。因此,本试验制备的FAdV Hexon蛋白的多克隆抗体证明特异性良好,为后期禽腺病毒病的诊断、致病机制研究及亚单位疫苗的研制提供了良好的物质基础。
禽腺病毒;基因; 多克隆抗体; 特异性
禽腺病毒(fowl adenovirus, FAdV) 依据抗原的不同分为3个群,其中Ⅰ群腺病毒又可分为5个亚群(A~E)、12个血清型(FAdV-1至8a和8b至11)[1]。1963年和1987年分别在美国和巴基斯坦爆发了包涵体肝炎病(inclusion body hepatitis,IBH)和心包积液综合征病(hydropericardium syndrome,HPS)[2,3],主要侵害雏鸡,多呈急性经过,使世界养禽业遭受灭顶之灾[4-7]。我国于1976年首先在台湾省发现禽腺病毒感染[8],随后在辽宁、山东、内蒙古等多个省份相继发现IBH的流行[9-11],2015年爆发了HPS[12]。
迄今为止,国内在该病毒的致病性机制、血清学诊断方法及亚单位疫苗开发等方面的研究未见报道。鉴于此,本研究从心包积液综合征临床病例中分离得到FAdV,克隆其衣壳蛋白-Hexon部分基因,构建重组原核表达载体pET-28a-Hexon,转入表达菌BL21 (DE3),IPTG诱导表达。
六邻体蛋白(Hexon蛋白)是腺病毒的主要结构衣壳蛋白之一,也是主要的属和亚属特异性抗原决定簇和次要的种特异性抗原决定簇。根据六邻体的三维结构模式,几个比较大的抗原表位区都位于前段loop1和中段loop2,具有型和群的特异性表位,能诱导产生特异性的抗体[11,12]。因此,运用软件预测loop1和loop2中免疫原性较强的一段序列,进行常规的原核表达,制备免疫原,而后对新西兰大白兔进行了三次免疫,以制备抗FAdV Hexon蛋白兔的多克隆抗体。制备特异性强且高效的多克隆抗体可为进一步开展FAdV流行病学调查、疾病诊断、致病机制研究和亚单位疫苗研制提供基础材料。
1 材料与方法
1.1 材料
禽腺病毒血清4型(FAdV-4)SDDM-4/15株、血清8b型(FAdV-8b)和血清11型(FAdV-11)由本实验室分离、鉴定并保存;pET-28a原核表达载体为本实验室提供;病毒DNA提取试剂盒和BL21(DE3)感受态细胞均来自北京全式金生物技术有限公司;rTag酶和限制性内切酶H I和d III均购自宝生物工程(大连)有限公司;FITC-羊抗兔二抗及DAB显色试剂盒购自北京康为生物技术有限公司;Ni- NTA纯化蛋白柱子购自南京金斯瑞生物科技有限公司;ELC显色液购自上海文渊阁生物科技有限公司;原代鸡胚肾细胞(CEK);鸡肝癌细胞(LMH)购自ATCC;胎牛血清购自BI公司。体重2.5 kg左右的新西兰大白兔购自济南实验动物有限公司。
1.2 FAdV-4 Hexon基因的原核表达和纯化
取病毒培养上清,采用病毒DNA提取试剂盒提取病毒基因组DNA,作为FAdV-4基因扩增模板。用DNA star软件预测n基因中免疫原性较强的一段序列(385-1419),并用Primers 6.0 软件根据参考序列(Gene Bank 登录号:KDA877411)设计特异性引物(小写部分为酶切位点),F: 5′-CGggatccCTGGCTCCCAAGGAGTCCATGTTT-3′(引入H I酶切位点);R: 5′-CCCaagcttGACGCGCTTGTTCATGTACTCGTAG-3′(引入d III酶切位点),扩增1052 bp。PCR产物经H I和d III双酶切后与经同样酶切的pET-28a进行连接,并转化入BL21 (DE3)感受态细胞,阳性克隆采用双酶切鉴定和序列测定分析,重组阳性质粒命名为pET-28a-Hexon。将双酶切与测序结果正确的阳性菌接种于新鲜的LB培养基中,活化扩大培养2~3 h,用终浓度为1 mmol/L的IPTG 37 ℃诱导表达3 h。将阳性菌液经13000 r/min 4 ℃离心15 min后,用少量的PBS重悬菌体,然后进行超声破碎后,离心取上清和沉淀,用SDS-PAGE检测目的蛋白的在上清和沉淀中的表达。取超声破碎后的包涵体,加入8 mmol/L的尿素溶解,利用Ni-NTA纯化试剂盒纯化融合蛋白,纯化后的目的蛋白SDS-PAGE鉴定后,放于-80 ℃冰箱保存备用。
1.3 兔抗鸡Hexon多克隆抗体的制备
初次免疫时,将鉴定纯化好的融合蛋白与弗氏完全佐剂按1:1充分混匀乳化,进行背部皮下多点注射3只兔子(1 mg/只)。以后每2周用弗氏不完全佐剂与纯化蛋白1:1混匀皮下注射,加强免疫2次。最后一次免疫一周之后,采血分离血清作为一抗,至-80 ℃保存。
1.4 间接免疫荧光鉴定多克隆抗体特异性
分别将FAdV-4 (SDDM-4/15)、FAdV-8b和FAdV-11接种CEK,病毒侵染3 d,观察到攻毒的细胞形成明显典型的细胞病变,采用多聚甲醛固定细胞,按常规间接免疫荧光步骤进行分析鉴定。一抗为1:200倍稀释,37 ℃孵育1 h,PBS洗3次,分别加入二抗为FITC标记的羊抗兔IgG(1:300倍),37 ℃孵育1 h,PBS洗3次后,每孔加入50mL PBS溶液,置荧光显微镜下观察。
1.5 免疫组织化学鉴定多克隆抗体的特异性
将之前进行FAdV-4攻毒试验第4天固定的各个脏器进行常规石蜡切片[10],之后按照常规的免疫组织化学步骤进行染色,切片孵育兔多克隆抗体(1:100倍),4 ℃过夜孵育,HRP标记的羊抗兔IgG (1:800倍),37 ℃孵育1 h,最后用DAB显色试剂盒显色。阴性对照用未免兔血清代替一抗。
1.6 Western blot 鉴定多克隆抗体的特异性
将MOI为10的FAdV-8b、FAdV-11和FAdV-4接种LMH,待接毒36 h后,收集细胞,裂解进行Western blot分析鉴定。一抗为1:5000倍稀释的兔抗Hexon的多克隆抗体,二抗为HRP标记的羊抗兔IgG(1:5000倍),ECL显色。
2 结果
2.1 FAdV-4 部分Hexon基因的PCR扩增
以提取的FAdV-4基因组为模板,经过PCR扩增获得了与预期大小相符的1052 bp片段(图1A)。之后PCR和I和III双酶的鉴定结果(图1B)均显示重组表达质粒pET-28a-Hexon构建成功,测序结果也证实插入的目的基因大小正确且阅读框没有移码。

图 1 FAdV-4 Hexon部分基因PCR扩增电泳图及重组表达载体pET-28a-Hexon双酶切鉴定电泳
A:M. DL2000 DNA Marker; 1. FAdV-4部分基因扩增产物1052bp; B:M. DL5000 DNA Marker;1. pET-28a载体;2. 重组pET-28a-Hexon双酶切产物。
A: M. DL2000 DNA Marker; 1, FAdV-4partial gene amplification product 1052bp. B: M. DL5000 DNA Marker; 1. pET-28a plasmid; 2. Recombinant pet-28a-bienzymatic product.
2.2 融合蛋白在E.coli BL21(DE3)中的诱导表达及纯化
经SDS-PAGE凝胶电泳验证发现(图2A),诱导后的pET-28a-Hexon在约43 kDa处有1条与预期大小相符的特异蛋白带,而诱导前后pET-28a和诱导前的pET-28a-Hexon却没有相应条带,这与预期结果是一致的,说明融合蛋白诱导表达成功。通过比较上清与沉淀的包涵体蛋白条带发现,绝大部分融合蛋白存在于沉淀包涵体中,而上清中仅有极少量甚至没有该融合蛋白,说明原核表达的该蛋白主要是以包涵体的形式存在菌体内。
超声波破碎重组诱导的菌体,离心分离包涵体,用Ni-NTA纯化重组蛋白pET-28a-Hexon,SDS-PAGE结果表明纯化效果较好(图2B),纯化的蛋白可以作为抗原免疫兔子。

图 2 重组蛋白FAdV-4 Hexon的表达及鉴定
A:M.蛋白质相对分子质量标准; 1. pET-28a诱导前;2. pET-28a诱导后; 3. 重组pET-28a-Hexon诱导前;4. 重组pET-28a-Hexon诱导后;B:M.蛋白质相对分子质量标准; 1. pET-28a-Hexon诱导后超声裂解上清;2. pET-28a-Hexon诱导后超声裂解包涵体;3. 融合蛋白纯化时流出液;4. 融合蛋白纯化的洗脱液。
A: M. Protein relative molecular mass standard; 1. Before the induction of pET-28a; 2.After the induction of pET-28a; 3.Before the induction of recombinant pET-28a-Hexon; 4. After the induction of recombinant pET-28a-Hexon. B: M. Protein relative molecular mass standard; 1. Supernatant of induced pET-28a-Hexon with sonication; 2. Inclusion bodies of induced pET-28a-Hexon with sonication; 3. Fusion protein efflux; 4. Elution solution for fusion protein purification
2.3 间接免疫荧光鉴定多克隆抗体的特异性
间接免疫荧光结果显示,pET-28a-Hexon重组菌诱导表达的Hexon蛋白免疫兔子,制备的多克隆抗体,1:200倍稀释能够与FAdV-4发生特异性反应发出亮绿色荧光,与FAdV-8b和FAdV-11不发生发应(图3)。阴性对照兔血清与FAdV-4、FAdV-8b和FAdV-11都不发生反应(未提供图)。因此,所制备的兔多克隆抗体能够特异的结合FAdV-4。

图 3 IFA鉴定兔多克隆抗体的特异性
A:CEK细胞感染FAdV-4 (400×);B:CEK感染FAdV-8b (200×);C:CEK感染FAdV-11 (200×);D:正常的CEK (200×)。
A: CEK infected with FAdV-4 (400×); B: CEK infected with FAdV-8b (200×); C: CEK infected with FAdV-11 (200×); D: Uninfected CEK (200×).
2.4 免疫组织化学鉴定多克隆抗体的特异性
免疫组织化学检测发现,pET-28a-Hexon重组菌诱导表达的Hexon蛋白免疫兔子,制备的多克隆抗体,1:100倍稀释能够与FAdV-4特异性结合,在肝、胰腺、腺胃、肠道、心、肺、肾、脾组织切片中看到褐色阳性颗粒(图4);用阴性兔血清作为一抗却无特异性着色(未提供图)。
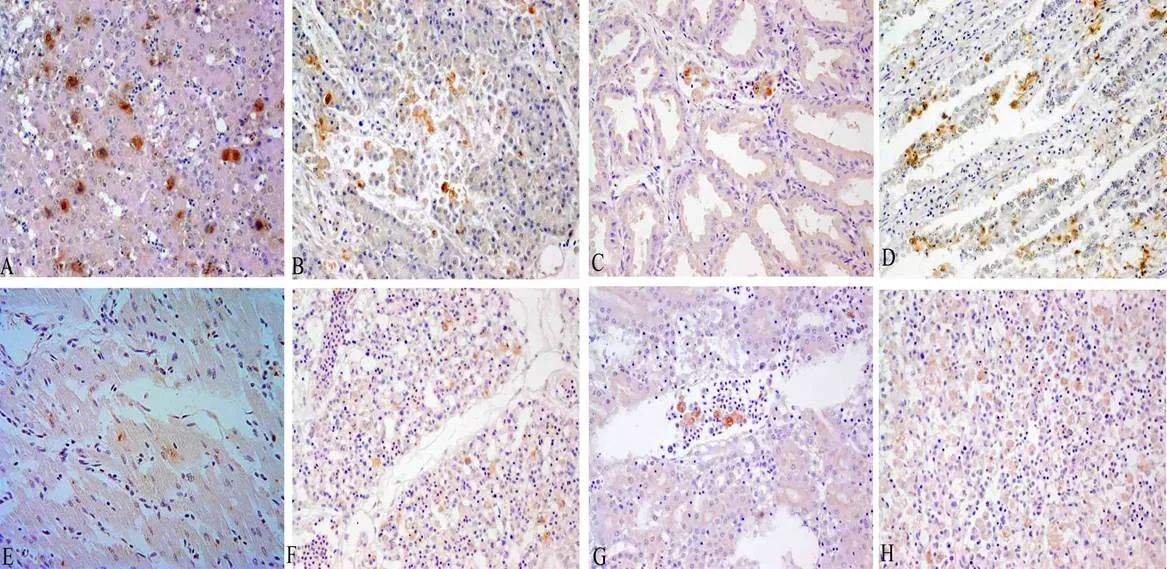
图 4 IHC鉴定兔多克隆抗体特异性
A:肝 (400×);B:胰腺(400×);C:腺胃(400×);D:小肠(400×);E:心脏(400×);F:肺脏(400×);G:肾脏(400×);H:脾 (400×)。
A: Liver (400×); B: Pancreas (400×); C: Glandular stomach (400×); D: Epithelial cells in the intestine (400×); E: Heart (400×); F Lung (400×); G: Kidney (400×); H: Spleen (400×).
2.5 Western blot鉴定多克隆抗体的特异性
Western blot试验结果显示,以兔多克隆抗体1:5000倍稀释,在接毒FAdV-8b和FAdV-11的蛋白泳道中没有出现约110 KD的特异性蛋白,在接毒FAdV-4的蛋白泳道中出现了约110 KD的特异性蛋白条带(图5),表明兔多克隆抗体能与FAdV-4的Hexon蛋白结合,具有良好的特异性。

图 5 Western blot鉴定兔多克隆抗体的特异性
Fig.5 Identification of rabbit polyclonal antibody specificity by Western blot
3 讨论
腺病毒编码的Hexon蛋白是病毒颗粒的主要衣壳蛋白之一,种属之间的基因同源性很低。该蛋白不仅是病毒的主要保护性抗原,也是不同血清型之间存在差异且有决定性的蛋白[11,12]。鉴于Hexon蛋白在FAdV血清学诊断中常被作为包被的抗原及在基因疫苗开发中的应用,故开展本研究。
目前,国内很少关于FAdV-4型Hexon蛋白的原核表达及该蛋白特异性多克隆抗体制备的报道。 FAdV-4型毒株基因全序列为2814 bp,编码937个氨基酸,包括四个高变环loop1、loop2、loop3和loop4和两个非常保守的基座区P1和P2。根据多种血清型腺病毒Hexon蛋白的序列发现,塔底区多数是非常保守的,可变区也大多是位于loop1和loop2,因此这两个区域是参与免疫反应的主要抗原决定簇[13-15]。根据软件预测免疫原性较好的一段蛋白位于loop1和loop2内,分子质量大小约为43 kDa。从SDS-PAGE检测结果可知,该蛋白能在大肠杆菌内表达,经IPTG 37 ℃诱导表达3 h主要以包涵体的形式存在,为后续大量制备亚单位疫苗和建立ELISA血清学检测提供了材料。
间接免疫荧光结果显示,该多克隆抗体能与FAdV-4产生特异性荧光,与FAdV-8b和FAdV-11无特异性结合,具有良好的型特异性。调查发现,中国目前流行的腺病毒主要为FAdV-4,因此制备的多克隆抗体能够有效监测FAdV-4的流行状况,并且可用于FAdV-4临床病例诊断及野毒的分离鉴定[16]。免疫组织化学显示,针对Hexon蛋白的多克隆抗体可以与FAdV-4发生反应,且特异性良好,可用于病毒定位与含量检测,为该病致病机制的研究提供了技术手段。Western blot的方法进一步鉴定了该多克隆抗体的特异性,且敏感性好,为后续研究病毒与宿主蛋白相互作用提供了物质基础。
针对Hexon蛋白的多克隆抗体能够有效地检测FAdV-4,且抗体效价及特异性较高,制备简单、成本低廉,为该病的诊断、致病机制研究及亚单位疫苗的研制提供了技术保障。
[1] Hess M. Detection and differentiation of avian adenoviruses: a review[J]. Avian Pathology, 2000,29(3):195-206
[2] Reece RL, Barr DA, Grix DC,Observations on naturally occurring inclusion body hepatitis in Victorian chickens[J]. Australian Veterinary Journal, 1986,63(6):201-202
[3] Anjum AD, Sabri MA, Iqbal Z. Hydropericarditis syndrome in broiler chickens in Pakistan [J]. Veterinary Record, 1989,124(10):247-248
[4] Gowda SRN, Satyanarayana ML. Hydropericardium syndrome in poultry[J]. Indian Journal Veterinary Pathology, 1994,18:159-161
[5] Balamurugan V, Kataria JM. The Hydropericardium Syndrome in Poultry – A Current Scenario[J]. Veterinary Research Communications, 2004,28(2):127-148
[6] Roy P, Vairamuthu S, Sakthivelan SM,. Hydropericardium syndrome in Japanese Quails (japonica )[J]. Veterinary Research, 2004,155(9):273-274
[7] Kim JN, Byun SH, Min JK,. Outbreaks of hydropericardium syndrome and molecular characterization of Korean fowl adenoviral isolates[J]. Avian Diseases, 2008,52(3):526-530
[8] Boyle DB, Mcferran JB. Avian adenoviruses isolated from poultry in Queensland[J]. Australian Veterinary Journal, 1976,52(12):587-589
[9] 朱广柱,林钧安.鸡包涵体肝炎病理形态学观察[J].中国兽医杂志,1987,12(13):15-17
[10] 刁有祥,李久芹.鸡包涵体肝炎的诊断[J].中国畜禽传染病,1996,1(3):40-41
[11] 郝先谱,林曦.包涵体肝炎的病理学研究[J].中国兽医科技,1993,23(5):5-7
[12] Niu YJ, Sun W, Zhang GH,. Hydropericardium syndrome outbreak caused by fowl adenovirus serotype 4 in China in 2015[J]. Journal of General Virology, 2016,97(10):2684-2690
[11] Norby E. The relationship between the soluble antigens and the virion of adenovirus type 3. IV. Immunological complexity of soluble antigens[J]. Virology, 1969,37(4):565-576
[12] Norby E, Wadell G. Immunological relationships between hexon of certain human adenoviruses[J]. Journal Virology, 1969,4(5):663-670
[13] Toogood CIA, Murali R, Burnett RM,. The adenovirus type 40 hexon: sequence, predicted structure and relationship to other adenovirus hexons[J]. Journal of General Virology, 1989,70(12):3203-3214
[14] Russell WC. Adenoviruses: update on structure and function[J]. Journal of General Virology, 2009,90(1):1-20
[15] Toogood CI, Crompton J, Hay RT. Antipeptide antisera define neutralizing epitopes on the adenovirus hexon[J]. Journal of General Virology, 1992,73(6):1429-1435
[16] Li C, Li H, Wang D,. Characterization of fowl adenoviruses isolated between 2007 and 2014 in China[J]. Veterinary Microbiology, 2016,197:62-67
Preparation and Specificity Identification of Polyclonal Antibodies Against Fowl Adenovirus Hexon Protein
NIU Yu-juan1,2,3, SUN Qin-qin1,2,3*, ZHAO Jun1,2,3, SUN Wei4, ZHANG Hui-xia1,2,3, ZHANG Gui-hua1,2,3, XIAO Yi-hong1,2,3, SHANG Ying-li1,2,3, LIU Si-dang1,2,3**
1.271000,2.271000,3.271000,4.265603,
The purpose of this study is to prepare polyclonal antibodies against fowl adenovirus (FAdV) Hexon protein and to identify its specificity. The recombinant prokaryotic expression plasmid pET-28a-Hexon was constructed and transformed intoBL21 (DE3), IPTG induction, the recombinant protein was identified by SDS-PAGE, and the protein was purified. The polyclonal antibodies of Hexon protein was prepared by routine immunity in New Zealand white rabbits with purified fusion protein. The specificity of polyclonal antibodies was identified by indirect immunofluorescence, immunohistochemistry and Western blot. The results showed the prokaryotic expression of Hexon protein was high and existed in the form of inclusion body, and its molecular weight was about 43 kDa; Polyclonal antibodies having specific reaction with FAdV and high potency could be obtained in the immunized rabbits. The above results indicated the polyclonal antibody of FAdV Hexon protein prepared in this study proved to be of good specificity and provided a good material basis for the diagnosis, pathogenesis study and subunit vaccine development of avian adenovirus diseases.
Fowl adenovirus;gene; polyclonal antibody; specificity
S858;S852.4+3
A
1000-2324(2018)06-0928-05
10.3969/j.issn.1000-2324.2018.06.005
2017-10-27
2017-12-06
山东省“双一流”奖补资金(2017)
牛玉娟(1989-),女,博士在读,研究方向:专业基础病理学. E-mail:15215384671@163.com
*同等贡献:孙芹芹(1991-),女,硕士在读,研究方向:专业动物临床病理学. E-mail:18763809792@163.com
Author for correspondence. E-mail:liusid@sdau.edu.cn

