不同pH条件下病毒理化性质分析
李天宇,林山杉,孙 欣,张业文
(1.东北师范大学环境学院,吉林 长春 130117;2.东北师范大学政法学院,吉林 长春 130117)
细菌和病毒等微生物广泛存在于污水污泥、化粪池、废水等污染源[1].在过去的几十年间,地下水资源的病毒污染问题已引起各国科学家的高度关注,并进行了较多的研究工作.广泛存在于污水污泥、化粪池、废水等污染源的致病细菌和病毒等微生物体积小,在通过多孔介质时不容易被过滤、净化[2-4],因此,对于地下水资源的病毒污染如果处理不当,污染物会通过地表和土壤等途径迁移,污染其他土壤、地表水和地下水系统[5-7].
随着分子生物技术的快速发展以及社会关注的提高,对病毒在不同水化学条件下的研究已逐渐成为环境修复工程、土壤学和水资源保护等方面的重要研究内容[8].
目前,有关胶体的研究已经取得了巨大进展,胶体悬浮液特征随自身水化学条件变化而变化的理论研究和实验研究均较为成熟[9-10]. 然而,病毒颗粒是一种具有“生物活性”的胶体,其环境行为特征与其他非生物胶体既有相似特征、又有不同之处[11].
近年来,随着生物大分子技术的快速发展以及水环境病毒污染越来越严重,大量国内外学者开始研究病毒在水环境中的存在形式与迁移转化规律[12-13].通过研究病毒在自然水环境中的迁移规律[14]、吸附-解吸规律[15]、自然衰减规律[16],预测病毒在自然水环境中的存在形式与迁移转化过程.本文通过改变溶液pH条件,探究了病毒在多孔介质溶液中的稳定性变化.
1 研究方法
1.1 实验材料
1.2 实验步骤

图1 实验装置
将处理好的玻璃珠填入玻璃柱,按图1完成连接,以0.772 mL/min的流量通入去离子水,玻璃柱由下向上饱水,连续通水8 h;再将配置好的pH及离子强度的病毒溶液通入实验装置中,并在通入溶液8 h后取样;通入去离子水,冲出实验装置中残余的病毒颗粒;对样品进行溶液病毒颗粒粒径及Zeta电势检测;按设计重新配置病毒溶液,重复上述实验.
2 实验结果与分析
2.1 不同水化学条件下病毒粒径变化
实验设计了3组不同pH的实验条件,pH值分别为5.0,7.0,9.0,分别代表偏酸性、偏中性、偏碱性水化学条件.病毒溶液由原病毒溶液、去离子水、0.1 mol/L NaOH溶液、0.1 mol/L HNO3溶液混合配置,溶液离子强度小于0.002 mmol/kg.
通过马尔文粒度仪测定不同pH条件下病毒粒径的分布,结果见图2.不同条件下病毒溶液中病毒颗粒平均粒径、粒径总体分布范围、粒径占比测定结果见表1.

图2 不同pH条件下病毒粒径分布图

pHI/(mmol/kg)主区间粒径/nm次区间粒径/nm主区间粒径占比/%次区间粒径占比/%5.0<0.002958.9010007.0<0.002271.95 37895.34.79.0<0.002217.401000
由表1可见,不同水化学条件下病毒粒径及其分布特征不同,随着pH值增大病毒粒径减小,酸性水化学条件(pH=5.0)对病毒粒径影响最大,此时病毒粒径远大于中性(pH=7.0)和碱性(pH=9.0)条件下的粒径;中性与碱性水化学条件下病毒粒径大小相近.
中性水化学条件下,病毒粒径分布存在两个区间,其中主区间粒径约为271.9 nm,占病毒颗粒的95.3%;另一区间粒径约为5 378.0 nm,约占4.7%,这部分病毒颗粒粒径过大,远大于胶体粒径范围,会产生沉淀.
2.2 不同水化学条件下Zeta电势
对不同水化学条件下所采集实验样品用马尔文粒度仪进行Zeta电势检测,结果见表2.

表2 不同水化学条件下病毒溶液中病毒颗粒Zeta电势 mV
对表格2数据进行四分卫数计算,再由计算数据做出不同水化学条件下病毒颗粒Zeta电势箱形图,结果见图3.
进行实验设计是开展科学探究的重要组成部分,实验设计是围绕所提出的问题进行实验方案设计的思维过程,有助于培养学生的探究能力和科学思维,促进其学科核心素养的养成。实验设计的关键在于变量的确定及控制。在生物学教学中,学生常因为不能正确地分析变量,所以难以设计出比较完整的实验方案,进而影响其实验设计能力的发展。因此加强变量分析教学,帮助学生掌握实验设计的各种变量及其控制方法,是提高学生实验设计能力发展的有效途径。

图3 不同水化学条件下病毒颗粒Zeta电势箱形图
由表2和图3可见,病毒颗粒Zeta电势随水化学条件改变而改变,随着pH值增大而增大.随着病毒颗粒Zeta电势的增大,病毒颗粒与颗粒之间静电斥力(双电层势能)明显增大,这将减少病毒颗粒发生碰撞并产生凝结或凝聚作用的概率.
2.3 不同水化学条件下病毒颗粒间DLVO稳定性分析
不同水化学条件下病毒理化性质不同,水化学条件的改变会导致病毒颗粒粒径、Zeta电势等理化性质的改变,使得病毒溶液中病毒颗粒之间的引力势能(范德华力)和斥力势能(双电层势能)发生改变,进而影响颗粒间总势能.溶液中病毒颗粒运动状态发生改变,病毒溶液稳定性随之相应变化,造成病毒颗粒聚集以及沉淀现象的发生.
计算分析病毒溶液中病毒颗粒间的引力势能与斥力势能,得出总势能,进而分析病毒溶液的稳定性,所需参数见表3.
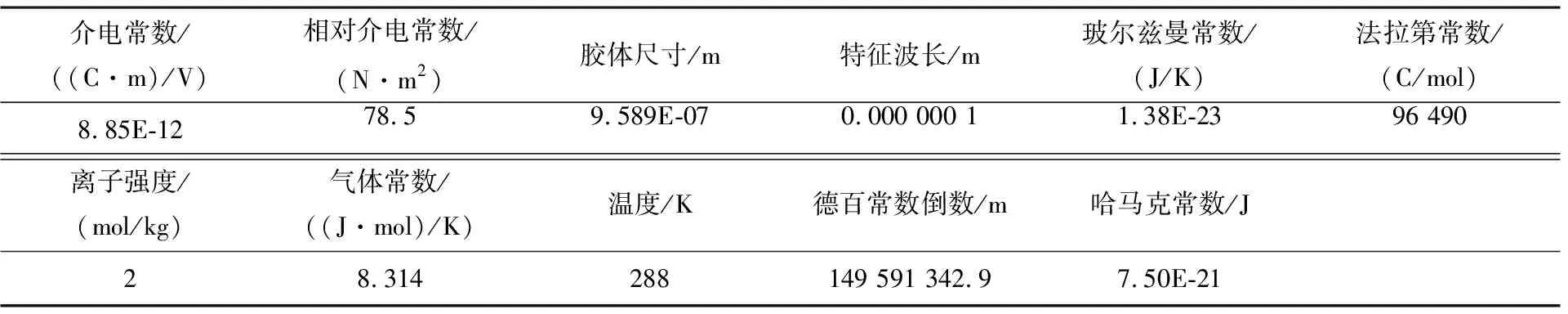
表3 病毒DLVO计算Excel数据参数表
对不同水化学条件下所采集实验样品用马尔文粒度仪进行Zeta电势检测并检测样品溶液中病毒胶体的粒径及其分布,得到不同水化学条件下病毒胶体溶液中粒径大小和分布特征.
将表1中的病毒颗粒粒径与表2中的Zeta电势数据带入表3,通过有关公式计算得出不同pH条件下病毒颗粒总势能图(见图4).

图4 不同pH条件下病毒颗粒间总势能图
由图4可见,在3种pH水化学条件下,当两病毒颗粒距离超过20 nm时,颗粒间引力势能(范德华力)与斥力势能静电斥力基本为零,病毒颗粒间基本保持稳定.由于pH=9时病毒颗粒的电势较低(-7.84 mV),当距离逐渐缩小时,颗粒间斥力势能以较快的趋势不断增大,增大速度远大于pH=5.0(电势为-3.76 mV)和pH=7.0(电势为-7.84 mV)时;由于范德华力一般与分子间距离成指数型反比关系,所以当分子间距离减小时,引力势能以越来越快的趋势增长,pH=9时引力势能增长速率要小于pH=5.0时,与pH=7.0时接近.
当病毒颗粒间距较大时(>20 nm)病毒总势能接近于0,颗粒间基本保持稳定;随颗粒间距的减小,病毒颗粒间总势能先增大再减小到0;随着病毒间距继续减小,总势能向引力势能方向快速增大.pH=5时总势能曲线上不存在势垒,病毒颗粒很容易发生碰撞,进而聚集或沉聚;pH=7时,总势能曲线上存在一个较小的势垒,约为5 kT;pH=9时,总势能曲线上存在一个较大的势垒,约为60 kT,若病毒颗粒总动能能越过势垒,病毒颗粒会产生聚集现象.
综上所述,在pH=9.0的水化学条件下,病毒颗粒之间斥力势能占优势,有较大的势垒,病毒溶液中病毒颗粒间基本保持稳定,其稳定性远大于pH=5.0与pH=7.0时.病毒颗粒间稳定性受pH值变化影响,随pH值增大病毒溶液中病毒颗粒间稳定性不断增强.pH=5.0时的病毒颗粒间不稳定;pH=7.0时病毒颗粒较稳定;pH=9.0时病毒颗粒间稳定性更强.
pH变化对病毒间斥力势能(双电层势能)影响较大,随pH值增大病毒颗粒间斥力势能快速增大;pH变化对引力势能影响较小.随pH值增大,溶液中质子浓度不断减小,影响病毒粒表面电荷分布与双电层性质,进而使病毒颗粒电势增大,影响病毒颗粒间斥力势能.
2.4 不同pH条件下病毒颗粒与玻璃介质间DLVO稳定性分析
根据表3计算得出相应水化学条件下病毒颗粒间引力势能与斥力势能,并做出DLVO总势能图(见图5).
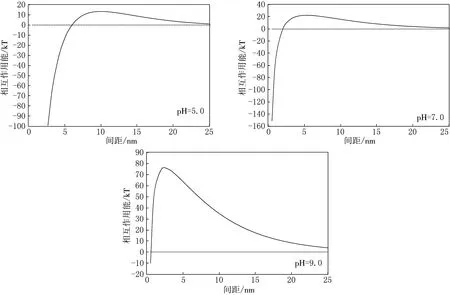
图5 不同水化学条件下病毒颗粒与玻璃介质间总势能图
由图5可见,当病毒颗粒与玻璃介质间距较大时(>20 nm),总势能接近于零,病毒颗粒与玻璃介质间基本保持稳定;随着病毒颗粒与玻璃介质间距减小,病毒颗粒与玻璃介质总势能先非常缓慢地增大再减小到0,再向引力势能方向快速增大,若病毒颗粒总动能越过势垒,病毒颗粒会吸附到玻璃介质上.
在pH=5.0的水化学条件下,总势能曲线上存在一个很小的势垒,几乎为0.病毒颗粒与玻璃介质间稳定性较差,很容易发生吸附反应.在pH=7.0的水化学条件下,总势能曲线上存在一个较小的势垒,约为20 kT,病毒颗粒动能大于势垒数值,发生吸附反应.在pH=9.0的水化学条件下,总势能曲线上存在一个较大的势垒,约为76 kT.若病毒颗粒总动能越过势垒,病毒颗粒会吸附到玻璃介质上.
当pH=9时总势能曲线上存在一个较大的势垒,远大于pH=5.0和pH=7.0时,病毒颗粒与玻璃介质间稳定性较pH=5.0和pH=7.0时强很多,发生吸附反应的概率较小.
综上所述,病毒颗粒与玻璃介质间稳定性受pH值变化影响,病毒颗粒与玻璃介质间DLVO总势能势垒随pH值增大而增大,病毒溶液中病毒颗粒与玻璃介质间稳定性不断增强.
pH值的变化对病毒颗粒与玻璃介质间斥力势能的影响较大,随着pH值增大病毒颗粒间斥力势能增大;pH值的变化对病毒颗粒与玻璃介质间引力势能影响较小.随着pH值的增大,溶液中质子浓度不断减小,影响病毒粒表面电荷分布与双电层的性质,进而使病毒颗粒电势增大,影响病毒颗粒与玻璃介质间斥力势能.
2.5 不同水化学条件下病毒溶液稳定性分析
不同水化学条件下,病毒颗粒的粒径与电势不同,水化学条件影响病毒颗粒表面电荷分布与双电层性质,使病毒颗粒间、病毒颗粒与玻璃介质间引力势能与斥力势能发生变化.
不同水化学条件下病毒颗粒间、病毒颗粒与玻璃介质间总势能图趋势基本一致,水化学条件主要影响总势能曲线上势垒的大小,势垒数值越大,病毒颗粒间、病毒颗粒与玻璃介质间稳定性越强.不同水化学条件下病毒颗粒间、病毒颗粒与玻璃介质间势垒数据见表6.
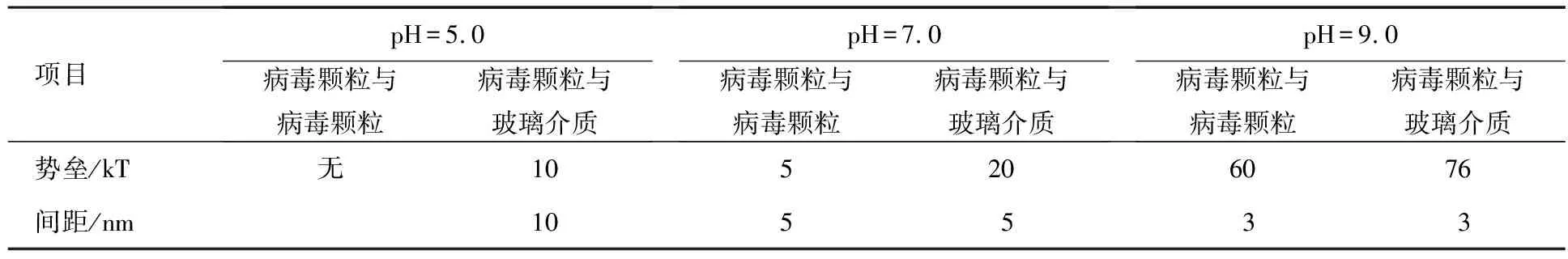
表4 不同水化学条件下病毒颗粒DLVO势垒
由表4可知:
相同pH水化学条件下,病毒颗粒间势垒比病毒颗粒与玻璃介质间势垒小,病毒颗粒与玻璃介质间的吸附作用所需能量大于病毒颗粒间的聚集,表明病毒溶液中病毒颗粒相比于吸附玻璃介质更倾向于病毒颗粒间的聚集.
不同水化学条件下,随pH值的增大,病毒颗粒间势垒、病毒颗粒与玻璃介质间势垒不断增大,病毒溶液中病毒颗粒与玻璃介质间的吸附作用以及病毒颗粒间的聚集作用发生所需能量更高,发生概率更小,溶液稳定性更高.
不同水化学条件下病毒颗粒间、病毒颗粒与玻璃介质间总势能图趋势基本一致,不同水化学条件主要影响总势能曲线上势垒的大小,势垒越大,病毒颗粒间、病毒颗粒与玻璃介质间稳定性越强.
3 结 论
本文研究了不同水化学条件下病毒理化性质的变化情况,进而通过DLVO理论计算了病毒溶液中病毒颗粒间以及病毒颗粒与玻璃介质之间引力势能(范德华力)与斥力势能(双电层势能)的变化情况,得出了病毒溶液稳定性与水化学条件的关系.结论如下:
(1) 不同水化学条件下,病毒粒径及其分布特征不同,随pH值增大病毒粒径减小,一致性增强;酸性水化学条件(pH=5.0)对病毒粒径影响最大,此时病毒粒径远大于中性(pH=7.0)和碱性(pH=9.0)水化学条件下的病毒粒径;中性与碱性水化学条件下病毒粒径相似.
(2) 病毒颗粒Zeta电势随水化学条件改变而改变,随着pH值增大而增大.随着病毒颗粒Zeta电势的增大,病毒颗粒与颗粒之间静电斥力(双电层势能)明显增大,这将减少病毒颗粒发生碰撞并产生凝结或凝聚作用的概率.
(3) 相同pH条件下,病毒颗粒间的势垒比病毒颗粒与玻璃介质间的势垒小,病毒颗粒与玻璃介质间的吸附作用所需能量大于病毒颗粒间的聚集能量,表明病毒溶液中病毒颗粒更倾向于颗粒间的聚集.
(4) 不同水化学条件下,随着pH值的增大,病毒颗粒间势垒、病毒颗粒与玻璃介质间势垒不断增大,病毒溶液中病毒颗粒与玻璃介质间的吸附作用以及病毒颗粒间的聚集作用发生概率更小,溶液稳定性更高.
——《势能》

