鲍鱼肽的制备及其抑制人乳腺癌MDA-MB-231细胞增殖作用
陈申如,魏配晓,叶燕军,陈 俊,2,翁武银,2,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.厦门市海洋功能食品重点实验室,福建 厦门 361021)
福建鲍鱼资源丰富,养殖产量约占全国鲍鱼总产量的80%[1]。伴随着消费者饮食观念的改变和市场的需求,干鲍、冷冻蒸煮鲍和罐头鲍等鲍鱼加工产品逐渐增加。在鲍鱼加工过程中,必然会产生约占鲍鱼质量25%的内脏。鲍鱼以摄食海藻和浮游生物为生,内脏富含蛋白、多糖、脂质、微量元素和各种活性代谢物。因此,近年来有关鲍鱼内脏活性成分的研究逐渐受到关注。鲍鱼内脏不仅含有丰富的牛磺酸[2],而且鲍鱼内脏酶解物及其膜分离组分、鲍鱼内脏多糖均具有良好的抗氧化活性[3-5]。具有抗氧化活性的寡肽能明显抑制乳腺癌细胞和胃癌细胞的增殖[6-7]。有研究报道,鲍鱼内脏蛋白多糖可能通过增强荷瘤小鼠的免疫功能抑制H22肝癌,鲍鱼内脏蛋白肽在一定程度上能抑制肝癌细胞的生长增殖[8-9]。然而,有关利用鲍鱼内脏提取蛋白肽对乳腺癌细胞增殖作用的影响却鲜见报道。
乳腺癌是全球女性最常见恶性肿瘤之一,近年来随着环境、生活方式的改变及人口老龄化加剧,我国女性人群乳腺癌患病率也呈上升趋势[10]。然而,越来越多的研究资料表明,从食品加工副产物中提取的营养物质也可抑制乳腺癌细胞的生长[11-13]。因此,本实验以鲍鱼内脏为原料,通过蛋白酶解、膜分离技术制备蛋白肽,并以不同质量浓度鲍鱼肽处理人乳腺癌MDAMB-231细胞,考察细胞的增殖抑制、诱导凋亡效应和作用机制,为利用鲍鱼内脏制备蛋白肽、开发辅助抗肿瘤功能性食品提供依据。
1 材料与方法
1.1 材料与试剂
鲍鱼内脏由厦门市岛之原生物科技有限公司提供。
人乳腺癌细胞(MDA-MB-231细胞) 中国科学院昆明细胞库;高糖培养基(Dulbecco’s modified Eagle medium,DMEM)、胎牛血清(fetal bovine serum,FBS) 美国Gibco公司;双抗(青霉素/链霉素)、胰酶(质量分数0.25%) 美国Corning公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)细胞增殖检测试剂盒 北京索莱宝科技有限公司;Calcein-AM细胞活性分析试剂盒 南京建成生物工程有限公司;细胞周期检测试剂盒、细胞凋亡检测试剂盒 上海碧云天生物技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)美国MP生物科技有限公司;台盼蓝(质量分数0.4%)美国Sigma公司。
1.2 仪器与设备
UV-8000A型紫外分光光度计 上海元析仪器有限公司;1200高效液相色谱仪 美国Agilent公司;Forma 702二氧化碳培养箱 美国Thermo公司;EVOS型倒置显微镜 美国AMG公司;Cytoflex流式细胞仪 中国贝克曼库尔特商贸有限公司;Series II Water Jaket酶联免疫检测仪 美国BMG公司。
1.3 方法
1.3.1 鲍鱼肽的制备
在鲍鱼内脏中,按照料液比为1∶5加入蒸馏水,捣碎,加入鲍鱼内脏质量2‰的胰酶,用质量分数1% NaOH溶液调整pH值至8.0,50 ℃条件下酶解6 h,然后用体积分数1% HCl溶液将酶解液的pH值调整至5.5,加入鲍鱼内脏质量1‰的木瓜蛋白酶,在50 ℃条件下继续酶解12 h。酶解液利用100 ℃灭酶10 min,将离心(8 000 r/min,10 min)获得的上清液利用截留分子质量为1 000 Da超滤膜进行超滤,获得的滤液再利用200 Da纳滤膜进行脱盐浓缩,获得200~1 000 Da的滤液组分通过冷冻干燥制备成鲍鱼肽,备用。
1.3.2 鲍鱼肽基本组分的测定
蛋白质质量分数采用GB/T 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》的凯氏定氮法进行测定,蛋白质的换算系数为6.25;碳水化合物质量分数采用GB/T 15672—2009《食用菌中总糖含量的测定》的苯酚-硫酸法进行测定;灰分质量分数的测定采用GB/T 5009.4—2016《食品安全国家标准 食品中灰分的测定》的高温灼烧法进行测定;水分质量分数采用GB/T 5009.3—2010《食品安全国家标准 食品中水分的测定》的直接干燥法进行测定。
1.3.3 鲍鱼肽分子质量分布的测定
蛋白肽的分子质量分布参考Weng Wuyin等[14]报道的方法进行测定,利用凝胶渗透色谱进行测定。色谱柱为TSKgel G2000 SWxL(300 mm×7.8 mm,5 μm),流动相为乙腈-水-三氟乙酸(体积比45∶55∶0.1),在柱温30 ℃、流速0.5 mL/min的条件下,以检测波长为214 nm对样品进行测定。
1.3.4 细胞培养
参考文献[13]的方法,将MDA-MB-231细胞在含质量分数10% FBS和质量分数1%双抗的DMEM培养液中,于37 ℃、5% CO2饱和湿度培养箱中培养,每隔2~3 d换培养液一次,待细胞融合率达90%时,用质量分数0.25%胰蛋白酶消化,并进行传代培养,取对数期生长状态良好的细胞供以下实验使用。
1.3.5 细胞存活率测定
细胞存活率参考Oh等[15]报道的方法进行测定。MDA-MB-231细胞以5×104个/孔接种于96 孔板中,放在37 ℃、5% CO2的条件下培养24 h后,吸弃上清液并加入含不同质量浓度鲍鱼肽的培养液继续培养48 h。培养结束后,吸弃培养液,加入100 μL MTT(0.5 mg/mL)染色,于37 ℃下继续培养4 h,然后移去培养液,加入110 μL DMSO溶解蓝紫色结晶,用酶联免疫检测仪于490 nm波长处测各孔的吸光度,按照下式计算细胞存活率。

1.3.6 Calcein-AM染色
Calcein-AM染色参照Haorah等[16]报道的方法进行测定。按1.3.4节的实验方法,细胞经过含不同质量浓度鲍鱼肽的培养液培养后,吸弃培养液,每孔加入100 μL Calcein-AM溶液(2 μmol//L),避光室温反应20 min后,置于荧光显微镜下观察活细胞情况。
1.3.7 细胞凋亡检测
按照试剂盒操作说明书,以Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)双染色法对细胞凋亡进行检测。按1.3.4节方法,细胞经过含不同质量浓度鲍鱼肽的培养液培养后,吸弃培养液,每孔分别加入100 μL含质量分数1% AnnexinV-FITC和质量分数1% PI溶液的工作液,避光室温反应10 min后,用流式细胞仪测定细胞凋亡情况。
1.3.8 细胞周期检测
按照试剂盒操作说明,以PI单染法对细胞周期进行检测。按1.3.4节的实验方法,细胞经过含不同质量浓度鲍鱼肽的培养液培养后,用胰酶消化,磷酸盐缓冲液洗涤,离心(1 000 r/min、5 min)收集细胞,加入预冷的无水乙醇进行固定,-20 ℃过夜,再通过离心(1 000 r/min、5 min)并用磷酸盐缓冲液洗去乙醇后,加入核糖核酸酶A和PI染色液,在37 ℃下避光水浴30 min后进行流式细胞检测,并用软件对细胞周期进行分析。
1.4 数据分析
数据采用SPSS 17.0统计软件进行单因素方差分析,差异显著(P<0.05)采用Duncan氏法进行多重比较检验。
2 结果与分析
2.1 鲍鱼肽的理化性质
鲍鱼内脏经蛋白酶解、超滤和纳滤制备成淡黄色的蛋白肽,其基本成分经检测为:蛋白质(71.62±1.23)%(质量分数,下同)、碳水化合物(3.38±0.04)%、灰分(11.48±2.38)%、水分(6.41±0.18)%。蛋白肽除了主要成分蛋白以外,还含有少量碳水化合物,表明鲍鱼内脏中的蛋白经胰酶和木瓜蛋白酶酶解后形成的小肽能透过1 000 Da超滤膜,而多糖几乎都被超滤膜截留。通常,纳滤处理不仅具有浓缩效果,还可起到良好的脱盐效果。周凤娟等[17]利用纳滤设备进行丝素蛋白酶解液进行脱盐,结果发现干燥后的丝素肽中灰分质量分数为2.34%。然而,在本研究中鲍鱼内脏酶解液虽然经过纳滤膜处理,但是在获得鲍鱼肽中灰分质量分数却高达11.48%,表明鲍鱼肽对矿物质元素具有良好的螯合能力。
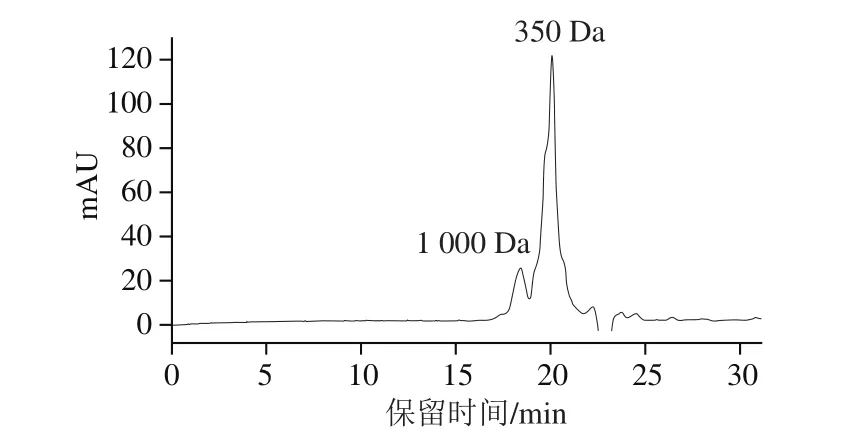
图1 鲍鱼肽的分子质量分布Fig.1 Molecular mass distribution of peptides derived from abalone viscera
分子质量检测的结果显示,鲍鱼肽中蛋白分子质量主要分布在350~1 000 Da范围内,丰度较高的蛋白肽分子质量分布在350 Da 附近(图1),表明获得的鲍鱼肽主要是由2~3 个氨基酸残基组成的小肽。据报道,寡肽尤其二肽或三肽容易穿越小肠黏膜被人体吸收利用[18-19]。因此,本研究制备的鲍鱼肽也可能有效地被人体吸收,从而发挥其生物活性功能。
2.2 鲍鱼肽对细胞存活率的影响
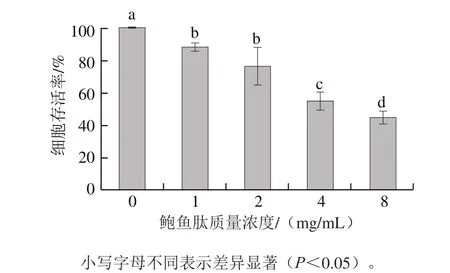
图2 鲍鱼肽对MDA-MB-231细胞存活率的影响Fig.2 Effect of peptides derived from abalone viscera on cell viability of MDA-MB-231 cells
从图2可以看出,随着培养液中鲍鱼肽质量浓度的增加,乳腺癌MDA-MB-231细胞的存活率呈下降趋势。当培养液中鲍鱼肽的质量浓度为8 mg/mL时,乳腺癌MDA-MB-231细胞存活率只有45%左右。这些结果表明,鲍鱼肽对乳腺癌细胞的增殖抑制作用显著(P<0.05),而且呈剂量依赖性。
2.3 细胞形态学观察
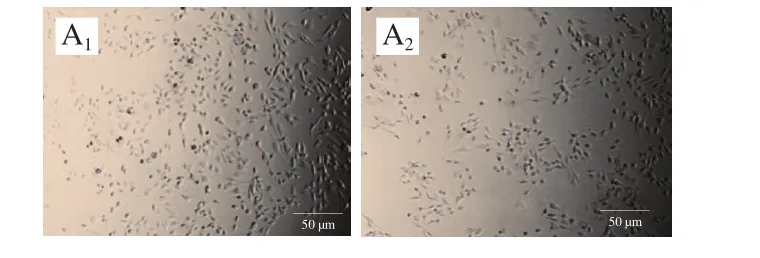
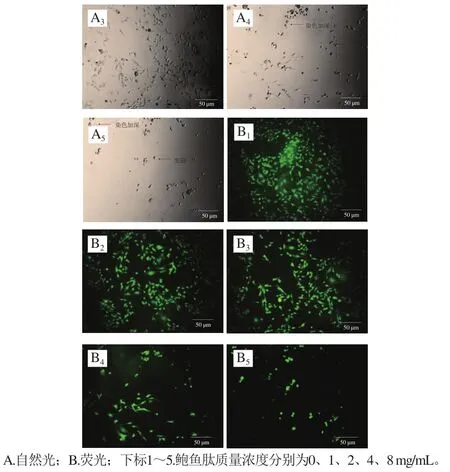
图3 MDA-MB-231细胞形态学观察Fig.3 Morphological change of MDA-MB-231 cells
如图3所示,在自然光条件下观察时,可以发现乳腺癌MDA-MB-231细胞在未添加鲍鱼肽的培养基中贴壁良好,呈梭形分布。伴随培养基中鲍鱼肽质量浓度的增加,贴壁细胞逐渐减少,且部分细胞出现染色加深(细胞核浓缩)、回缩变圆等现象。这与Mirakabadi等[20]报道的利用蛇蝎毒液提取的肽抑制MDA-MB-231细胞时的现象一致。另一方面,在荧光条件下观察到的鲍鱼肽质量浓度对MDA-MB-231活细胞形态的影响与自然光条件的趋势一致,只是在荧光条件下更清晰。不管是在自然光条件下还是在荧光条件下,当培养基中含有的鲍鱼肽质量浓度不小于4 mg/mL时,视野内活细胞的数目(图3)明显低于MTT法检测的数据(图2)。MTT法检测细胞存活率是利用活细胞线粒体中的琥珀酸脱氢酶还原MTT生成水不溶性的蓝紫色结晶甲瓒,在490 nm波长处检测溶解在二甲基亚砜中的甲瓒[21]。琥珀酸脱氢酶活性除了与活细胞数量有关外,还与外界干预后细胞的状态有关[22]。在细胞晚期凋亡和坏死情况下,线粒体的功能都受损,会导致MTT检测的吸光度偏低[23]。因此,鲍鱼肽对MDA-MB-231细胞增殖的实际抑制效果应该高于MTT法检测的结果。
2.4 鲍鱼肽对细胞凋亡的影响
在流式Annexin V-FITC/PI双参数中,I、III、II和IV象限分别代表机械损伤细胞、活细胞、晚期凋亡/坏死细胞和早期凋亡细胞[24]。由图4可以发现,对照组的MDA-MB-231细胞早期凋亡率和晚期凋亡率分别为1.96%和4.05%,而1、2、4、8 mg/mL鲍鱼肽处理48 h的MDA-MB-231细胞早期凋亡率分别为12.01%、21.43%、5.09%和1.96%;晚期凋亡率分别为14.74%、32.25%、48.33%和72.65%。这表明鲍鱼肽能诱导乳腺癌MDA-MB-231细胞凋亡和坏死,进而抑制肿瘤细胞增殖,并呈现出明显的质量浓度梯度依赖性。
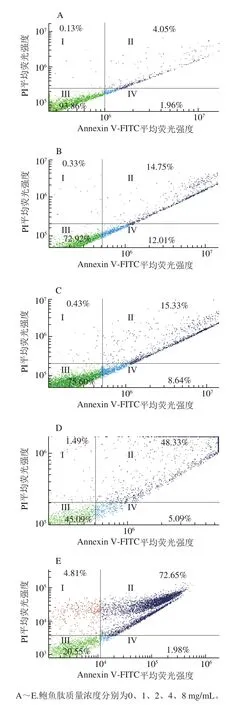
图4 流式细胞仪检测MDA-MB-231细胞凋亡率Fig.4 Apoptosis rates of MDA-MB-231 cells determined by flow cytometry
2.5 鲍鱼肽对细胞周期的影响
利用流式细胞仪对不同质量浓度鲍鱼肽处理的MDA-MB-231细胞的细胞周期分布进行检测。随着鲍鱼肽的质量浓度的增加,可以发现G1期细胞数减少,S期细胞数增加,G2期细胞数在鲍鱼肽质量浓度8 mg/mL条件下显著增加(图5),表明鲍鱼肽主要将MDA-MB-231细胞阻滞在S期,从而达到抑制乳腺癌细胞增殖的目的。通常,细胞从一次分裂完成到下一次分裂开始一般会经历细胞间期(G1期、S期和G2期)和分裂期。一旦细胞进入分裂期,细胞周期就会不可逆转地进行下去。有研究表明,小肽可以进入癌细胞,激活抗癌基因p53,进而诱导癌细胞的凋亡[25]。低分子质量的小肽,可以调动、增强机体的抗肿瘤机制,减弱、抑制促肿瘤生长机制,进而抑制肿瘤的生长繁殖[26]。而且,小肽中的阳离子会与癌细胞细胞膜的阴离子发生特异性的结合,从而使细胞发生裂解[27]。因此,MDA-MB-231细胞周期被阻滞在S期说明细胞DNA合成受抑制或DNA损伤无法得到修复,结果导致细胞无法进行分裂增殖(图2)。
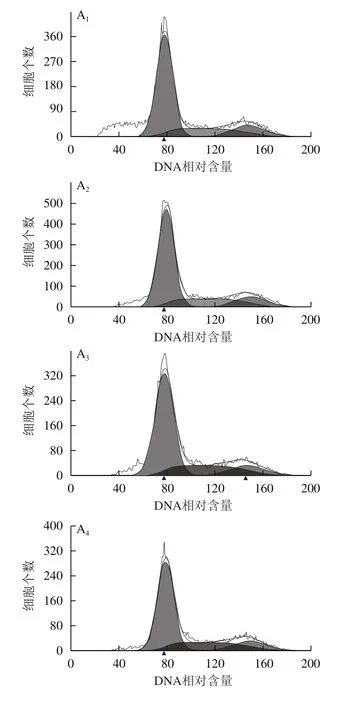
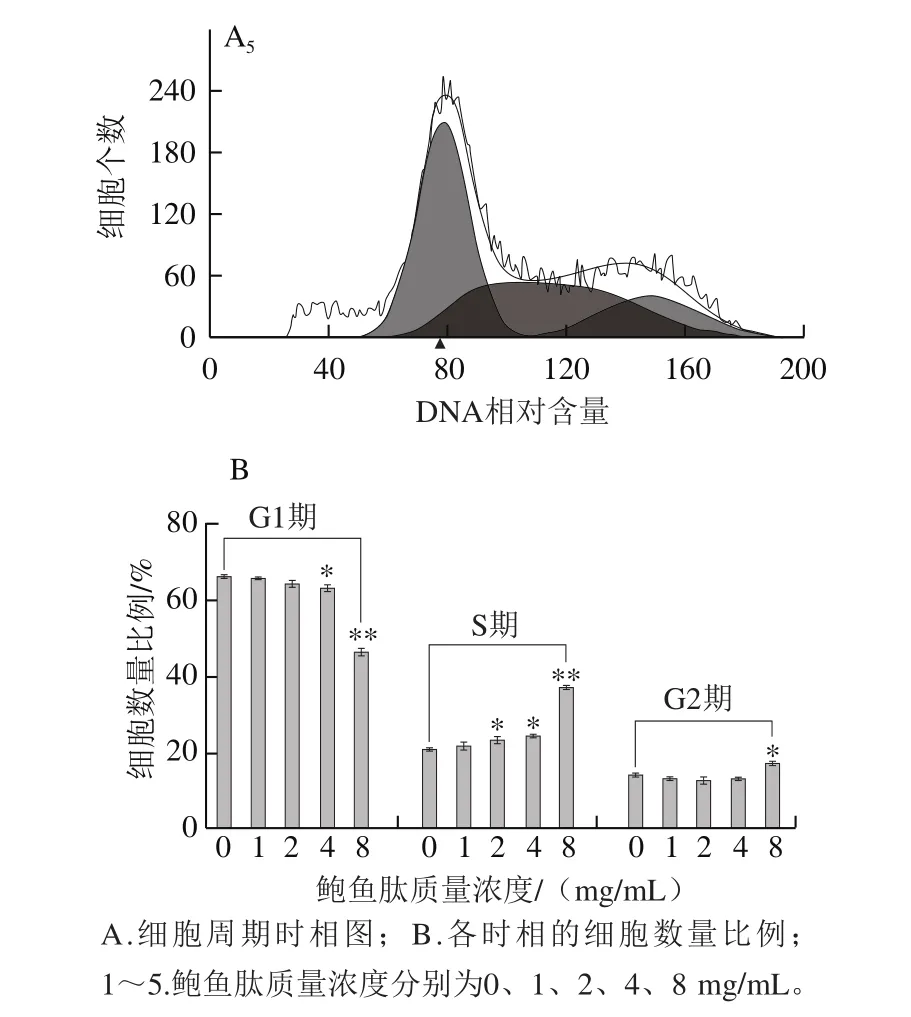
图5 鲍鱼肽对乳腺癌细胞MDA-MB-231细胞周期的影响Fig.5 Effect of peptides derived from abalone viscera on cell cycle in MDA-MB-231 cells
近年来,鲍鱼内脏的综合利用和活性物质提取的研究,日益引起各国学者的关注。有研究表明,鲍鱼内脏酶接物中苯丙氨酸、酪氨酸和天冬氨酸等具有抗氧化活性的氨基酸质量分数可以高达57.1%,它们可以通过清除细胞内的自由基保护肝细胞免受氧化应激[28]。鲍鱼内脏酶接物通过系列凝胶层析分离可以获得具有良好抗血管紧张素转化酶活性的三肽(Ala-Met-Asn)[29]。黑鲍内脏酶解物经过FPLC分离后可以获得具有抗血栓和抗凝血功能的活性物质[30]。然而,有关鲍鱼内脏制备的蛋白肽对乳腺癌细胞增殖抑制的研究却鲜见报道。因此,本研究的结果将为鲍鱼内脏的高值化利用拓展新的应用范围。
3 结 论
本研究利用鲍鱼内脏,通过酶解、超滤和纳滤制备成淡黄色的鲍鱼肽,结果发现制备的蛋白肽中还含有少量的碳水化合物和高含量的矿物质。以乳腺癌MDA-MB-231细胞为模型,研究了制备的鲍鱼肽的抗增殖活性和促细胞凋亡作用,结果表明鲍鱼肽对MDA-MB-231细胞增殖有显著的抑制作用,并呈现出剂量依赖效应。运用流式细胞术发现,鲍鱼肽能显著诱导乳腺癌MDA-MB-231细胞凋亡,而且细胞周期发生了变化,主要被阻滞在S期和G2期,进而抑制MDA-MB-231细胞的增殖。本研究的结果表明,鲍鱼内脏可以用于研发具有辅助抗肿瘤功能的蛋白肽产品。

