汽巴蓝F3GA染料亲和色谱介质的制备及其对黑芸豆凝集素的特异性吸附
赵金龙,李延红,孙汉巨,方 利,孙先保,唐明明,张 扬,武香玉,何述栋,*
(1.合肥工业大学食品与生物工程学院,安徽 合肥 230009;2.常州天地人和生物科技有限公司,江苏 常州 213000;3.河南省农业科学院经济作物研究所,河南 郑州 450002;4.山东省肥城市食品药品监督管理局,山东 肥城 271608)
凝集素是一类非免疫来源的、不具有酶催化活性的糖蛋白或糖结合蛋白,在一些豆科植物种子或豆科食物中含量较高[1-2],是一种公认的抗营养因子,可诱发病理性恶心、呕吐和腹泻等症状[3-4]。然而,凝集素在生物和医药领域具有重要的应用,如血型鉴定、抗病毒、抑制恶性癌细胞、免疫应答和药物靶向定位等[5]。目前,高纯度的凝集素蛋白样品需经过多步色谱纯化或者单步多次重复纯化获得。但是,随着色谱纯化步骤的增加,凝集素蛋白的得率及活性将显著降低[6-7]。因此,快速、经济、高效地分离纯化豆类凝集素,将显著提高豆类作物的经济利用价值。
亲和色谱是一种利用生物分子之间特异识别的原理(如酶与底物、抗体与抗原、凝集素与特异性结合的糖等)对生物大分子进行分离纯化的方法[8-9]。亲和色谱主要由固相载体及其偶联的配基组成,配基的性质和密度决定了亲和色谱的选择性和纯化效率[10-11]。现今关于采用亲和色谱对糖蛋白,尤其是凝集素蛋白的分离纯化应用研究报道较少,且亲和体系应用效果多不理想[12]。作为应用最广泛的一类配基,三嗪型染料汽巴蓝F3GA具有价格低廉、化学物理性能稳定、不易被生物降解[8,13]等特点,目前已成功应用于一些蛋白质和酶的分离纯化[14-15]。从分子结构看,汽巴蓝F3GA由三嗪环、多芳香环和离子磺酸基团3 个部分组成,和N-乙酰葡萄糖胺结构相似,都含有氨基、羰基及六元环。鉴于黑芸豆凝集素对N-乙酰葡萄糖胺具有特异性识别作用[5],推测汽巴蓝F3GA与凝集素之间可能存在一定的特异性亲和作用。因此,本实验采用偶联染料配体汽巴蓝F3GA的方法进行凝集素的分离纯化,这将具有极大的应用潜力和发展空间。
本实验以琼脂糖为原料,采用反相悬浮再生法制备琼脂糖微球,并对琼脂糖微球进行环氧氯丙烷的交联及配基汽巴蓝F3GA偶联。采用扫描电子显微镜、激光粒度分析仪、傅里叶变换红外光谱等方法对微球进行表征,并研究活性染料微球对黑芸豆凝集素的吸附性能。
1 材料与方法
1.1 材料与试剂
黑芸豆 安徽省合肥市宁国路农产品批发市场;黑芸豆凝集素(纯度≥95%)由哈尔滨工业大学化工与化学学院食品安全实验室馈赠[7,16]。0.45 μm混合纤维素脂微孔滤膜 上海半岛实业有限公司;吐温-80、司班80、琼脂糖与活性炭 上海阿拉丁试剂公司;汽巴蓝F3GA(分析纯) 加拿大Bio Basic公司;考马斯亮蓝R-250/G-250、4×上样缓冲溶液、蛋白Marker 北京索莱宝科技有限公司;盐酸、氢氧化钠等其他试剂均为国产分析纯;全部实验用水均为超纯水。
1.2 仪器与设备
96 孔U型板 江苏世泰实验器材有限公司;中药粉碎机 上海顶帅电器有限公司;CP114电子天平 美国奥豪斯国际贸易(上海)有限公司;DELTA 320 pH计瑞士梅特勒-托利多公司;RH basic 2磁力搅拌器德国艾卡(广州)仪器设备有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;DZKW-4电热恒温水浴锅 北京林茂科技有限公司;UV-4802双光束紫外-可见分光光度计 美国尤尼柯(上海)仪器有限公司;BJ-9300HJ激光粒度分析仪丹东百特仪器公司;JSM-6490LV型钨灯丝扫描电子显微镜 日本电子公司;67型傅里叶变换红外光谱仪美国Nicolet仪器公司;DYY-10C型电泳仪 北京六一生物科技有限公司;AKTApurifier 100蛋白纯化仪 美国GE公司;e2695型高效液相色谱(high performance liquid chromatography,HPLC)系统(配有UV-2489紫外检测器) 美国Waters公司。
1.3 方法
1.3.1 活性琼脂糖微球的制备
1.3.1.1 反相悬浮再生法制备琼脂糖微球
参照尹霜霜等[17]的方法制备琼脂糖(agarose)微球。首先取6.0 g琼脂糖和1.0 g NaCl置于100 mL超纯水中,加热溶解制得6 g/100 mL琼脂糖溶液。然后在500 mL三口圆底烧瓶中,加入150 g真空泵油和一定质量的乳化剂(30 g吐温-80、15 g司班80),70 ℃水浴搅拌30 min,转速为800 r/min。趁热加入琼脂糖溶液,继续搅拌30 min。整个过程均在70 ℃恒温水浴中进行。随后,低速搅拌(140~200 r/min),缓慢降至室温,再继续将温度降至15 ℃以下,冷凝成型,超纯水将琼脂糖微球洗涤干净,用标准筛网湿态筛选粒径为30~150 μm的琼脂糖微球;体积分数20%(下同)乙醇溶液封存,4 ℃冰箱储存备用。
1.3.1.2 琼脂糖微球的交联
在生物大分子分离纯化中,琼脂糖微球在不经过任何的化学修饰情况下,机械强度低,不适合直接偶联键合功能基团[18]。为最大程度提高琼脂糖微球的机械强度,本实验拟对琼脂糖微球进行两次交联,反应方程式如式(1)所示。具体操作为:准确称取2 mL的琼脂糖微球,与等体积的1 mol/L的NaOH溶液混合,加入100 μL 5 g/L的NaBH4,于25 ℃条件下反应4 h。反应结束后,过滤,加入蒸馏水反复洗涤,直到中性,然后将交联后的琼脂糖微球按照上述方法进行二次交联,再次过滤,加入蒸馏水反复洗涤至中性且滤液中无环氧基检出,完成两次交联,抽干,收集备用。
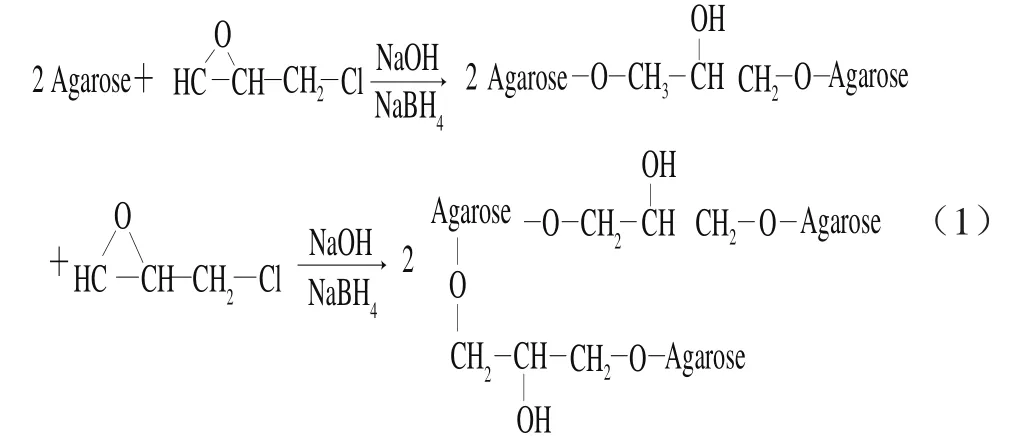
1.3.1.3 琼脂糖微球配基(汽巴蓝F3GA)的偶联
配基(汽巴蓝F3GA)的偶联过程如式(2)所示。称取1.3.1.2节制备好的高度交联的琼脂糖微球1.0 g于100 mL的三口烧瓶中,加入20 mL超纯水,待琼脂糖微球充分溶胀后,将三口烧瓶置入50 ℃的恒温水浴中。在磁力搅拌器不断搅拌下(300 r/min),将1.0 g活性染料汽巴蓝F3GA溶于15 mL超纯水中,充分溶解后加入到三口烧瓶中,反应60 min后,加入6 mL质量分数为20% NaCl溶液。随后,用2 mol/L的NaOH溶液调节溶液的pH值为9~10,反应时间为10 h。反应结束后,趁热抽滤,用超纯水洗涤至无色,然后依次用甲醇、2 mol/L NaCl、体积分数20%乙醇溶液、热水充分洗涤,得到以汽巴蓝F3GA为功能配基的染料介质Blue Beads 6FF,于体积分数20%的乙醇溶液中储存备用。收集所有的洗涤液,调至中性,定容,测溶液中活性染料配基汽巴蓝F3GA在620 nm波长处的吸光度。根据吸光度算出洗涤溶液中活性染料汽巴蓝F3GA的含量,并用其与染料加入量的差值计算出染料配基汽巴蓝F3GA的偶联量[19]。

1.3.2 活性Blue Beads 6FF微球的表征
采用扫描电子显微镜观察微球粒径及形貌。
采用傅里叶变换红外光谱仪测定活性微球Blue Beads 6FF的红外光谱,通过KBr压片,检测波数范围为4 000~400 cm-1。
参照Huang Yongdong等[20]的方法利用AKTApurifier 100蛋白纯化仪进行微球压力流速曲线的测定。
参照Zhang Lina等[21]的方法进行微球溶胀率、孔隙率及配基泄漏率的测定。
将制备好的活性微球Blue Beads 6FF用超纯水充分溶胀,用滤纸将表面水分吸净后,测湿质量为mw,然后放置于烘箱中60 ℃烘干至恒质量,测干质量为md。溶胀率的计算如公式(3)所示。
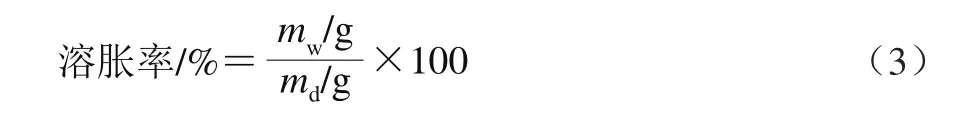
采用比重法测Blue Beads 6FF活性微球密度ρc/(g/mL),孔隙率Pr计算如式(4)所示。

式中:ρw为水的密度(1 g/mL);Q为吸水量,Q=(mw-md)/mw。
在配基泄漏率的测定过程中,移取0.2 mL活性微球Blue Beads 6FF于3 支4 mL离心管中,分别加入2 mL配制好的0.5 mol/L NaOH、0.5 mol/L HCl、10 mmol/L pH 7.2的磷酸盐缓冲液,25 ℃摇床振荡5 d,6 000 r/min离心20 min,取上清液在620 nm波长处测汽巴蓝F3GA的吸光度,并计算染料泄漏率[14]。
1.3.3 活性Blue Beads 6FF微球的吸附性能测定
1.3.3.1 微球对黑芸豆凝集素的吸附量
取平衡好的活性Blue Beads 6FF微球1 mL,置于7 个50 mL锥形瓶中,依次加入10 mL质量浓度分别为0、0.5、1.0、2.0、4.0、6.0、8.0 mg/mL的凝集素溶液(纯度≥95%)(pH 7.2,10 mmol/L磷酸盐缓冲液),在25 ℃下摇床振荡吸附24 h,取上清液,测定蛋白质量浓度,计算出活性微球的吸附量,并以Langmuir吸附等温式(式(5))进行吸附性能拟合[17]。

式中:q为吸附量/(mg/mL);qm为最大吸附量/(mg/mL);ρ为蛋白质量浓度/(mg/mL);Kd为蛋白解离常数/(mg/mL)。
1.3.3.2 吸附时间对黑芸豆凝集素吸附的影响
分别取平衡好的活性Blue Beads 6FF微球1 mL,置于8 个50 mL锥形瓶中,均加入10 mL质量浓度为2.0 mg/mL的黑芸豆凝集素溶液(pH 7.2、10 mmol/L磷酸盐缓冲液),在25 ℃下摇床振荡吸附,分别测定0.2、0.5、1.0、1.5、2.0、4.0、6.0 h和8.0 h上清液蛋白质量浓度,计算出活性微球在不同时间的吸附量。
1.3.3.3 蛋白质量浓度测定
采用考马斯亮蓝G-250法测定蛋白质量浓度,以牛血清白蛋白为标准,所得回归方程为:y=1.492 8A+0.039 6(R2=0.996 9)。
1.3.4 黑芸豆凝集素的亲和层析纯化
1.3.4.1 色谱柱的填装
称取制备好的150 mL活性Blue Beads 6FF微球,用500 mL匀浆液分散后加入匀浆罐中,采用高压泵封闭灌装;流速由零开始慢慢调高,利用流速调整压力,压力不宜超过30 MPa,装完之后用体积分数20%乙醇溶液封装,4 ℃环境中储存备用。
1.3.4.2 黑芸豆凝集素的浸提和粗分离
黑芸豆子叶经中药粉碎机粉碎,过80 目筛,称取20 g粉末于500 mL烧杯中,加入200 mL 10 mmol/L pH 7.2的磷酸盐缓冲溶液,磁力搅拌浸提12 h后高速离心(9 000 r/min、30 min)获得浸提液。然后调pH值至3.5,于4 ℃环境静置1 h后,高速离心(9 000 r/min、30 min),取上清液并采用50 kDa的超滤离心管超滤离心(4 000 r/min、20 min),然后将滤过液体重新调回pH值至7.2,再用50 kDa超滤离心管超滤(4 000 r/min、20 min),收集未滤过液体得到粗分离样品,4 ℃冰箱储存备用。
1.3.4.3 黑芸豆凝集素亲和层析纯化
将得到的黑芸豆凝集素粗品(30 mL、(9.56±0.52)mg/mL)上样于装好的Blue Beads 6FF柱中(柱体积150 mL),进行色谱纯化。平衡液与洗杂液均为10 mmol/L pH 7.2的磷酸盐缓冲液,洗脱液为10 mmol/L pH 7.2的磷酸盐缓冲液和0.25 mol/L的NaCl溶液,流速为2.5 mL/min,收集各洗杂峰与洗脱峰并进行凝血活性的检测。质量分数2%的兔血红细胞压积溶液为实验室自制,制备方法及凝血活性实验参照He Shudong等[7,16]的报道进行,根据式(6)~(8)计算黑芸豆凝集素的纯化倍数、蛋白得率及蛋白回收率。

1.3.4.4 高效液相凝胶排阻色谱分析
采用e2695系列HPLC系统进行高效液相凝胶排阻色谱(HPLC-gel permeation chromatography,HPLC-GPC)分析,计算凝集素蛋白含量。排阻色谱柱型号为TSKgel G3000SWxl(300 mm×7.8 mm),平衡缓冲液和洗脱缓冲液均为10 mmol/L、pH 7.2的磷酸盐缓冲液(含0.05%的叠氮化钠和0.1 mol/L的硫酸钠),流速为1.0 mL/min,进样量为10 μL,进样前样品过0.22 μm膜,检测波长为280 nm。
1.3.4.5 SDS-PAGE分析
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析采用Laemmli等[22]的方法,分离胶与浓缩胶的质量分数分别为12%与4%,取200 μL样品,按体积比1∶3加入4×上样缓冲液,漩涡振荡充分混匀后,沸水浴5 min,高速离心(10 000 r/min,10 min)取上清液进行上样,每孔上样量均为15 μL。电泳条件为起始电压80 V,溴酚蓝前沿到达分离胶后升至120 V。电泳结束后,用考马斯亮蓝R-250进行染色,脱色后,电泳结果采用1600全自动数码凝胶图像仪拍照进行分析。
1.4 数据分析
每次实验均重复3 次,利用SPSS 20.0软件对实验结果进行统计分析,数据以平均值±标准偏差表示,采用Origin 8.5软件进行作图。
2 结果与分析
2.1 活性Blue Beads 6FF微球的形貌
实验中制备的活性Blue Beads 6FF微球,为肉眼可见的细小蓝色颗粒,呈圆球状,无杂质。扫描电子显微镜观察表明,微球呈完整的球形,圆滑无破损,微球粒度分散比较均匀,呈单分散性,粒径在45~65 μm之间(图1);由图1c的单颗粒表征可知,活性微球表面具有许多细小的沟纹,无碎片附着。以上结果表明,反相悬浮再生法所制备的琼脂糖微球的球形度良好。

图1 活性Blue Beads 6FF微球的钨灯丝扫描电子显微镜图Fig.1 SEM images of Blue Beads 6FF microspheres
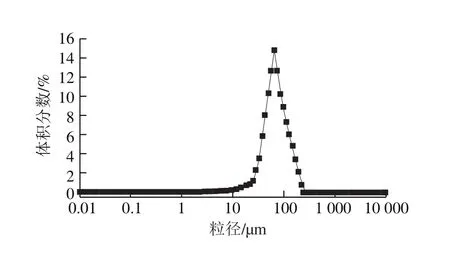
图2 Blue Beads 6FF的粒径分布Fig.2 Particle size distribution of Blue Beads 6FF microspheres
合适的粒径分布对于吸附过程起着重要作用[23]。如图2所示,活性Blue Beads 6FF微球的粒径较为均匀,主要分布在45~65 μm范围内,平均粒径为56.37 μm,这与市场上常见的琼脂糖微球产品的数据基本一致,不仅可以保证装柱的均匀性,同时可以确保流速稳定,利于待分离样品在固定相中的物质分配[24]。
2.2 活性Blue Beads 6FF微球傅里叶变换红外光谱分析
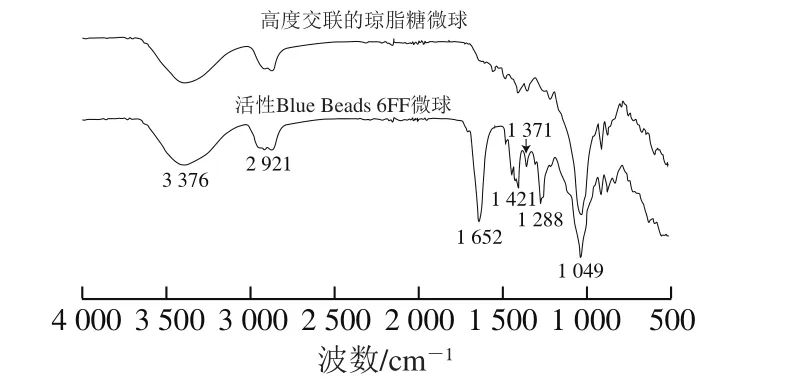
图3 高度交联的琼脂糖微球与Blue Beads 6FF的傅里叶变换红外光谱Fig.3 FTIR spectra of highly cross-linked agarose and Blue Beads 6FF microspheres
由图3可知,高度交联的琼脂糖(偶联汽巴蓝F3GA前的样品)与活性Blue Beads 6FF微球在3 376、2 921 cm-1和1 049 cm-1出现一致的吸收峰,分别归属于琼脂糖的O—H,C—H及琼脂糖交联环氧氯丙烷后产生的C—O—C的伸缩振动[17]。当汽巴蓝F3GA偶联之后,活性Blue Beads 6FF微球在1 652、1 421、1 371 cm-1和1 288 cm-1处出现4 个新的红外吸收峰,其中,1 652 cm-1处为C=O的伸缩振动吸收峰,1 421 cm-1为三嗪环的特征吸收,1 371 cm-1和1 288 cm-1为C—N的伸缩振动吸收峰[25]。以上结果表明,染料配基汽巴蓝F3GA已成功固载于交联的琼脂糖微球。
2.3 活性Blue Beads 6FF微球的物理性能
活性Blue Beads 6FF微球的物理性能如表1所示。测得活性染料配基汽巴蓝F3GA的偶联量为7.23 µmol/mL,表明配体偶联效果良好。活性Blue Beads 6FF微球的湿密度为1.26 mg/mL,溶胀率为266.67%,与市场上常见的琼脂糖微球产品的数据基本一致。孔隙率为67.74%,孔隙率良好,有利于蛋白吸附。染料配基汽巴蓝F3GA在0.5 mol/L NaOH、0.5 mol/L HCl和10 mmol/L pH 7.2的磷酸盐缓冲液中泄漏率为零,具有宽范围的pH值稳定性,表明染料偶联稳定。
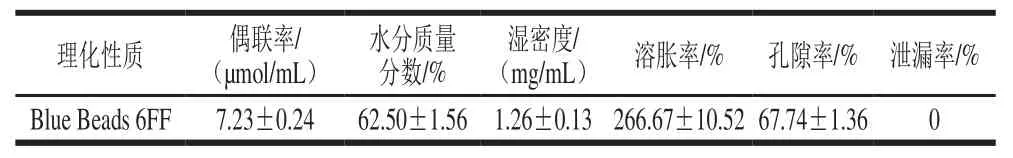
表1 Blue Beads 6FF的理化性质Table1 Physical properties of Blue Beads 6FF
2.4 活性Blue Beads 6FF微球压力流速曲线
通过压力流速曲线来表征填料微球的机械强度。由图4可知,实验制备的活性Blue Beads 6FF微球最大耐受压力为0.25 MPa,最大耐受流速为700 cm/h,机械强度显著增强。本实验制备的琼脂糖微球经过两次交联,介质的交联度大,故可以耐受更大的流速,扩大亲和介质的适用性[26]。
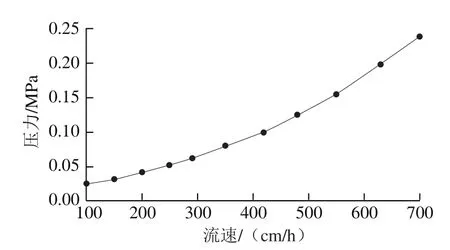
图4 Blue Beads 6FF的压力流速曲线Fig.4 Pressure-flow velocity curve of Blue Beads 6FF
2.5 活性Blue Beads 6FF微球的凝集素吸附性能
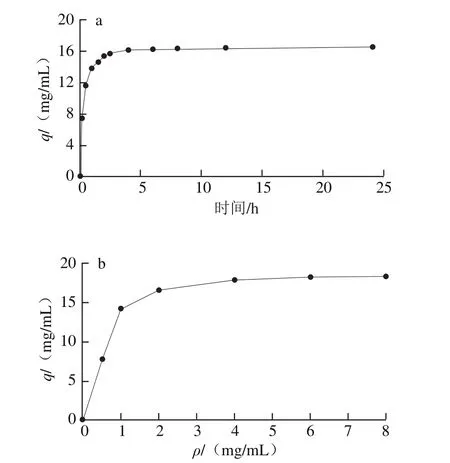
图5 吸附时间对Blue Beads 6FF吸附黑芸豆凝集素的吸附量影响(a)及吸附等温线(b)Fig.5 Adsorption capacity as a funtion of adsorption time of Blue Beads 6FF toward lectin from black kidney beans (a) and adsorption isotherms (b)
吸附时间对吸附量的影响如图5a所示。吸附开始时,液相中凝集素蛋白的浓度较高,溶液中和固相(活性微球)间的蛋白质量浓度差大,因此有着较高的吸附速率;随着吸附的进行,溶液中剩余的凝集素蛋白质量浓度逐渐减小,质量浓度差减小,导致吸附速率下降[27],4 h时达到吸附饱和,此时吸附量为15.32 mg/mL。
从图5b中可以看到,当黑芸豆凝集素质量浓度处于0~1 mg/mL时,吸附量随蛋白质量浓度的增加近似呈线性增长;随着蛋白质量浓度的增加,吸附量提高幅度逐渐降低,并趋于平缓。根据Langmuir曲线拟合得到Blue Beads 6FF微球的最大蛋白吸附量为19.7 mg/mL,解离常数Kd为0.68 mg/mL,表明本实验得到的染料配体对黑芸豆凝集素具有较好的特异性亲和力。
2.6 黑芸豆凝集素亲和层析纯化
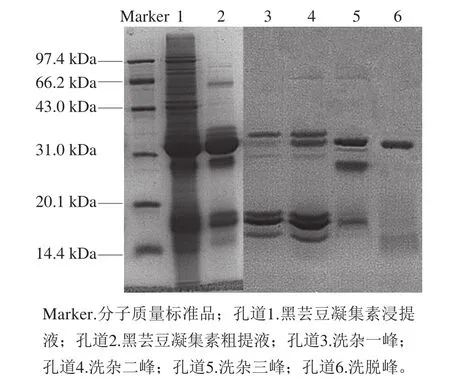
图6 黑芸豆凝集素分离纯化SDS-PAGE分析Fig.6 SDS-PAGE analysis of black kidney bean lectin after isolation and purification
如图6所示,黑芸豆蛋白浸提液经过酸碱调节及超滤离心粗分离后,分子质量大于32 kDa的杂蛋白大部分被去除。由于天然状态下的黑芸豆凝集素为四聚体(分子质量为120 kDa左右),在低酸性(pH 3.5)条件下凝集素蛋白会解聚为单聚体(分子质量为30 kDa左右)[28-29],因此,可利用50 kDa超滤离心管将大分子质量的杂蛋白大量去除。待溶液调pH值至7.2后,凝集素重新聚合为四聚体形式,可采用50 kDa超滤离心管去除小分子蛋白和盐离子。如表2所示,浸提液及超滤分离粗品的凝血活力分别为(1.45×103)HU/mg和(2.82×103)HU/mg,说明粗分离后黑芸豆凝集素的含量较高,凝集素得到有效富集,此时超滤分离凝集素纯化倍数为1.94 倍,蛋白得率为(51.61±1.26)mg/g,蛋白回收率为(42.83±0.26)%。

表2 Blue Beads 6FF亲和层析纯化凝集素步骤总结Table2 Summary of purification procedures of lectin from black kidney bean through Blue Beads 6FF affinity chromatography
传统凝集素提取经过硫酸铵分级沉淀、离子交换色谱及分子排阻色谱等多步色谱纯化,时间长、成本高、纯化得率低[30-31],黑芸豆凝集素的最终得率仅为(0.65±0.13)mg/g[7]。Ren Jiaoyan等[32]采用Tg-Sepharose亲和层析,显著提高了红芸豆凝集素的提取率,最终可达到(3.4±0.3)mg/g,表明亲和层析可以高效地被用于动植物凝集素的一步分离纯化[10],但是,这类天然的生物大分子配基本身需要纯化分离而获得,制备过程复杂且价格昂贵,同时,不易保持其生物活性[8,33]。因此,价格低廉、化学物理性能稳定,且不易被生物降解活性染料类配基已经成为目前的研究热点[14-15]。活性染料类配基是一类易于人工合成的、具有生物相似活性的小分子化合物,其中,三嗪型染料汽巴蓝F3GA应用最为广泛。研究表明,三嗪型染料汽巴蓝F3GA的分子结构包括3 个部分,即三嗪环、多芳香环和离子磺酸基团,可被固载于一些固相基质上,用于分离纯化干扰素,白蛋白和需要辅因子(如NAD、NADH、NADP和NADPH)活化的酶等[15,34]。本实验发现,采用汽巴蓝F3GA为配基活性Blue Beads 6FF微球对黑芸豆凝集素蛋白具有一定的亲和选择吸附性,这可能是由于汽巴蓝F3GA与N-乙酰葡萄糖胺具有相似的氨基、羰基及六元环结构所致[14-15],而N-乙酰葡萄糖胺是黑芸豆凝集素蛋白的特异性识别糖基配体[5]。由表2可知,本实验方法凝集素含量为(0.96±0.05)mg/mg,蛋白得率和纯化时间显著优于传统方法,且亲和填料制备成本显著降低。
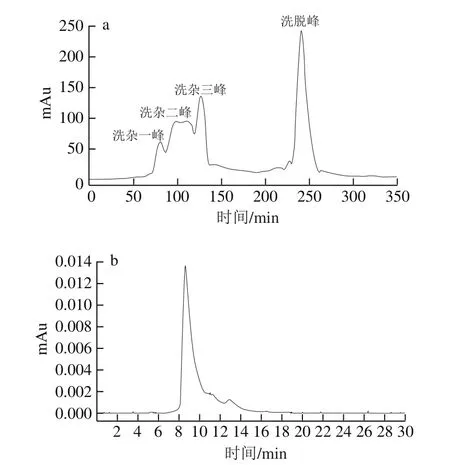
图7 黑芸豆凝集素的Blue Beads 6FF吸附洗脱曲线(a)及HPLC-GPC(b)Fig.7 Adsorption and desorption profiles of Blue Beads 6FF (a) and HPLC-GPC (b) toward lectin from black kidney bean
3 结 论
本研究以两次交联环氧氯丙烷的6 g/100 mL琼脂糖为固相载体,偶联染料配体汽巴蓝F3GA制备了一种新型高效染料亲和色谱介质Blue Beads 6FF,该亲和染料介质粒径均一,具有高的孔隙率、溶胀率及宽范围的pH值稳定性,且耐压能力强,对黑芸豆凝集素蛋白具有良好的亲和色谱分离性能,经一步亲和色谱纯化后凝集素含量可达(0.96±0.05)mg/mg,相对于传统方法及其他亲和介质具有显著的效率和成本优势,同时,可为其他种类凝集素和一些糖蛋白的快速分离纯化提供新的研究思路。

