拟南芥AFP4的克隆、原核表达和纯化及其与ABI5的互作
邓子兵,邱梁堃,马建忠
(兰州理工大学 生命科学与工程学院,甘肃 兰州730050)
脱落酸(abscisic acid,ABA)是植物响应生物与非生物胁迫的一个重要的激素,参与种子萌发、幼苗生长、种子成熟等生理过程[1-2]。拟南芥ABI5亚家族转录因子参与了植物种子晚期胚胎发育、种子萌发和生长,以及ABA信号转导等生长发育过程[3-11]。然而在随后的研究过程中,Lopez-Molina等[12]利用酵母双杂交系统筛选了与ABI5相互作用的蛋白AFP。在随后的研究中发现,AFP的表达特性与ABI5相似,在种子萌发期间受ABA诱导[13]。afp的突变体植株对ABA超敏感,而AFP超表达植株对ABA产生低抗性[13]。
AFPs与共抑制物TOPLESS相互作用,以抑制ABA调节的基因表达[13]。AFP的水稻同系物MODD(OsbZIP46失活和降解的调节剂)通过与TPR/HAD复合物和OsbZIP46(与拟南芥最接近的同源物)的相互作用而负调节ABA反应ABF1,导致OsbZIP46靶基因的组蛋白乙酰化减少[14]。MODD还与E3连接酶相互作用,导致OsbZIP46的稳定性降低。这些相互作用的组合效应是减弱ABA响应,类似于拟南芥中的AFP的作用[14]。AFP部分通过组蛋白乙酰化的改变抑制ABA/ABI5调控的基因的表达。在低浓度的ABA下,AFP1和AFP2与ABI5蛋白的比率最高,这些蛋白质在反馈环中起作用,以允许幼苗从ABA抑制生长中逃脱[2]。
到目前为止,对AFPs的研究大多局限于植物中的时空表达、ABA胁迫影响、突变体表型分析等方面。以AFP4为代表克隆其基因的完整编码序列,并表达纯化其蛋白,是研究其与ABI5相互作用机理所必需的。
1 材料与方法
1.1 材料
拟南芥哥伦比亚生态型(ArabidopsisthalianaL.Columbia)的饱满种子经4 ℃春化后播种于营养土(丹麦品氏基质5号,pH 5.5)表面,放置于植物温室(光照强度250 μmol·m-2·s-1,22 ℃,16 h光照,8 h黑暗,60%湿度)中培养。幼苗生长2周后取莲座叶片并提取基因组。
大肠埃希菌EscherichiacoliDH5α菌株、EscherichiacoliBL21 Star (DE3)菌株、pET-32a(+)质粒为兰州理工大学生命科学与工程学院马建忠研究员实验室保存。
所有限制性内切酶、PrimeSTAR®HS DNA聚合酶、T4 DNA连接酶、蛋白质分子量标准(低)、DNA Marker、DNA凝胶回收试剂盒、植物基因组DNA提取试剂盒购自大连宝生物工程有限公司。SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、SDS、IPTG、苯甲基磺酰氟(PMSF)、氨苄青霉素、琼脂糖、溴化乙锭、丙烯酰胺、胰蛋白胨和酵母提取物等购自生工生物工程(上海)有限公司。Ni-NTAAgarose购自Qiagen公司。Anti-HIS-antibody(D110002-0025)一抗和羊抗兔lgG二抗(ZB-2301)购自生工生物工程(上海)有限公司。其他常用试剂均为国产。
1.2 方法
1.2.1 拟南芥基因组的提取
剪取2周龄拟南芥幼苗的莲座叶100 mg,参照北京康为世纪生物科技有限公司的植物基因组DNA提取试剂盒和天根生化科技有限公司的植物RNA提取试剂盒进行拟南芥基因组和RNA的提取。用超微量核酸蛋白测定仪(NanoDrop 2000)检测其浓度后放置于-20 ℃保存备用。
1.2.2 拟南芥总RNA的提取及反转录
剪取拟南芥的叶片或整株于1.5 mL EP管中,并将EP管置于液氮中,用RNA试剂盒(天根)提取总RNA。利用NanoDrop2000测定提取的RNA浓度,置于-80 ℃保存,或者直接进行反转录。采用Invitrogen M-MLV试剂盒进行反转录,加入总RNA 1~5 μg·μL-1,100 μmol·L-1Oligo dT201 μL,10 mmol·L-1dNTP 1 μL,以ddH2O补足至29 μL,于冰上混合,65 ℃反应5 min后,迅速取出冰浴10 min;再在管中加入5×first strand buffer 8 μL、0.1 mol·L-1DTT 2 μL、200 U·μL-1M-MLV 1 μL,并轻轻混匀,37 ℃反应60 min后,于70 ℃放置15 min以终止反应。反转录完成后,加入ddH2O稀释cDNA浓度至20 ng·μL-1。
1.2.3AFP4基因CDS的扩增及原核表达重组质粒及酵母双杂交重组质粒的构建
根据GenBank中提供的AFP4基因序列(GenBank登录号:NM_111081.2)分别设计特异性引物。原核表达重组质粒上游引物F: 5′-ATGAATTCATGGAGATGATAAGAGGCAG-3′;下游引物R: 5′-CCGCTCGAGCTAGATAGAAGAAGA-AGGAAGTTTAAC-3′。酵母双杂交重组质粒上游引物F: 5′-ATGAATTCATGGAGATGATAAGAGGCAG-3′;下游引物R: 5′-AACTGCAGCTAGATAGAAGAAGAAGGAAGTTTAAC-3′。特异性引物由江苏金唯智生物科技有限公司合成。通过PCR扩增并分别将PCR产物经EcoRⅠ和XhoⅠ以及EcoRⅠ和PstⅠ双酶切后分别与pET-32a(+)原核表达载体和酵母双杂交载体pGBKT7连接,转化大肠埃希菌E.coliDH5α感受态细胞后,挑阳性克隆进行鉴定并送江苏金唯智生物科技有限公司进行测序。测序正确的重组质粒分别命名为pET-32a(+)-AFP4、pGBKT7-AFP4。
1.2.4ABI5基因CDS的扩增酵母双杂交重组质粒的构建
根据GenBank中提供的ABI5基因序列(GenBank登录号:NM_129185.3)设计特异性引物。酵母双杂交重组质粒上游引物F: 5′-ATGAATTCATGGTAACTAGAGAAACGAAGTTGACGT-3′;下游引物R: 5′-AACTGCAGTTAGAGTGGACAACTCGGGT-3′。特异性引物由江苏金唯智生物科技有限公司合成。通过PCR扩增并分别将PCR产物经EcoRⅠ和XhoⅠ双酶切后与酵母双杂交载体pGADT7连接,转化大肠埃希菌E.coliDH5α感受态细胞后,挑阳性克隆进行鉴定并送江苏金唯智生物科技有限公司进行测序。测序正确的重组质粒命名为pGADT7-ABI5。
1.2.5 AFP4重组蛋白的诱导表达
(1)IPTG诱导浓度的选择。将上述测序正确的重组质粒pET-32a(+)-AFP4转化大肠埃希菌E.coliBL21 Star (DE3)感受态细胞。挑取一个阳性单克隆接种于3 mL含60 μg·mL-1氨苄青霉素的液体LB培养基中,37 ℃过夜培养。次日按1∶100转接于20 mL含60 μg·mL-1氨苄青霉素的液体LB培养基中,37 ℃、220 r·min-1培养至D600为0.5~0.7,取1 mL菌液留做SDS-PAGE分析,然后分别加入IPTG,使其终浓度为0.2、0.4、0.6、0.8、1.2 mmol·L-1,30 ℃、150 r·min-1诱导培养4 h。分别稀释至相同D值后取1 mL菌液12 000 r·min-1离心2 min,收集菌体,随后用12% SDS-PAGE电泳进行蛋白表达量的分析。
(2)诱导时间的选择。挑取一个阳性单克隆接种于3 mL含60 μg·mL-1氨苄青霉素的液体LB培养基中,37 ℃过夜培养。次日按1∶100转接于300 mL含60 μg·mL-1氨苄青霉素的液体LB培养基中,37 ℃、220 r·min-1培养至D600为0.5~0.7,取1 mL菌液留做SDS-PAGE分析,然后分别加入IPTG使其终浓度为0.4 mmol·L-1。30 ℃、150 r·min-1进行诱导培养。分别在1、2、4、6、8 h进行取样,稀释至同一D值后取1 mL菌液12 000 r·min-1离心2 min,收集菌体,随后用12% SDS-PAGE电泳进行蛋白表达量的分析。空载的pET-32a(+)载体用相同的方法进行对照实验。
(3)诱导温度的选择。挑取一个阳性单克隆接种于3 mL含60 μg·mL-1氨苄青霉素的液体LB培养基中,37 ℃过夜培养。次日按1∶100转接于20 mL含60 μg·mL-1氨苄青霉素的液体LB培养基中,37 ℃、220 r·min-1培养至D600为0.5~0.7,取1 mL菌液留做SDS-PAGE分析,然后分别加入IPTG使其终浓度为0.4 mmol·L-1。分别于20、25、30、35 ℃进行诱导培养6 h,稀释至同一D值后取1 mL菌液12 000 r·min-1离心2 min,收集菌体,随后用12% SDS-PAGE电泳进行蛋白表达量的分析。
1.2.6 融合蛋白的纯化
将经过IPTG诱导的100 mL菌液经4 ℃、4 000 r·min-1离心10 min后收集菌体沉淀。之后用4 mL预冷的结合缓冲液(20 mmol·L-1NaH2PO4,20 mmol·L-1Na2HPO4,500 mmol·L-1NaCl,pH 7.4)重悬沉淀并加入PMSF至终浓度为1 mmol·L-1。冰浴30 min后用超声波破碎仪裂解菌体(JY92-II超声波细胞粉碎机,功率320 W,冰浴下超声4 s,间隔2 s,99个循环)。4 ℃、10 000 r·min-1离心30 min收集上清并经0.4 μm滤膜过滤后用于Ni-NTA亲和层析柱纯化。2 mL Ni-NTA层析柱以6倍柱体积的平衡缓冲液(20 mmol·L-1NaH2PO4,20 mmol·L-1Na2HPO4,500 mmol·L-1NaCl,pH 7.8)平衡后进行上样。上样后,用约40 mL洗涤缓冲液(20 mmol·L-1NaH2PO4,20 mmol·L-1Na2HPO4,500 mmol·L-1NaCl,pH 6.0,流速18 mL·h-1)洗涤层析柱,直至流出液体的D280小于0.01。之后依次用10 mL含10、50、100、150、200 mmol·L-1咪唑的洗脱缓冲液洗脱目的蛋白。分管收集洗脱液,测定D280,用SDS-PAGE电泳鉴定蛋白纯度。
1.2.7 Western blot分析
按照文献[15]将蛋白进行SDS-PAGE电泳,根据蛋白Marker及目的蛋白的位置将剥离的凝胶进行裁剪,根据戎芳等[16]的方法进行Western blot分析。Anti-HIS-antibody(D110002-0025)一抗用TTBS稀释至5 μg·mL-1。辣根过氧化物酶标记的山羊抗兔lgG二抗(ZB-2301)用TTBS稀释至10 ng·mL-1。
1.2.8 酵母双杂交验证AFP4与ABI5的相互作用
(1)酵母感受态细胞的制备。从YPDA固体培养基表面选择年龄为2周左右、直径为3 mm左右的酵母AH109单菌落,并将其接种于0.5 mL YPDA液体培养基中,涡旋振荡约3 min以分散聚集在一起的酵母细胞,然后将其全部接种于10 mL YPDA液体培养基中,30 ℃、250 r·min-1振荡培养约18 h,直到菌体D600值达到1.5以上。将过夜培养物接种于250 mL YPDA液体培养基中并使初始菌体D600值为0.2~0.3,30 ℃、250 r·min-1振荡培养约4 h,直到菌体D600值为0.4~0.6。1 000g、室温离心5 min,小心倒掉上清,加入20 mL 1×TE/LiAc 溶液重悬酵母细胞,1 000g、室温离心5 min,小心倒掉上清,再重复一次。向沉淀的酵母细胞中加入约3 mL 1×TE/LiAc溶液并轻轻悬起细胞,即为酵母感受态细胞,可将感受态细胞封存于4 ℃冰箱或冰浴中,保存最长时间约为4 h。
(2)重组质粒转化酵母感受态细胞。吸取0.1 μg重组质粒于1.5 mL灭菌离心管中,再加入10 μL鲑鱼精子DNA(Sperm DNA,10 mg·mL-1),用移液器反复吹打混匀,酵母感受态细胞缓缓颠倒混匀,分别吸取100 μL加入到上述离心管中,并用移液器缓慢吹打混匀。每个离心管加入600 μL 1×PEG/LiAc,涡旋振荡混匀,30 ℃、150 r·min-1振荡培养40 min,各加入70 μL 100% DMSO,缓慢颠倒混匀后,置于42 ℃水浴保温15 min,迅速放入冰浴冷却2 min。12 000 r·min-1、室温离心30 s,轻轻吸取上清,再在每管中加入500 μL 1×TE并吹打混匀,吸取100 μL悬浮液均匀涂布于SD/-Trp营养缺陷型固体培养基表面,待表面的液体挥发后,于30 ℃恒温倒置培养4~6 d,直至长出的菌落直径约为3 mm。
2 结果与分析
2.1 拟南芥基因组的提取以及AFP4原核表达载体的构建
以提取的拟南芥基因组为模板,采用特异性引物通过PCR扩增获得AFP4整个编码序列(图1-A),分别将pET-32a(+)载体和PCR产物用EcoRⅠ和XhoⅠ进行双酶切,T4连接酶连接并转化大肠埃希菌E.coliDH5α,阳性克隆进行PCR鉴定(图1-B),EcoRⅠ和XhoⅠ双酶切鉴定发现有一条大约1 000 bp的条带(图1-C),随后进行测序。
2.2 AFP4重组蛋白的诱导表达
AFP4编码序列插入pET-32a(+)表达载体中后形成一个可编码486个氨基酸残基的开放阅读框,经计算,该融合蛋白的分子量为53.4 ku(图2)。实验结果表明,IPTG终浓度为0.4 mmol·L-1时融合蛋白含量占上清总蛋白含量比例最高,为24.3%(图3-A)。用终浓度为0.4 mmol·L-1的IPTG同时诱导空载载体和融合载体,经过不同的时间诱导后,经BandScan 5.0软件扫描分析SDS-PAGE电泳结果,发现空载载体只有一条大约23 ku的小条带,而诱导6 h时融合蛋白质含量占上清总蛋白含量比例最大,为40.1%(图3-C)。在前两个参数(IPTG浓度、诱导时间)的基础上进一步研究不同温度诱导蛋白表达量。结果表明,25 ℃时融合蛋白质含量占上清总蛋白含量比例最大,为41.6%(图3-D)。
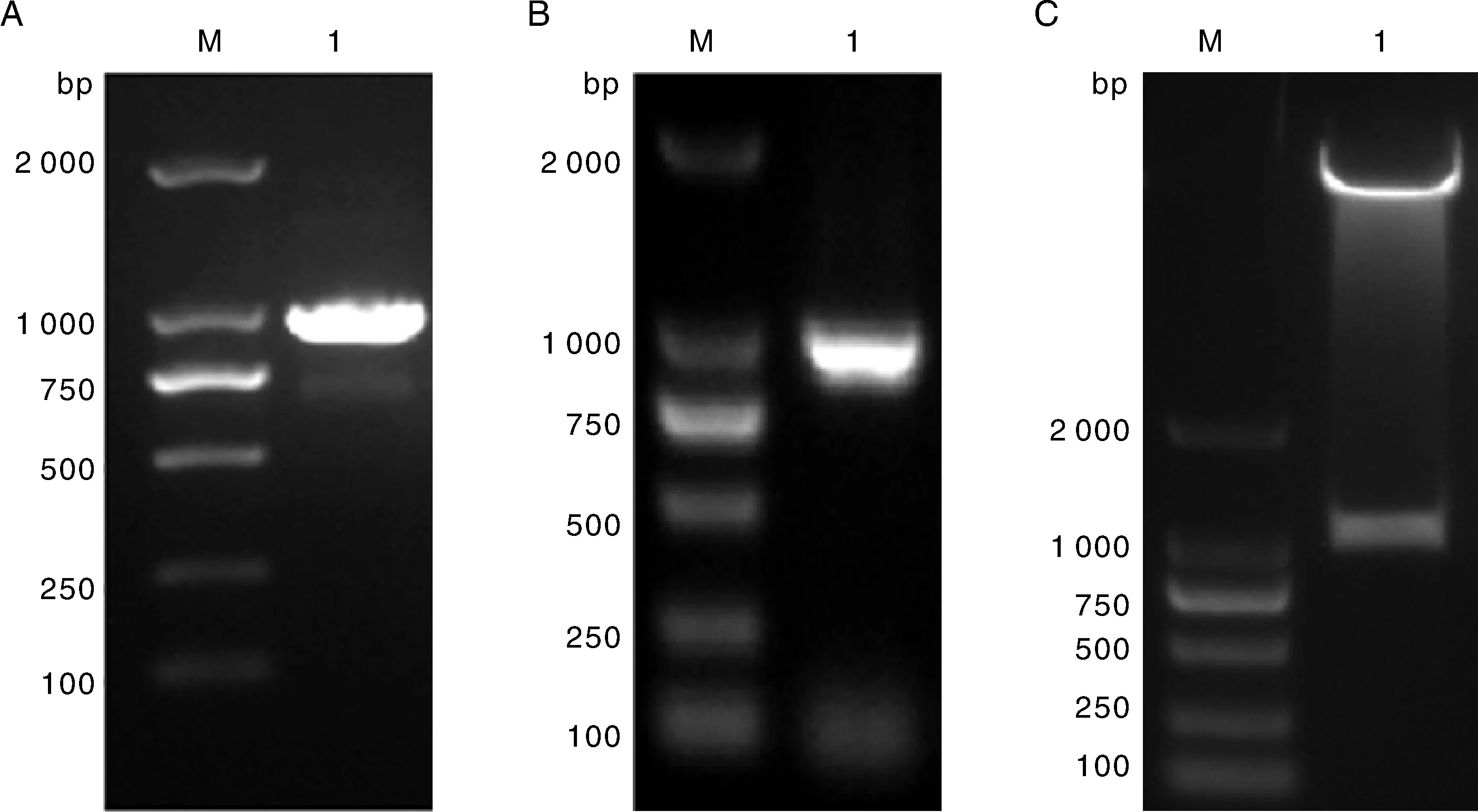
A: AFP4编码区PCR扩增产物。M,DL2000 DNA marker;1,AFP4 PCR产物。B: AFP4菌落PCR鉴定。M,DL2000 DNA marker;1,AFP4菌落PCR鉴定。C:双酶切鉴定重组质粒,M,DL2000 DNA Marker;1,重组质粒酶切鉴定。A: PCR amplification products in coding region of AFP4.M,DL2000 DNA marker; 1,PCR amplification products of AFP4.B: PCR identification of colony of AFP4.M,DL2000 DNA marker; 1,PCR identification of colony of AFP4.C: Double enzyme digestion for identification of recombinant plasmids.M,DL2000 DNA marker; 1,Identification of recombinant plasmid by restriction enzyme digestion.图1 AFP4扩增、PCR鉴定及双酶切鉴定琼脂糖凝胶电泳图Fig.1 PCR amplification,detection and double enzyme identification of AFP4
2.3 AFP4重组蛋白的纯化及Western blot鉴定分析
100 mL菌液在IPTG终浓度为0.4 mmol·L-1、25 ℃下诱导6 h后超声裂解,上清液加载至Ni-NTA亲和层析柱,洗涤缓冲液洗涤之后,以含不同咪唑浓度的洗脱缓冲液洗脱。诱导表达的蛋白条带在咪唑浓度为150 mmol·L-1时可被洗脱。SDS-PAGE结果显示,经Ni-NTA亲和层析柱纯化后的蛋白为一条清晰的条带。BandScan 5.0软件扫描样品泳道后显示,该条带的蛋白含量可占到上样成分的86.9%(图4-A)。为了更进一步确定该条带是否为含AFP4的融合蛋白,经Western Blot分析,结果表明上述纯化的蛋白含有6×His标签肽(图4-B)。
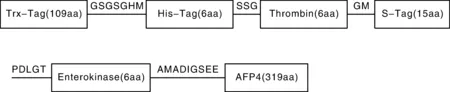
图2 AFP4重组融合蛋白结构图Fig.2 Fusion protein structure of AFP4
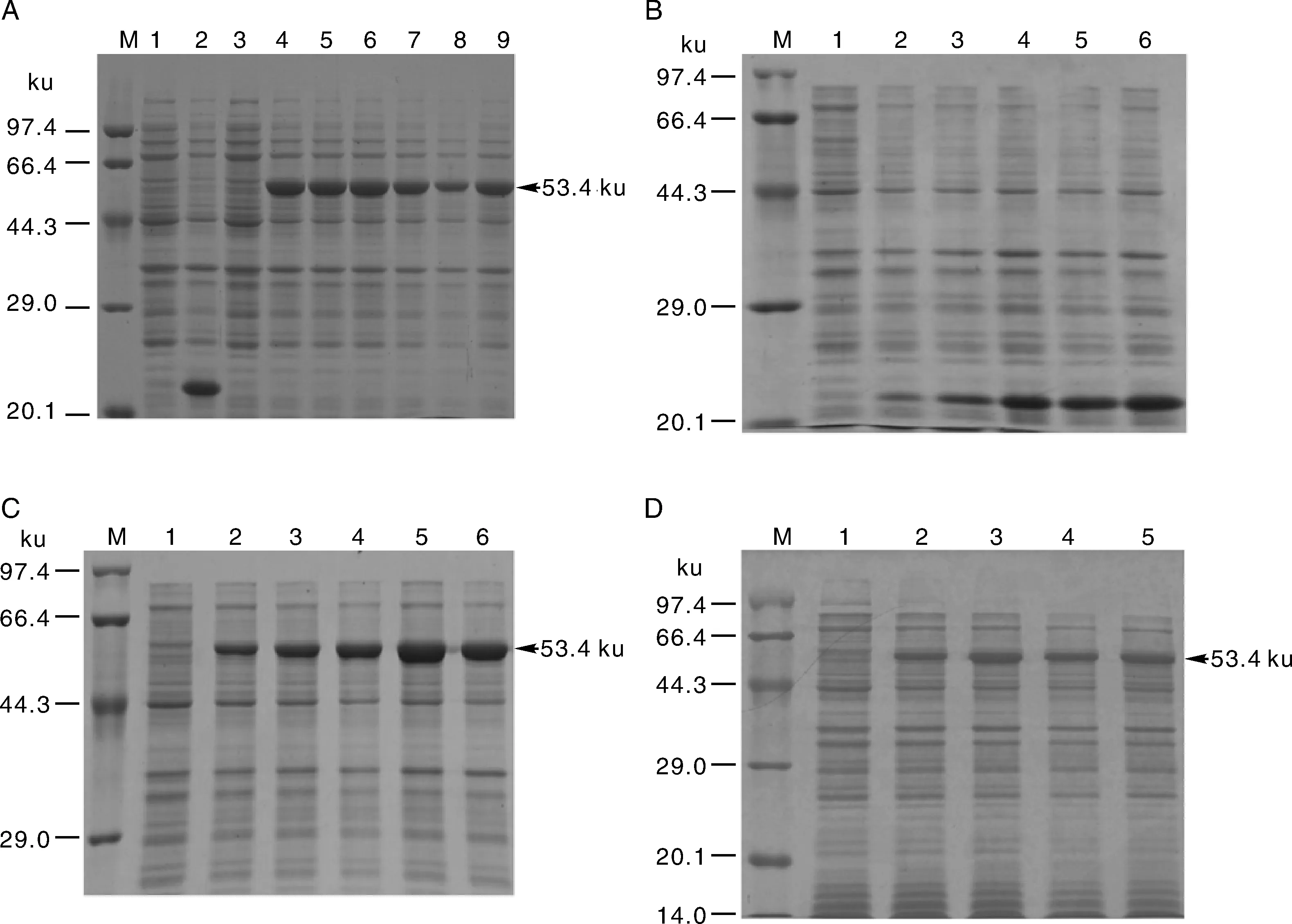
A:不同IPTG浓度诱导融合蛋白表达量。M,Premixed protein marker (Low);1,pET-32a(+)诱导前;2,pET-32a(+)诱导后;3,pET-32a(+)-AFP4诱导前;4~9,当IPTG浓度分别为0.1、0.2、0.4、0.6、0.8、1.0 mmoL·L-1时诱导含pET-32a(+)-AFP4的大肠埃希菌4 h的蛋白表达量;B:pET-32a(+)空载诱导蛋白表达量。M,Premixed protein marker (Low);1,pET-32a(+)诱导前;2~6,当IPTG浓度分别为0.1、0.2、0.4、0.6、0.8 mmoL·L-1时诱导含pET-32a(+)的大肠埃希菌蛋白的表达量。C:不同诱导时间融合蛋白的表达量。M,Premixed protein marker (Low);1,pET-32a(+)-AFP4诱导前;2~6,当诱导时间分别为1、2、4、6、8 h时诱导含pET-32a(+)-AFP4的大肠埃希菌蛋白的表达量。D:不同诱导温度融合蛋白的表达量。M,Premixed protein marker (Low);1,pET-32a(+)诱导前;2~5,当诱导温度分别为35、30、25、20 ℃时诱导含pET-32a(+)的大肠埃希菌蛋白的表达量。A: Expression of fusion protein induced by different IPTG concentration.M,Premixed protein marker (Low); 1,Before induction of pET-32a(+); 2,After induction of pET-32a(+); 3,Before induction of pET-32a(+)-AFP4; 4-9,Protein expression of Escherichia coli 4 h containing pET-32a (+)-AFP4 was induced when the concentrations of IPTG was 0.1,0.2,0.4,0.6,0.8 and 1.0 mmoL·L-1.B: PET-32a (+) no load induced protein expression.M,Premixed protein marker (Low); 1,Before induction of pET-32a(+); 2-6,Expression of Escherichia coli protein containing pET-32a (+) was induced when the concentrations of IPTG was 0.1,0.2,0.4,0.6 and 0.8 mmoL·L-1.C: Expression of fusion protein at different induction time.M,Premixed protein marker (Low); 1,Before induction of pET-32a(+)-AFP4; 2-6,Expression of Escherichia coli protein containing pET-32a(+)-AFP4 was induced when the induction time was 1,2,4,6 and 8 h.D: Expression of fusion protein at different induction temperatures.M,Premixed protein marker (Low); 1,Before induction of pET-32a(+); 2-5,Expression of Escherichia coli protein containing pET-32a (+) was induced when the induction temperature was 35,30,25 and 20 ℃.图3 不同参数诱导融合蛋白的表达量Fig.3 Expression quantity of induced fusion protein under different conditions
2.4 酵母双杂交验证AFP4与ABI5相互作用结果
将质粒按照表1的顺序共同转化至酿酒酵母AH109中,并涂布于SD-Leu/Trp固体培养基上,30 ℃培养3~4 d。挑2 mm左右的单菌落于3 mL SD-Leu/Trp液体培养基中,30 ℃、220 r·min-1过夜培养。次日用微量移液器将培养物分别点在SD-Leu/-Trp,SD-Leu/-Trp/-His/-Ade,SD-Leu/-Trp/-His/-Ade X-α-Gal固体培养基上,30 ℃培养3~4 d。
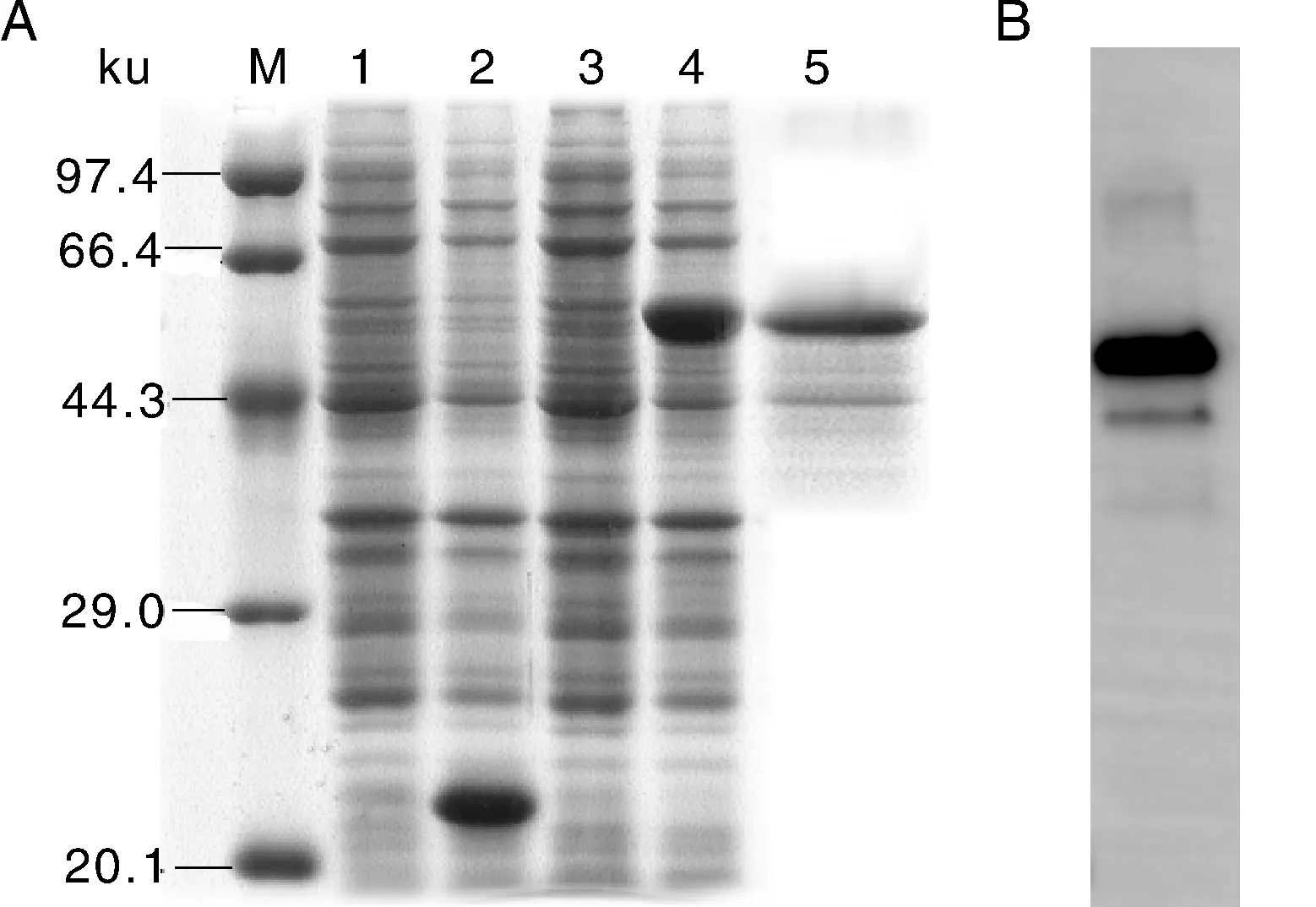
A: SDS-PAGE电泳。M,Premixed protein marker (Low);1,pET-32a(+)诱导前;2,pET-32a(+)诱导后;3,pET-32a(+)-AFP4诱导前;4,pET-32a(+)-AFP4诱导后;5,Ni-NTA亲和层析柱纯化后。B: Western blot鉴定结果。A: SDS-PAGE.M,Premixed protein marker (Low); 1,Before induction of pET-32a(+); 2,After induction of pET-32a(+); 3,Before induction of pET-32a(+)-AFP4; 4,After induction of pET-32a(+)-AFP4; 5,After purification with Ni-NTA affinity chromatography column.B: Identification result of Western blot.图4 重组蛋白的纯化以及Western blot鉴定结果Fig.4 Purification of recombinant proteins and identification results of Western blot
3 讨论
本实验结果表明,AFP4融合蛋白在大肠埃希菌E.coliBL21 Star (DE3)中的表达是非常强烈的,可能归因于大肠埃希菌表达系统具有遗传背景清楚、细胞生长迅速、目的基因表达水平较高、培养成本低、培养周期短等特点[17]。然而外源目的基因的表达量也受到菌体生长状况、诱导温度、时间以及诱导剂的浓度等因素的影响[18]。由于本实验的目的融合蛋白不是大批量生产,不需要通过正交分析确定最优的工艺条件。在IPTG终浓度为0.4 mmol·L-1、25 ℃下诱导6 h之后的培养物中,目的蛋白的表达量占上清液总蛋白的41.6%。在经不同IPTG浓度诱导融合蛋白表达的过程中,经0.8 mmol·L-1诱导时重组蛋白含量有所降低,这极有可能是操作过程中产生的误差。
经Ni-NTA亲和层析柱纯化后,虽然为一条清晰的条带,但是其前面有一条微弱的条带以及弥散杂带,有可能是纯化过程中条件不成熟造成的非特异性蛋白质或目的蛋白降解。将诱导之后的目的蛋白质条带和纯化后的蛋白质条带经Western blot鉴定分析,结果证实了上述表达以及纯化的蛋白是AFP4重组蛋白。然而对于上述几个问题形成的原因仍有待于进一步实验加以证实。

表1 共转质粒信息表
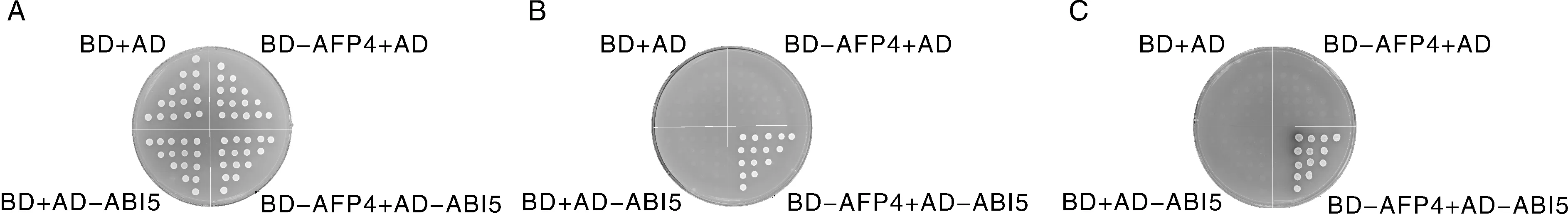
A,SD-Leu/-Trp生长结果;B,SD-Leu/-Trp/-His/Ade生长结果;C,SD-Leu/-Trp/-His/Ade X-α-Gal显色结果。A,Growth results of SD-Leu/-Trp; B,Growth results of SD-Leu/-Trp/-His/Ade; C,Chromogenic results of SD-Leu/-Trp/-His/Ade X-α-Gal.图5 酵母双杂交鉴定结果Fig.5 Analysis of yeast two-hybrid
酵母双杂交系统最早是由美国科学家Fields等[19]于1989年提出的,由于其遗传背景简单、操作简单、灵敏度高、技术成熟等,已经广泛被用于蛋白质-蛋白质之间相互作用的验证、细胞信号转导、功能基因组学研究等工作[20-23],在研究蛋白质-蛋白质之间的相互作用、文库筛选、筛选新的多肽药物、研究基因和蛋白质的功能等方面发挥了重要作用[20]。随着科学技术的发展,在酵母双杂交系统的基础上,通过不断改进建立了酵母单杂交系统[21]、酵母三杂交系统[22]以及反向双杂交系统[23]。酵母双杂交及其衍生系统在生物学各个领域应用的不断扩大,为我们展示了一个获得生物体内蛋白质之间纷繁复杂作用关系的有效途径。随着酵母双杂交系统的不断改进与完善,酵母双杂交及其相关技术将得到更广泛的应用,在蛋白质组学、细胞周期调控、细胞信号转导和肿瘤基因表达,以及植物激素信号通路等领域的研究中将发挥巨大的作用。
致谢:本实验部分结果是在兰州大学细胞活动与逆境适应教育部重点实验室完成。感谢黎家教授、苟小平教授、何凯教授,以及肖成斌等各位师兄师姐的支持与帮助。

