三维立体培养间充质干细胞的生物学特性
邓俊豪,李 苗,张里程,唐佩福
1解放军总医院 骨科,北京 100853;2北京大学深圳研究生院,广东深圳 518055
间充质干细胞是一类形态呈梭形、具有高度可塑性、来源广泛的多能干细胞[1-2]。因其具有多向分化潜能、强大的旁分泌及免疫调控作用[3-4],自Friedenstein首次报道间充质干细胞以来[5],已有多个动物实验将其应用于细胞移植治疗[6],如心肌梗死[7-8]、皮肤坏死[9-10]、神经创伤[11-12]等损伤修复,部分已经开始Ⅰ期、Ⅱ期甚至Ⅲ期临床试验[13-16]。然而,尽管间充质干细胞来源广泛、易于获取,但人们从组织中进行原代细胞分离后,仅能获取极少数量的间充质干细胞[17]。因此,在间充质干细胞应用于移植治疗之前,需要在体外进行细胞扩增以得到足够数量的细胞。目前体外细胞扩增的“金标准”仍然是依赖传统的培养皿进行二维贴壁培养。人体绝大多数的正常生理细胞,均以三维立体形式存在以发挥其正常功能[18-19]。因此,传统二维的体外培养环境可能会使间充质干细胞的许多生物学性状难以维持,导致细胞老化、分化潜能下降及旁分泌功能受损等[20-21]。为维持细胞原有的生物学特性,我们应用并改良三维悬滴(Hanging-drop)法培养三维细胞[22]。之前已有相关研究报道了Hanging-drop培养方式在某些模型上的优势[23-24],但缺乏该方法培养的3D细胞与传统贴壁培养的2D细胞的直接对比研究,缺少直观的证据表明此类细胞的优势。因此,本次研究选择了人胎盘来源的间充质干细胞进行实验,从不同方面对比了2D和3D间充质干细胞的生物学特性,为未来3D间充质干细胞应用于移植治疗提供依据。
材料和方法
1 主要试剂和药品 DMEM培养液、青霉素/链霉素双抗溶液、10%胎牛血清(Gibco公司)、0.25%Trypsin-EDTA酶(Sigma公司)、人胎盘来源的间充质干细胞株(清华大学深圳研究生院馈赠)、Annexin V-FITC细胞凋亡试剂盒(Invitrogen公司)、TRIzol抽提试剂盒(Invitrogen公司)、SuperscriptⅡ逆转录酶(Invitrogen公司)、ELISA试剂盒(四正柏生物科技有限公司)。
2 2D间充质干细胞培养 将所得人胎盘来源的间充质干细胞株复苏后,用富含DMEM培养液、10%胎牛血清及青霉素/链霉素双抗进行重悬,并将细胞种植到未经处理的聚苯乙烯培养皿上进行培养。培养液每2 d更换1次,当细胞融合达80%时,用0.25% Trypsin-EDTA酶消化进行传代。本次试验均采用4 ~ 5代的细胞。
3 3D间充质干细胞培养 选择一致的间充质干细胞株复苏后进行悬滴法三维培养[22]:复苏后的细胞以悬滴形式种于培养皿上,每一悬滴含有DMEM培养液、10%胎牛血清及2×104个细胞,培育36 h。然后将成球的细胞聚集体转移到培养基上再次培育24 h。用0.25%的Trypsin-EDTA酶消化球形体细胞4 ~ 6 min,同时每2 ~ 3 min轻柔吹打1次以获得单个的间充质干细胞。
4 形态学观察 自细胞培养起,分别在第1、4、7天应用普通倒置光学显微镜对细胞的生长、形态等情况进行动态追踪观察,对比两组细胞的形态学改变。
5 细胞直径测量 细胞培养72 h后,用0.25%Trypsin-EDTA酶对两组细胞进行消化后重悬,在倒置光学显微镜下观察并拍照,所得图片用Image J (NIH)软件测量细胞直径(每个视野下测量100个细胞的直径,取其平均值)。
6 流式细胞术进行细胞存活率检测 分别收集2D与3D间充质干细胞约2×105个,用Annexin V-FITC与PE细胞凋亡试剂盒进行染色,计算Annexin V-FITC/PE阳性细胞比例,从而进行细胞存活率检测。
7 实时定量PCR(RT-PCR)检测抗炎因子(IL-4,IL-10,IL-11及IL-13)和重要生长因子(VEGF和NT-3)的表达 按照说明书,用TRIzol试剂进行两组细胞的总RNA抽提。用SuperscriptⅡ逆转录酶和寡核苷酸引物(dT)合成一条cDNA链,并将其储存于-20℃。应用SYBR Green实时PCR Master Mix进行RT-PCR过程。选择等量的GAPHD作为内参,所得数据用2-△△Ct进行标准化分析。所设计的引物见表1。
8 酶联免疫吸附试验(ELISA)测定血管源性生长因子VEGF的表达 2D和3D细胞以同等密度水平种植在六孔中,加入DMEM培养24 h,收集其培养基,离心并储存在-80℃。用酶联免疫吸附试验试剂盒测定血管源性生长因子多肽(VEGF)浓度。
9 统计学分析 用SPSS17.0进行统计学分析,计量数据以±s表示,两组比较采用两独立样本t检验进行分析,P<0.05为差异有统计学意义。
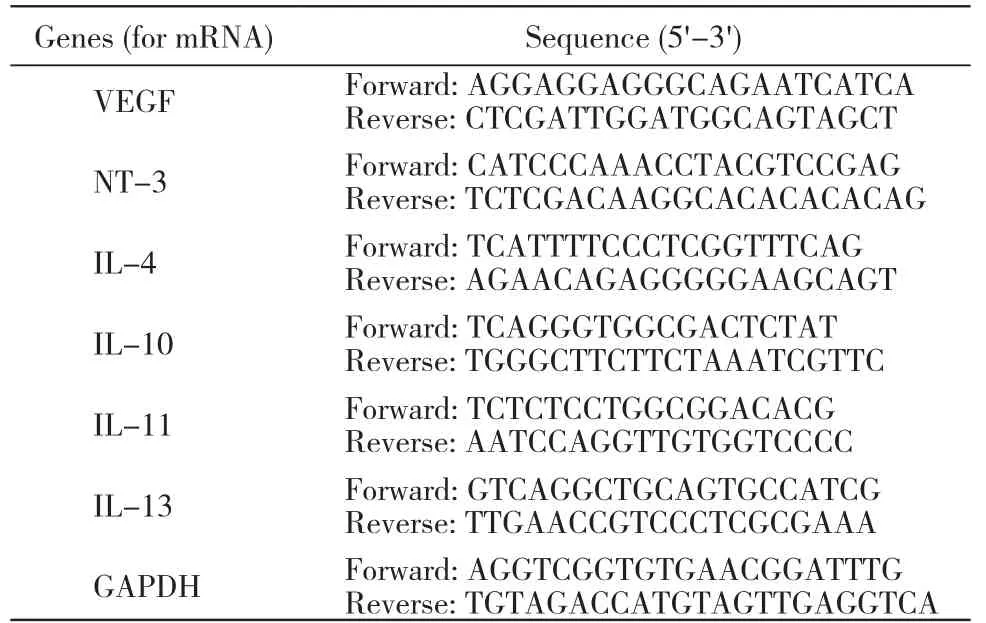
表1 RT-PCR所需引物的序列Tab. 1 Prime sequences for RT-PCR
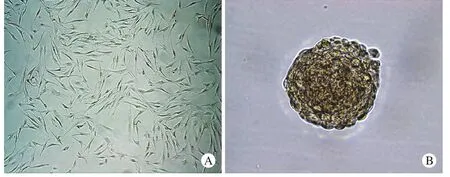
图 1 2D和3D间充质干细胞的形态学观察A为普通贴壁培养第7天的形态,细胞伸长呈长梭形; B为三维培养的细胞第7天的形态,可见3D间充质干细胞呈明显的球形聚集生长。二者均未见到明显衰老坏死的细胞Fig. 1 Morphological observation of 2DMSCs vs 3DMSCs A: the morphology of 2DMSCs at the 7th day.Cells grew as the spindle-shape; B: 3DMSCs were more likely to grow as a spheroid. There was no obvious senescent or necrosis cell in both of them
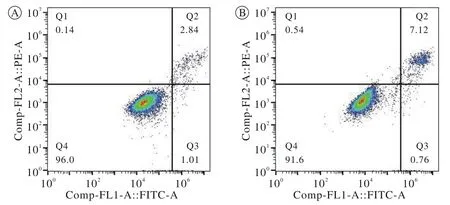
图2 两组细胞存活率的流式细胞测定A:2D细胞存活率为96%; B:3D细胞存活率为91.6%Fig. 2 Comparison of survival rate between two groups The survival rate of 2DMSCs was 96%, while the survival rate of 3DMSCs was 91.6%
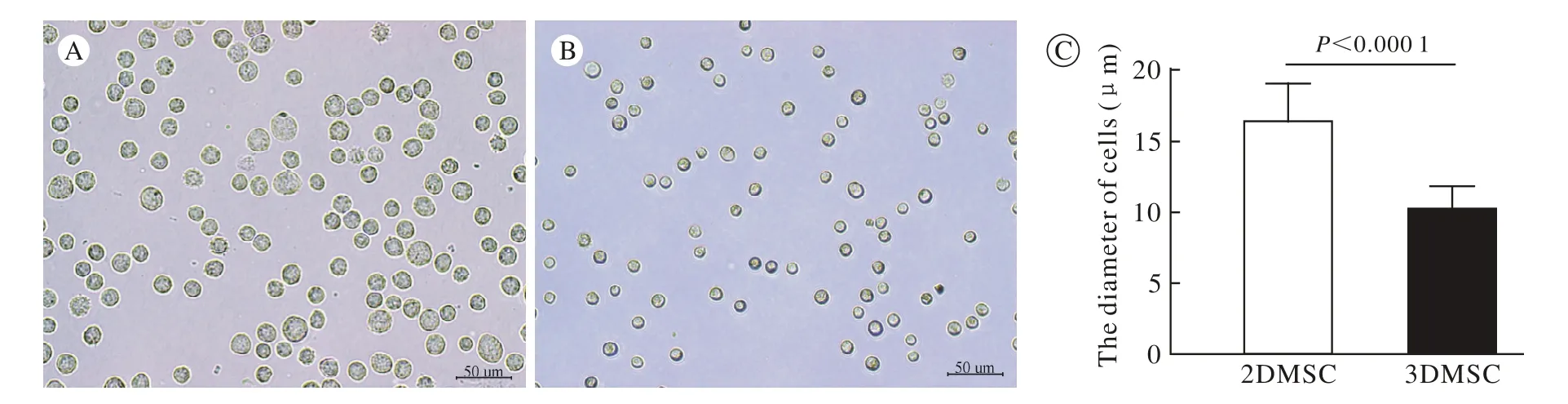
图3 两组细胞直径比较 A:2D细胞; B:3D细胞; C:3D细胞的直径显著低于2D细胞Fig. 3 Comparison of cell size of two groups. Panel A and panel B were the representative picture of 2DMSCs and 3DMSCs under a standard microscopy, respectively. Panel C showed that the average cell size of 3DMSCs was smaller
结 果
1 细胞形态学观察 2D间充质干细胞在原代培养3 ~ 4 h开始贴壁,24 h左右细胞呈完全贴壁生长,7 d时细胞融合达80 ~ 90%,光学显微镜下可观察到呈均一长梭形的间充质干细胞(图1A);悬滴法培养的3D间充质干细胞,则表现为聚集成球生长(图1B)。两组细胞大部分生长完好,很少见到衰老死亡的细胞。
2 细胞存活率的比较 经过Annexin-V FITC染色后,流式细胞仪结果显示2D与3D间充质干细胞存活率分别为96%、91.6%(P=0.234),差异无统计学意义(图2)。
3 细胞直径比较 2D间充质干细胞平均直径为16.31μm,3D间充质干细胞的平均直径为10.15μm,减少了37.8%(P<0.001)。见图3。
4 细胞因子分泌能力比较 与2D间充质干细胞相比,3D间充质干细胞的VEGF、NT-3、IL-4、IL-10、IL-11、IL-13的mRNA表达水平明显上升(P均<0.05)。见图4。
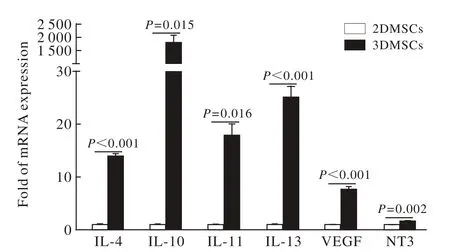
图4 IL-4、 IL-10、 IL-11、 IL-13、 VEGF及NT3 mRNA表达水平比较Fig. 4 Comparison of IL IL-4, IL-10, IL-11, IL-13, VEGF and NT3 at mRNA level between 2DMSCs and 3DMSCs
5 血管源性生长因子蛋白表达比较 ELISA法结果显示,与2D细胞相比,3D细胞的VEGF的表达量显著升高(P=0.002)。见图5。
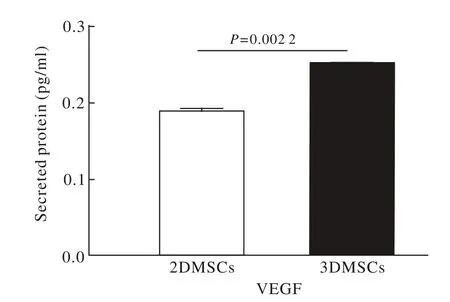
图5 ELISA结果显示,3D间充质干细胞的VEGF的表达显著高于2D间充质干细胞Fig. 5 ELISA results showed that the protein level of VEGF was highly expressed in 3DMSCs when compared to 2DMSCs
讨 论
目前体外培养间充质干细胞的经典方式仍然是传统贴壁培养。这种培养方式因操作简便、能够短时间内扩增获得足够数量的细胞等优点,受到广泛的青睐。然而,这种二维贴壁培养的微环境与该细胞在原代分离前所处的微环境相差甚远,使得所培养干细胞的生物学特性难以维持,导致分化潜能降低、增殖性细胞老化及旁分泌功能受损等[25-27]。因此,探索可替代、不明显影响细胞生物学特征的培养方式势在必行。
相比于传统的贴壁培养,以三维立体的方式进行培养能够更好地模拟体内生理环境,减少对细胞生物学特征的影响。目前对三维培养方式的构建,大多研究依赖研发的新型支架材料,如Zhou等[28]使用猪真皮基质作为支架进行人间充质干细胞三维培养,发现细胞的迁移归巢能力得到明显提升;Fagihihi等[29]应用明胶材料作为支架进行三维培养,使得间充质干细胞的分化潜能明显提高。但是,生物或人工材料的应用会明显限制间充质干细胞的应用范围,尤其是临床的细胞移植治疗,因为材料终究是异物,会带来相应的免疫排斥反应,加之材料会占据相当的空间,易引起血管堵塞等问题。
本次研究采用改良的悬滴法进行人胎盘间充质干细胞的培养,该方法无需任何体外的支架材料,即可营造三维的培养环境,具备高效率、低成本等优点。培养所得细胞在形态学上表现为大小均一,呈三维球形生长。同时,我们对比了3D和2D间充质干细胞的直径,结果表明3D的间充质干细胞的直径明显减小。这一点尤其重要,因为目前临床上最常用的细胞移植方式为血管内注射移植[30],细胞较大常会引起血管堵塞,不仅影响疗效,还会导致严重不良反应,如肺栓塞、缺血性脑梗等。这为后期3D间充质干细胞的临床移植治疗提供便利。
大量研究表明,间充质干细胞发挥治疗的效应主要通过其旁分泌效应而非细胞替代作用[31]。其旁分泌效应又是通过释放营养因子和抗炎因子实现。因此,我们进一步对比了3D与2D间充质干细胞的旁分泌功能。研究表明,在mRNA水平上,前者的VEGF、NT-3以及多种抗炎因子IL-4、IL-10、IL-11、IL-13的水平显著高于2D间充质干细胞;为进一步确定某些因子在蛋白质水平上的表达,我们选择性地检测了VEGF的表达,因为该种细胞因子对创伤的修复以及血管的再生具有重要作用。结果表明,3D间充质干细胞的VEGF表达明显高于2D间充质干细胞。我们也应用流式细胞术检验了两组细胞的存活率,结果表明经过三维处理的3D细胞与2D细胞在存活率上无统计学差异。
本次研究也存在一定的局限性,我们尽管从多个方面观察到三维培养的优点,但其优势的具体机制仍不得而知,仍需进一步开展相关实验进行研究。另外,相比于2D间充质干细胞,3D间充质干细胞某些重要因子的表达反而下降,如脑源性生长因子多肽(该因子在神经损伤修复中发挥重要作用,相关数据未发表)。
综上所述,本实验对比了改良悬滴法培养的3D间充质干细胞与传统贴壁培养的2D间充质干细胞,发现3D间充质干细胞在分泌营养因子及抗炎能力上要明显强于2D间充质干细胞,而更小的细胞直径使其在未来的临床应用上有良好前景,为3D间充质干细胞的下一步动物及临床实验奠定了基础。

