TACE联合多影像引导技术精准消融特殊部位肝细胞癌29例
杨柏帅, 袁 敏, 侯毅斌, 周 粟, 李清涛, 陈天佑
肝细胞癌(HCC)是常见的恶性肿瘤,全球范围内每年新发病例达100万例[1],但仅约20%患者具备条件接受手术切除、肝移植和针对部分小肝癌的消融术[2]。部分患者由于肿瘤的大小及位置存在较高的手术风险[3]。对于不能手术的患者,RFA是一种相对理想的治疗方案,既往研究也提示,小肝癌行RFA治疗可以得到较好的局部控制率,能够显著延长患者生存时间[4],从而为患者争取到等待肝移植时间[5]。研究显示,一些特殊部位的肝癌并不适合行消融治疗[6]。另外部分膈顶、肋骨后肝癌病灶,超声无法探及,常规CT引导困难,单纯消融存在一定风险。本研究旨在评估TACE联合超声、透视、DynaCT等多种影像技术融合引导精准RFA治疗特殊部位HCC的可行性、安全性及有效性。
1 材料与方法
1.1 材料
1.1.1 患者入组标准 ①经病理学确诊或符合我国卫生部颁布的原发性肝癌诊疗规范2017版临床诊断标准的肝细胞肝癌患者;②肿瘤直径≤5 cm;③特殊部位定义为:肿瘤位于膈顶、肋骨后、或毗邻腔静脉、心脏等,为超声引导的盲区;肝脏肿瘤毗邻肝内较大血管或胆管,距离≤10 mm;肿瘤毗邻心脏、肺、胆囊、右肾或胃肠道,距离≤10 mm[7];肿瘤凸出肝脏表面,或距肝包膜≤5 mm;④Child-Pugh A、B级;⑤根据BCLC分期为A、B期(按2017版中国《原发性肝癌诊疗规范》为Ⅰ、Ⅱ期)。
1.1.2 排除标准 ①合并门静脉癌栓;②肝外转移;③合并TACE禁忌证(如总胆红素>3 μmol/L、AST/ALT>5倍正常上限、白蛋白<28 g/L、白细胞计数<2.0×109/L、血小板计数<50×109/L、凝血酶原时间较正常值延长6 s以上、肌酐>115 μmol/L、HCC范围超过肝脏体积的70%、高流量肝内动静脉分流);本研究排除多病灶患者。
1.1.3 一般资料 回顾性分析2013年4月至2017年5月在我中心行TACE联合RFA治疗98例肝癌病例,其中常规部位病灶69枚、特殊部位病灶29枚(膈顶6枚;血管旁5枚,胆管旁1枚;肋骨后2枚;包膜下10枚;胆囊旁2枚;胃肠道旁3枚)(表1)。对所有符合入组标准的患者及家属详细解释TACE联合RFA治疗的获益及可能出现的不良事件,并需其明确放弃或拒绝外科手术,签署知情同意书。
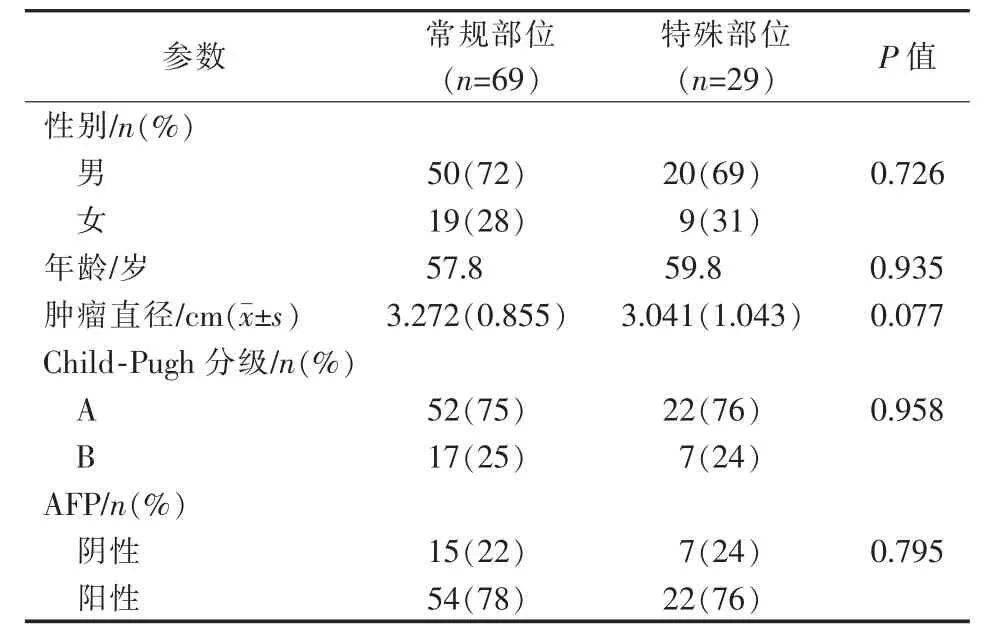
表1 患者一般资料
1.2 方法
1.2.1 治疗前检查及评估 术前详细了解所有患者的临床资料。术前行实验室检查包括血常规、肝肾功能、出凝血功能、AFP及影像学检查(增强CT或MRI)。确定患者符合TACE联合RFA适应证。
1.2.2 消融参数 影像引导设备:超声仪(百胜,Esaote MyLabClassC)、DSA(西门子数字减影成像系统)配套DynaCT;RFA系统:迈德医疗S-1500射频消融仪及配套消融电极针(规格21-A63271)。
1.2.3 TACE 局麻后,穿刺股动脉,为尽可能明确所有肿瘤供血动脉,使用4~5 F RH导管(Cordis)分别行腹腔干、肠系膜上动脉、胃左动脉、双侧膈动脉造影。明确肿瘤供血动脉后,使用2.7 F微导管(ASAHI)超选择靶血管。 将(THP 10~20 mg)与(5~10 mL)超液化碘油混合成乳剂,根据肿瘤供血情况决定化疗药物及碘油用量。X线透视下,经微导管缓慢注入化疗药及碘油乳剂,直至靶血管血流瘀滞,再用合适直径的栓塞微球(Embosphere)或明胶海绵颗粒补充栓塞。TACE后即刻行RFA治疗。
1.2.4 常规位置病灶RFA治疗 根据病灶位置选择体表穿刺点,根据病灶大小选择消融针大小,局麻后,超声引导下,RFA针穿刺入肿瘤中心,开针,超声确定针尖覆盖完整病灶,选择功率控制模式,常规设定功率50~80 W,切断温度设定120℃,最长消融时间设定为20 min。
1.2.5 特殊位置病灶RFA治疗
1.2.5.1 膈顶病灶:常规超声引导,会受肺部气体干扰,常规CT引导需经过肺,可能引起严重气胸,故先行TACE标记,透视下斜进针,DynaCT确定布针,精准消融。(图1①~④)
1.2.5.2 大血管旁病灶:常规消融可能损伤血管或因“热沉”效应导致消融不完全,故先行TACE,阻断动脉血流,减少热沉效应,超声引导下实时监测进针,避开血管,DynaCT确定布针,防止损伤邻近血管,精准消融,消融后复造影,可见肿瘤血管染色消失。(图2①~⑤)
1.2.5.3 包膜下病灶:常规消融存在出血风险,先行TACE栓塞,标记病灶并阻断动脉血供预防出血,超声结合透视下进针,DynaCT确认针尖有无突破包膜外,精准消融。(图3①~④)
1.2.5.4 肋骨后近包膜病灶:常规超声无法探及,单纯CT引导,由于进针路径短,患者呼吸运动,造成多次反复进针,增加出血风险。故先行TACE标记病灶,同时栓塞血管减少出血风险,透视下进针,精准把握进针位置深度,DynaCT确定布针,精准消融。(图4①~④)
为了预防并发症发生,在消融胆囊窝旁病灶时,我们采用术中超声引导下注水隔离,防止胆囊损伤、破裂。在消融胃肠道旁病灶后,如有胃肠道穿孔风险,选择术后禁食48 h,合并制酸、抗感染、生长抑素治疗。
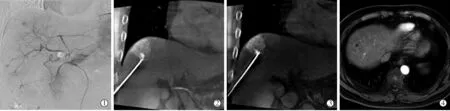
图1 近膈顶病灶消融
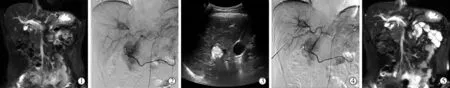
图2 大血管附近病灶消融
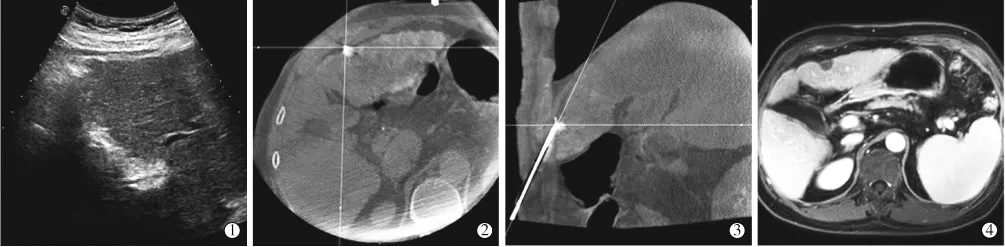
图3 肝包膜下病灶消融
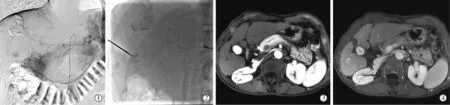
图4 肋骨后病灶消融
特殊治疗组联合引导方式汇总,见表2。

表2 特殊病灶治疗组引导方式汇总
1.2.6 术后处理及随访 术后24 h检测生命体征,同时进行保肝、水化、预防感染、营养支持及止痛治疗。术后3 d进行实验室检查及平扫CT,对消融程度及并发症进行评估。术后1个月复查实验室检查及增强CT或MRI,根据欧洲肝病治疗研究组织(EASL)的标准,消融灶没有强化,则为肿瘤完全坏死;消融灶还可见强化,则为局部坏死。局部坏死的病灶需要下次重复消融或采取进一步治疗措施。
1.2.7 安全性及有效性评价 分别对两组患者的生存率、中位生存期(mOS)、中位肿瘤无进展生存率(mPFS)及相关治疗事件进行评价。生存期定义为:自患者接受治疗至患者死亡或至随访期结束的时间间隔。
1.3 统计分析
所有统计采用SPSS 22.0统计分析软件。对于分类变量采用独立样本或配对样本t检验进行分析;计数资料用百分比表示,用卡方检验进行比较。并对患者术后PFS及OS进行统计,制作Kaplan-Meier曲线,行Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 疗效评估
术后随访1~36个月,平均16个月。术后1个月,常规病灶消融组及特殊病灶消融组的肿瘤完全坏死率分别为 60 枚(87%)及 27 枚(93%),(P=0.499)。 术后1年,常规病灶消融组及特殊病灶消融组的肿瘤PFS分别为76%和72.9%,生存率为89.3%和90.9%。常规病灶消融组及特殊病灶消融组的mPFS分别为18.6 个月及 20.1 个月,(P=0.832)(图 5)。常规病灶消融组及特殊病灶消融组的mOS分别为25.4个月及 24.9 个月,(P=0.896)(图 6)。

图5 常规病灶消融组和特殊病灶消融组的中位PFS分别为18.6个月和20.1个月,(P=0.832)
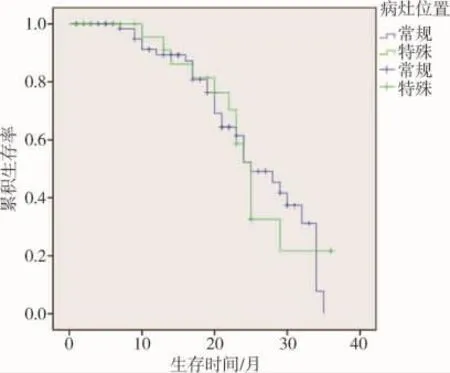
图6 常规病灶消融组和特殊病灶消融组的中位OS分别为25.4个月和24.9个月,(P=0.896)
2.2 安全性评估
所有患者均成功接受TACE联合RFA治疗,手术成功率100%。出现并发症4例,其中:肝包膜下出血1例(为特殊部位治疗组),胸腔积液2例(常规部位及特殊部位治疗组各1例),包膜下出血患者,术后常规肝动脉造影可见少量对比剂外溢,未经特殊处理,10 min后再次造影,未见明显对比剂外溢,患者生命体征平稳,提示出血血管自行闭塞;胸腔积液患者,术后予常规对症治疗,未行胸腔穿刺引流,均于术后1周内自行缓解。两组患者均无严重治疗相关不良事件发生。术后消融及栓塞综合征(发热、腹痛、呕吐)发生率,常规病灶消融组为24例(34.8%),特殊病灶消融组为11例(37.9%),两组患者无统计学差异(P=0.819)。特殊部位治疗组术后短期肝功能轻度损害,1个月内恢复至正常范围内。(表3)
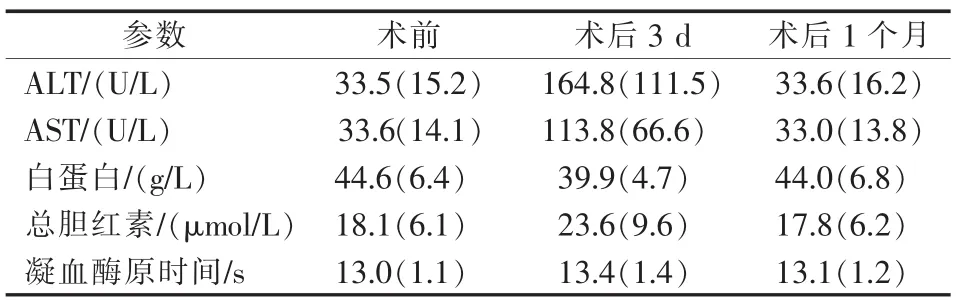
表3 特殊病灶治疗组术前及术后肝功能情况
3 讨论
目前,对于病灶≤5 cm,肝功能ChildA-B级,BCLC A-B期的肝癌患者,外科手术依旧是治疗的首选。但是,对于初诊的肝癌患者,只有约20%适合外科手术[8]。近年来,随着介入诊疗设备技术快速发展,多种影像引导技术将TACE与RFA完美结合,成功弥补外科手术的缺陷,成为越来越热门的研究课题。
早期研究显示,邻近大血管的肿瘤并不适合行单纯RFA治疗,不但可能造成血管损伤,尤其是门脉、胆管损伤后果特别严重,而且由于 “heat sink”效应,导致肿瘤消融效果不佳[9]。但是,邻近大血管同样是手术治疗的难点,切除范围扩大容易损伤血管,导致不可逆的肝功能衰竭,切除范围小,术后极易复发转移,因此,这部分患者临床迫切需要一种更好的治疗方式。于是,有学者提出,先行TACE再行RFA治疗,可以降低邻近大血管旁的肝癌病灶消融过程中的热沉效应,提高肿瘤坏死率[10-11]。因此,对于这部分患者,我们在消融治疗前先行TACE治疗。然而,一些邻近重要脏器的肝脏肿瘤,(如靠近心脏、肺、胆囊、胃肠道的肝癌病灶),在某些情况下不能行RFA治疗。这时,良好的引导技术和优异的治疗策略可以将过去消融治疗的禁忌转为可能。Chen等[12]报道了249例,超声引导下RFA治疗特殊部位肝癌,其中110例邻近膈顶、49例邻近胆囊、36例肝包膜下,54例邻近胃肠道、分别采用不同进针策略进行消融,他们的研究结果显示,肿瘤完全坏死率达到91.6%。除此之外,部分肿瘤病灶,在常规超声、CT平扫上呈阴性,故单纯影像引导困难,可以先行TACE进行标记后再在超声、CT或透视引导下行RFA,同样可以达到很好的疗效。对于部分特殊部位病灶,如膈顶或肋骨后病灶,超声、及CT平扫引导困难,甚至可能损伤肺部引起气胸,或因反复穿刺引起肿瘤破裂出血,这部分病灶,透视下进针也是不错的选择。Kim等[13]对比了47例外科手术切除病例与37例TACE联合RFA病例,提示对于单发2~5 cm肝脏肿瘤,TACE联合RFA与手术切除疗效相当。因此,综合上述的研究,并参考既往文献提出的组合方案概念[14],本中心提出应用TACE联合超声、透视、DynaCT等多种影像技术,融合引导精准消融特殊部位肝癌。
消融治疗前TACE,不但可以标记肿瘤,阻断血供,预防出血,还能杀伤肿瘤,延长肿瘤进展时间,预防复发[15],再根据患者实际情况选择引导方式,最后当针尖到位并开针后,均建议行DynaCT确定布针情况,排除可能的风险,避免由于超声经验缺乏导致的误消融,真正达到精准消融。同时,DynaCT作为消融的引导方式,与常规CT相比,可以在TACE后伺机立即实施,患者避免搬动、等待、多次麻醉等情况,真正做到同步完成。
通过TACE联合多影像引导技术,我们29例患者均成功实施了特殊部位肝癌的精准消融。安全性方面,特殊部位病灶组术后3 d肝功能轻度损害,术后1个月均能达到正常范围。同时特殊部位病灶组,包膜下出血、胸腔积液等并发症发生率较低,且并发症较轻,没有治疗相关死亡。疗效方面,术后1个月随访,肿瘤完全坏死27例(93%),与Teratani等[16]报道的疗效相仿,优于郭永建等[17]报道结果。随访可以发现,常规与特殊部位病灶组,肿瘤mPFS没有明显差异,术后1年,肿瘤无进展生存率接近80%,与常规外科手术基本相当。同时,在长期实践过程中,我们同意 Kelogrigoris 等[18]的观点,射频消融治疗,尤其是超声或透视引导下的消融治疗,其疗效与治疗实施者经验、熟练程度密切相关。因此,熟练掌握TACE、RFA及多种影像引导方式,可以显著降低并发症发生,减少患者住院时间及费用,对患者肝功能损害更小,使预后更好,也能为更多无法或拒绝手术的肝癌患者带来希望。TACE联合多影像引导技术精准射频消融特殊部位肝细胞肝癌,可行、安全、有效。

