MDCK细胞微载体培养条件优化研究
马启财 武文莉 马富龙 潘和平
(西北民族大学生命科学与工程学院,兰州 730030)
Madin等[1]在 1958年 从 美 国Cocker Spaniel母曲架犬的肾脏组织中分离出MDCK细胞,经培育建立了MDCK细胞系(MDCK Cell Lines),并发现MDCK细胞不仅能以贴壁(Anchorage-Dependent Culture)方式培养,还能连续传代[2-3]。MDCK细胞易培养,对多种不同亚型的流感病毒株敏感。由于MDCK细胞病毒感染率高、增殖快和不易变异等优点[4-5],是最适合甲、乙型流感病毒疫苗生产的3种细胞系之一[6],且广泛用于多种病毒的扩增和纯化等[7]。
近年流感发病频率日益增加,给各个国家和地区造成严重的经济损失,进一步提高疫苗生产水平和质量,是现在急需解决的重要问题[8]。大量研究表明,细胞生长的最终密度分别与细胞的接种密度、搅拌转速及方式和微载体浓度有关[9]。Cytodex1微载体是培养细胞的优良载体之一,与其他细胞培养方式相比较,Cytodex1载体培养具有提高产量、降低成本和减少污染等优点[10]。本实验通过改变影响MDCK细胞微载体培养条件,在250 mL的悬浮培养瓶微载体培养MDCK细胞实验细胞接种量、微载体浓度和搅拌转速对细胞生长的影响,得到最佳的微载体培养条件,旨在为后续的MDCK细胞微载体培养提供数据参考。
1 材料与方法
1.1 材料
1.1.1 细胞株与微载体 微载体Cytodex1(美国通用电气医疗集团生命科学部,GE Healthcare,批号:10225244);MDCK细胞系(从ATCC引进,甘肃省动物工程技术研究中心保存)。
1.1.2 试剂与仪器 新生牛血清(兰州民海生物工程有限公司,批号:20160811);0.25%胰酶(兰州百灵生物技术有限公司,批号:20161124);DMEM高糖培养基(兰州百灵生物技术有限公司,批号:20161228);无Ca2+、Mg2+PBS缓冲液由甘肃省动物细胞工程技术研究中心自配;结晶紫细胞裂解液由甘肃省动物细胞工程技术研究中心自配;立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);恒温水浴锅(北京科伟永兴仪器有限公司);CO2培养箱(Thermo Fisher,参数设置:37℃,5%CO2);250 mL悬浮培养瓶(兰州百灵塑料制品有限公司);电热恒温鼓风干燥箱(上海精宏实验设备有限公司);磁力搅拌器(英国Techne MCS-104S);倒置相差显微镜(日本 OLYMPUS,CKX41+DP72);普通显微镜(日本 Olympus,CX21)。
1.2 方法
1.2.1 MDCK细胞复苏 MDCK细胞复苏利用慢冻快融原则[11],先从液氮罐中取出冻存管,浸入37℃温水中,并不时摇动令其快速融化。然后从37℃水浴中取出冻存管,吸管吸出细胞悬液,加到离心管并滴加10倍以上培养液,混匀后离心1 000 r/min,5 min后弃上清,加入含10%新生牛血清的DMEM培养液重悬细胞,计数,调整细胞密度,最后接种于T75的培养瓶中,放在37℃、5%的CO2培养箱中静置培养;次日观察,更换一次培养液,继续培养。等细胞长成致密单层后,就可传代培养[12-13]。
1.2.2 MDCK细胞传代及扩大培养 将长成单层的MDCK细胞从CO2培养箱中取出,在超净工作台上操作,倒掉T75培养瓶中的培养液,加入少量的胰酶。倒置镜下观察被消化的细胞,若细胞变圆,相互之间不再连接后,立即将T75培养瓶中的胰酶倒掉,加入3-5 mL新鲜培养液,吹打成细胞悬液。然后将细胞悬液吸出后,加到另一个T75的培养瓶中并向每个T75瓶中分别加入培养液,盖好瓶塞,放回CO2培养箱中,继续进行培养。细胞传代培养2-3 d,细胞分裂增殖旺盛,是活力最好时期,称为对数生长期,此时适宜对细胞进行扩大培养[14]。扩大培养后,细胞数量扩大到一定密度就可接种,进行下一步实验[15-16]。
1.2.3 不同变量对微载体培养MDCK细胞增殖生长的影响
1.2.3.1 细胞接种量 将扩大培养的MDCK细胞消化,制成细胞悬液,进行接种实验,将剩余细胞悬液继续扩大培养,进行下一步不同搅拌速率实验。实验通过对不同细胞接种量在搅拌转速(45 r/min)和微载体浓度(2 g/L)一定的情况下,得到最佳细胞接种量,共设计了6组实验,分别是5 个/球、10 个 /球、15 个 /球、20 个 /球、25 个 /球和 30 个 /球,用含有10%的NBS的DMEM培养基接种在悬浮瓶中,悬浮瓶培养的体积为200 mL,温度为37℃。每隔24 h取样观察,进行细胞计数,最终得到最佳细胞接种量。
1.2.3.2 搅拌速率 将扩大培养的MDCK细胞消化,制成细胞悬液,进行接种实验,将剩余的细胞悬液继续扩大培养,进行下一步的不同微载体浓度的实验。实验按照确定的细胞接种量和微载体浓度(2 g/L)一定的情况下,得到最佳搅拌转速,共设计了4组实验,分别是35 r/min、40 r/min、45 r/min和50 r/min,用含有10%的NBS的DMEM培养基接种在悬浮瓶中,培养的体积为200 mL,温度为37℃。每隔24 h取样观察,进行细胞计数,最终确定最佳搅拌转速。
1.2.3.3 微载体浓度 将扩大培养的MDCK细胞消化,制成细胞悬液,进行接种实验。按照确定的最佳搅拌转速和细胞接种量,接种到5组微载体浓度不同的悬液中培养。微载体浓度分别是1 g/L、2 g/L、3 g/L、4 g/L和5 g/L。用含有10%的NBS的DMEM培养基接种在悬浮瓶中,培养体积为200 mL,温度为37℃。每隔24 h取样观察,进行细胞计数,最终确定微载体浓度。
1.2.4 取样计数 细胞数利用血球计数板在显微镜下直接计数[17-18]。实验数据以x-±s表示,采用Origin75软件作图进行分析。
2 结果
2.1 MDCK细胞扩大培养
细胞传代培养三代后(图1),在显微镜下可以观察到,细胞贴壁后形态良好,细胞之间相互衔接或紧密排列,生长旺盛。经消化后,制成悬液,加至T150的培养瓶中并向每个T150瓶中分别加入培养液,进行扩大培养。
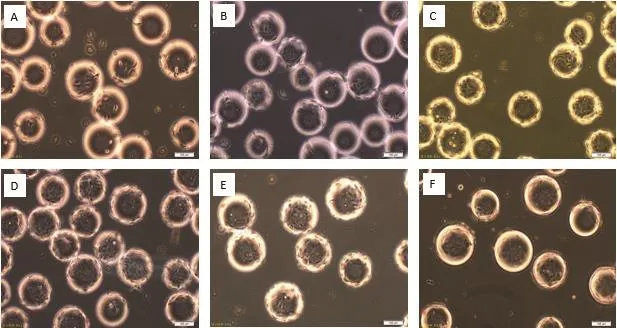
图2 MDCK细胞微载体培养不同细胞接种量24 h的细胞生长状态
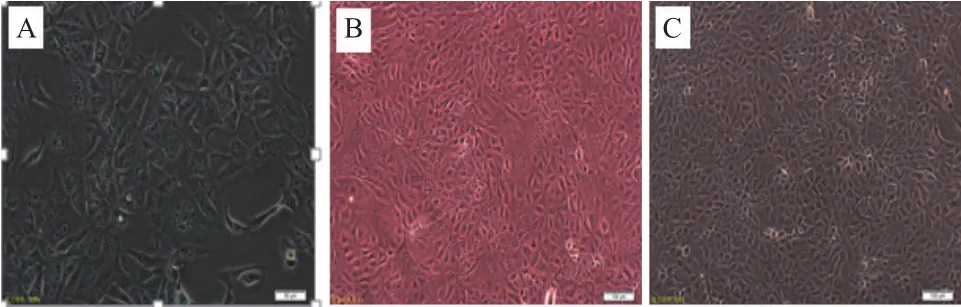
图1 MDCK细胞传代培养细胞形态
2.2 最佳细胞接种量
通过设计6组不同细胞接种量在搅拌转速(45 r/min)和微载体浓度(2 g/L)一定的情况下,确定最佳细胞接种量,每隔24 h取样 观察、换液和细胞计数,检测结果显示,在6组不同细胞微载体培养MDCK细胞结果表明细胞在微载体上均可贴附和铺展,在显微镜下可见MDCK细胞在微载体Cytodex1表面呈多层生长(图2-3),经5-6 d培养后20 个/球微载体周围细胞量的细胞密度可达15.6×106个/mL(图 4)。
2.3 最佳搅拌转速
通过4组搅拌转速(35 r/min、40 r/min、45 r/min和50 r/min)在微载体浓度(2 g/L)和细胞接种量(20个/球)一定的情况下,确定最佳搅拌转速,每隔24 h取样观察、换液和细胞计数。检测结果(图5)显示,在显微镜下可见细胞在微载体Cytodex1表面呈多层生长,在搅拌转速不同时,细胞的生长密度不同。经4-5 d培养后,45 r/min的细胞密度较高,可达 15.1×106个 /mL(图 6)。
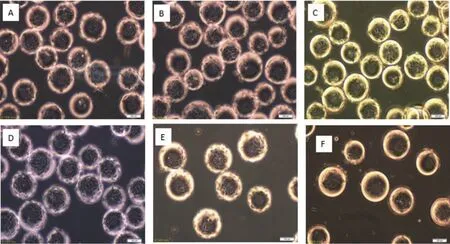
图3 MDCK细胞微载体培养不同细胞接种量72 h的细胞生长状态
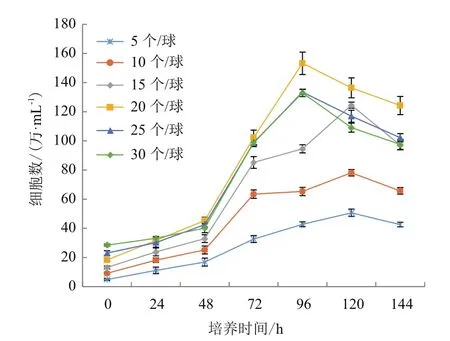
图4 不同细胞接种量对微载体培养影响的折线图
2.4 最佳微载体浓度
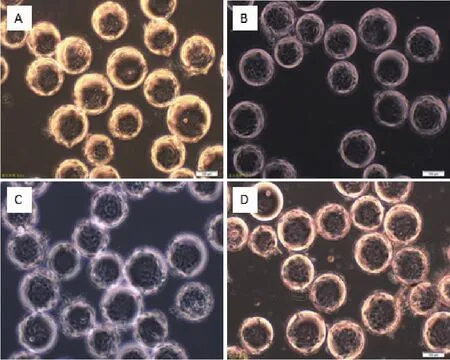
图5 MDCK细胞微载体培养48 h不同搅拌转速生长状态
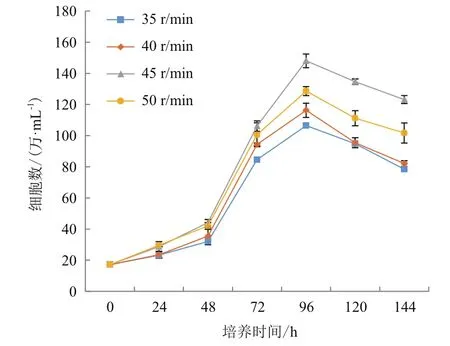
图6 不同搅拌转速对微载体培养影响的折线图
通过设计5组微载体不同浓度在搅拌转速(45 r/min)和细胞接种量(20 个/球)一定的情况下,确定最佳微载体浓度,每隔24 h取样观察、换液和细胞计数,微载体浓度不同时,细胞也可在微载体上贴附和铺展(图7-8),检测结果(图9)表明,在搅拌转速(45 r/min)和细胞接种量(20 个/球)时,2 g/L的微载体浓度上细胞密度较大,最大可达15.2×106个 /mL。
3 讨论
近年来,流感、禽流感等病毒的肆虐导致世界范围内对流感疫苗的需求量增加,而产能相对较低的动物细胞培养模式已经不能满足需求[21]。因此,为了解决病毒疫苗大规模生产与细胞培养产能较低间的矛盾,微载体培养细胞技术成为解决这一矛盾的有效手段。细胞量是考察细胞培养方法优劣的重要指标之一[2-4]。然而,目前大多数的研究仅提出微载体培养MDCK细胞可以达到较高的细胞密度[22]或发现微载体浓度、搅拌转速和细胞接种量限制细胞增殖的因素之一[8],而对优化MDCK细胞培养技术鲜少研究。据此,本研究通过设置不同细胞接种量、搅拌转速和微载体浓度3个条件,研究了它们对MDCK细胞量的影响。
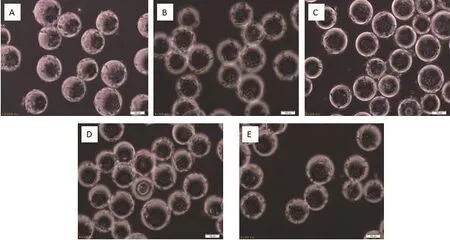
图7 MDCK细胞微载体培养不同微载体浓度生长状态24 h
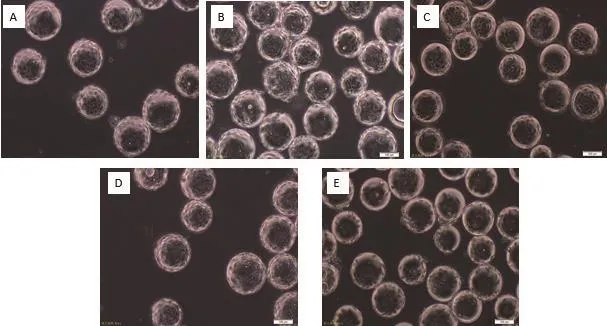
图8 MDCK细胞微载体培养不同载体浓度生长状态48 h
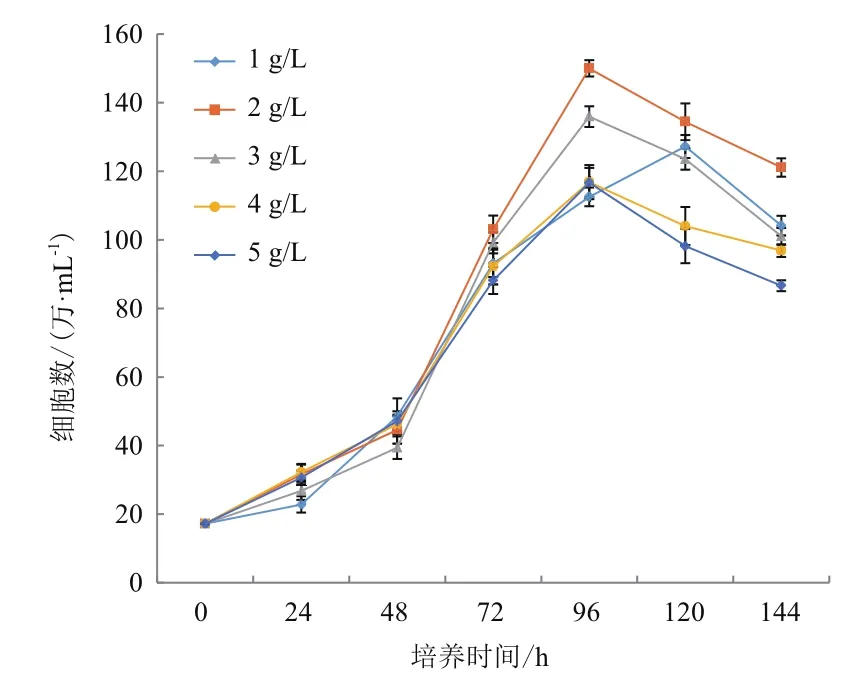
图9 不同微载体浓度对微载体培养影响的折线图
合适的微载体浓度、搅拌转速和细胞接种量是增加影响MDCK细胞量,提高为载体利用效率,实现细胞大规模生产的有效手段[8,22-23]。研究表明,在设置6个不同的细胞接种量条件下,经过5-6 d的培养后,在20 个/球微载体中发现其周围细胞量的细胞量最多,密度可达15.6×106个/mL。这表明细胞接种量并不是越多越好,在相同的培养条件下,过多的细胞接种量会导致快速的消耗培养基中营养物质和细胞代谢产生的有害物质的不断积累,进而影响细胞的增殖,对细胞产生抑制作用。一旦细胞密度增大,导致营养物质的耗竭,细胞就无法生长,不能达到理论应得的细胞密度,会造成微载体的浪费。与之相反,若是细胞接种量过少,则会导致微载体空球情况增加,其原因是过少的细胞接种量与微载体的比例过低,不利于初期细胞与微载体间发生接触和黏附,这与陈以衡等[23]对ST细胞培养结果一致。不同的搅拌转速会影响MDCK细胞量。本研究分别采用4种搅拌速度进行实验,结果表明,在搅拌转速不同时,细胞的生长密度不同,且发现在较低搅拌速度下(即本实验中45 r/min)MDCK细胞密度较高,这与龚迪等[8]认为在细胞微载体培养初期使用较低转速能够使细胞分布更均匀,从而避免细胞在载体某处聚集过多上的研究结果相一致。通过分析不同微载体浓度对微载体培养影响,研究结果表明,MDCK细胞生长曲线呈“S”型,在接种量和搅拌速度相同的条件下,随着微载体浓度的增加,MDCK细胞量呈现先增加后降低的趋势,这与陈以衡等[23]研究结果一致,在这个过程中细胞经历了缓慢生长期、对数生长期、生长平台期和衰退期。在48 h后,细胞进入对数生长期,细胞最大密度可达16.2×106个/mL。相应的,细胞接种量也有类似的现象,高的细胞接种量在微载体浓度和搅拌转速一定的情况下,也会对细胞的大密度生长造成影响,而且平台期较短,不利于后期的实验。
4 结论
细胞增殖过程中产生的抑制物和培养基营养物的含量都会对细胞生长造成一定的影响,只有细胞生长条件较好,才会最大程度的使细胞增殖,并达到预期效果,即细胞接种量在20 个/球,微载体浓度在2 g/L和搅拌转速在45 r/min时,细胞增殖密度最大,而且有较长的平台期,有利于后期实验的进行。

