蜈蚣草内生及根际砷还原菌的表征
王 姣,田海霞,和文祥
(西北农林科技大学资源环境学院,农业部西北植物营养与农业环境重点实验室,陕西 杨凌 712100)
砷(As)是一种有毒的类金属,可通过自然环境作用或人类活动释放到环境中[1-2],并对人类健康造成极大的威胁[3]。其中无机砷主要以五价砷[As(V)]和三价砷[As(Ⅲ)][4-5]形态存在,二者生物毒性相差60~80倍。由于环境条件的变化,会导致土壤中砷形态的转化,此过程极有可能受到砷还原菌的调控。国内外学者对砷还原菌开展了研究工作,如Krumova等[6]从5个土样中分离出27株变形菌门(Proteobacteria)的抗砷菌,兼具氧化和还原能力;Chang等[7]从砷污染土壤中分离出Citrobacter sp.NC-1,24 h内可将固相中的As(V)还原为具有更高迁移性的As(Ⅲ),与硫化物或亚铁离子结合从而降低其移动性。目前公认的砷还原机制有两种,包括呼吸和解毒机制[8]。As(V)进入好氧砷还原菌后,在细胞内被还原为As(Ⅲ)并排出体外,实现砷解毒作用。这一过程由染色体[9]或质粒[10]编码的ars操纵子调控,具体包括3~5个基因(arsR,-D,-A,-B,与-C)[11]。研究表明,好氧砷还原菌可以控制砷的迁移转化,促进沉积物中砷的释放[7]。因此,好氧砷还原菌的多样性及其在砷地球化学循环中的重要调控作用受到了广泛关注。
对砷而言,蜈蚣草是一种理想的修复植物。但目前关于蜈蚣草砷富集研究主要集中于体内砷还原酶及砷转运机制[12],对微生物在蜈蚣草砷富集过程中的作用研究尚处于初始阶段。已有研究表明,微生物在促进蜈蚣草砷富集能力的同时,还可以提高蜈蚣草的生物量。Ghosh等[13]将根际菌与蜈蚣草共培养,提高了蜈蚣草对砷的摄入量(18.1~35.3 mg·kg-1),并且蜈蚣草的生物量有所增加[1.5~3.4 g(dw)]。Yang等[14]也有类似的发现,在添加砷还原菌后,蜈蚣草的生物量增加了53%,砷吸收量增加了44%。Han等[15]在加入抗砷菌之后,蜈蚣草的砷和磷吸收量分别增加了47%和69%,且生物量增加了20%~74%。蜈蚣草体内及根际土壤中分布着大量的抗砷及砷还原菌,但是目前相关研究较少,且分离出的抗砷菌种类十分有限。
本文从蜈蚣草体内及根际土壤中分离抗砷菌,以期不断扩充砷还原菌的种类,加强对砷还原菌群分布的认识,并对其砷还原效率和机制进行表征,进一步探明它们在抗砷及砷的地球化学循环中的重要作用,为砷污染土壤中的微生物-植物联合修复提供理论依据。
1 材料与方法
1.1 供试材料
蜈蚣草及其根际土壤采自湖南石门地区的雄黄尾砂矿区(29°38′55″N,111°01′46″E),其中蜈蚣草连根采集装入样品袋;振荡除去粘附根系的松散土壤后,刮下紧紧粘附在根系的土壤作为根际土壤,保存于塑封袋中[16];用大量自来水冲洗附着在植物样品表面的尘土,最后用去离子水冲洗干净备用。所有样品存储于4℃冰箱保存备用。
1.2 抗砷菌的筛选和鉴定
1.2.1 抗砷菌的筛选
本试验选用4种培养基,分别为含20 mmol·L-1砷酸钠的寡营养培养基(BCM和YCM)与富营养培养基(TYEG和BPM),具体成分见表1。蜈蚣草内生抗砷菌的分离方法如下:称取3 g植物样品,移入超净工作台后,用75%酒精消毒处理,并用手术刀剪碎至5 mm片段,充分研磨后[17],再分别加入30 mL的4种培养基。
筛选根际土壤中抗砷菌时,称3 g土样分别加入30 mL的4种培养基。两类菌均采取如下两种培养方法。直接稀释法:将混合培养物充分振荡混匀后取1 mL液体进行稀释,吸取不同稀释度的100 μL稀释液进行平板涂布。驯化法:将上述混合物于30℃、150 r·min-1下振荡培养12 h,取样品3 mL再次转接入相同的无菌培养基中,重复3次后进行平板涂布。通过划线培养挑取单菌落,再转接入相应的培养基进行二次划线培养,挑取的单菌落保存至含30%甘油的培养基中,置于-80℃冰箱备用。
1.2.2 抗砷菌的16S rRNA鉴定
利用LB(Luria-Bertani)液体培养基对保存菌株进行活化培养,10 000 r·min-1下离心10 min后收集菌体。采用细菌基因组试剂盒(Omega,美国)提取细菌总DNA后,PCR扩增仪(Eppendorf,德国)扩增各菌株16S rRNA序列。所用引物为27F(5′-AGAGTT⁃GATCCTGGCTCAG-3′)和 1492R(5′-TACGGT⁃TACCTTTTACGACTT-3′),随后1×TAE-1%的琼脂糖凝胶电泳分离PCR产物。胶回收试剂盒(Omega,美国)回收PCR产物后,按常规步骤克隆后由擎科公司(北京,中国)进行DNA测序,利用NCBI的BlastN程序进行序列比对,确定鉴定结果。
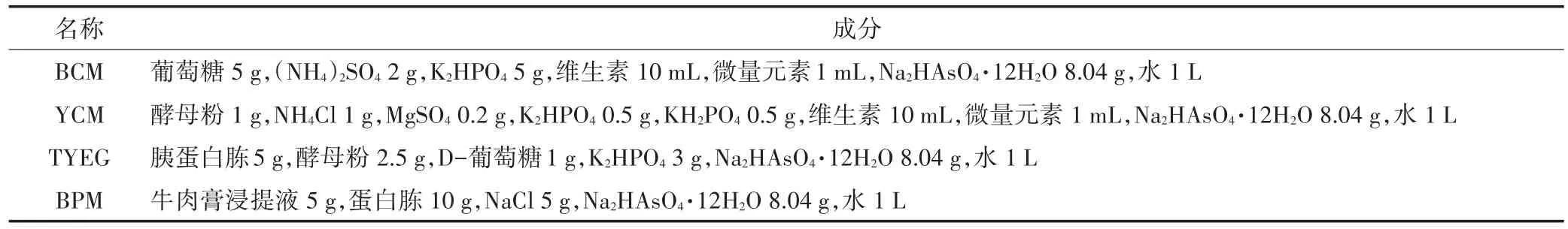
表1 分离抗砷菌的培养基配方Table 1 The component of four mediums used in the isolation experiment
1.3 抗砷能力及还原基因鉴定
1.3.1 抗砷菌的As(Ⅴ)与As(Ⅲ)抗性
本试验采用最大生长抑制浓度(Minimum inhibi⁃tory concentration,简称MIC)来表征菌株的砷抗性[7]。具体方法如下:利用LB液体培养基对保存菌株进行活化。同时配制50 mL含砷的LB液体培养基,As(Ⅴ)和 As(Ⅲ)的浓度分别为 0~500 mmol·L-1与 0~50 mmol·L-1。将对数生长期的菌液100 μL接入上述含砷培养基中,于150 r·min-1、30 ℃条件下培养48 h,利用紫外分光光度计(HACH DR2800,美国)测定其OD600。
1.3.2 砷还原基因(arsB,arsC)鉴定
将保存菌株利用LB液体培养基活化培养至对数期后,离心收集菌体。用细菌基因组试剂盒(Omega,美国)提取其DNA,采用表2中引物扩增目的基因片段。阳性PCR产物采用胶回收试剂盒(Omega,美国)回收,按常规步骤克隆后由擎科公司(北京,中国)进行DNA测序,利用NCBI的BlastN程序进行序列比对。
1.4 砷还原率及累积率测定
将保藏菌液接种于LB液体培养基活化培养至对数期后,取100 μL菌液于含1 mmol·L-1As(Ⅴ)的LB培养基中,150 r·min-1、30 ℃下培养24 h后,取1 mL混合培养液于5000 r·min-1离心5 min,收集上清液。同时设置无菌处理为对照。用高效液相色谱-原子荧光联用仪(HPLC-AFS)(吉天,中国)测定上清液中As(Ⅴ)与As(Ⅲ)的浓度,计算菌株的砷还原率与累积率。
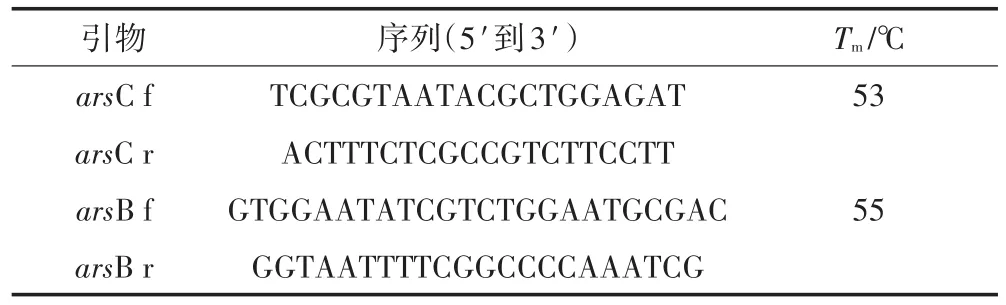
表2 arsBC引物序列[18]Table 2 The primer sequences used in the detection of arsBC genes
还原率=(CAs(Ⅲ)/CT-As)×100%
累积率=(C0-CT-As/C0)×100%
式中:C0为初始砷浓度;CAs(Ⅲ)为加入菌株反应24 h后的As(Ⅲ)浓度;CT-As为加入菌株反应24 h后的总砷浓度。
1.5 系统发育树构建
通过NCBI查询并获得构建发育树所需的参考序列。将所有序列通过Clustal X2程序编辑成相同片段长度后,利用MEGA6.0软件中的Neighbor_Joining方法构建系统发育树[19]。本研究所得DNA序列已全部提交至GenBank数据库,序列号分别为MG759526~MG759548(16S rRNA);MG765306~MG765326(arsC)及MG765327~MG765328(arsB)。
2 结果与分析
2.1 砷抗性菌分离和鉴定
从蜈蚣草体内及根际土壤共筛选分离到23株砷抗性菌,结果见表3与表4。寡培养基和富培养基中分别获得10、13株菌;驯化培养法和直接稀释法各分离出13、10株抗性菌;而且18株和5株分别分离自根际土壤和蜈蚣草体内。23株菌归属于两个门:变形菌门(Proteobacteria,其中γ-Proteobacteria,16株;α-Proteobacteria,2株)、厚壁菌门(Firmicutes,5株),涉及10个属。其中13株菌来自假单胞菌属(Pseudomo⁃nas)。

表3 23株抗砷菌的分离培养基及培养方法Table 3 The culture media and methods used for 23arsenic-resistant strains
为确定抗砷菌的分类学地位,测定其16S rRNA序列,经与NCBI数据库比对发现所有抗砷菌与已报道模式菌的同源性高达99%。并对23株抗砷菌的16S rRNA构建了系统发育树(图1),表明所有假单胞菌属(Pseudomonas sp.)的菌株同源性高,亲缘关系近,只存在种间差异;来自微小杆菌属(Exiguobacteri⁃um sp.)的两株菌S13和S17也存在类似关系。解糖假苍白杆菌(Pseudochrobactrum sp.)和土壤杆菌(Agrobacterium sp.)不同属序列之间也显示了较高的一致性,这可能是因为它们来源于相距较近的类群。
2.2 砷抗性菌的抗性、还原率和累积率
23株抗性菌对As(Ⅴ)、As(Ⅲ)的耐受浓度截然不同,其浓度范围分别为 80~150 mmol·L-1与 5~30 mmol·L-1(表5)。比较各个菌株对不同价态砷的抗性可以发现,其对As(Ⅴ)与As(Ⅲ)的抗性能力并未呈现出一致性。如菌株S4和P1对As(Ⅴ)和As(Ⅲ)抗性最高,而S16虽然可耐受30 mmol·L-1的As(Ⅲ),但其抗As(Ⅴ)能力相对较小,耐受浓度仅为80 mmol·L-1。
各菌株的砷还原及累积特性差异较大,砷还原率范围为0%~100%,砷累积率为3%~79%。其中19株抗砷菌的砷还原率均低于20%,砷累积率低于50%。仅有4株菌(Pseudomonas sp.S2、Pseudomonas sp.P3、Staphylococcus sp.S14与Agrobacterium sp.P1)同时表现出较高的砷还原率(81%~100%)与累积率(75%~79%),表明这几株菌在砷污染土壤的生物修复中具有较大的应用潜力。
2.3 砷还原基因arsBC
对23株菌的arsBC基因进行扩增,结果表明,从21株菌可扩增出arsC基因,而仅在2株菌中扩增出arsB基因。综合比较23株菌的砷抗性特征发现,arsC基因是抗砷菌中普遍存在的还原基因,但并非砷还原率及抗性的决定性因素。分别将21个arsC和2个arsB序列与GenBank中的参比序列比对,构建相应氨基酸的系统发育树(图2和图3)。结果表明,21株菌的arsC序列与已验证的砷还原酶arsC亲缘关系较近。菌株S1、S15和S6在16S rRNA结果中显示为不同属(图1),但其arsC基因的相似度高达99%,说明arsC基因在进化过程中可能保守性较高或存在相关的水平转移。而arsB的系统发育树结果发现,菌株S7和S14的arsB存在于不同分支,亲缘关系较远。

表4 23株抗砷菌16S rRNA的鉴定结果Table 4 16S rRNA identification of 23 arsenic-resistant bacteria
3 讨论
3.1 抗砷菌的多样性
本研究共筛选获得来自10个属的23株抗砷菌,其中5个属(Pseudomonas、Acinetobacter、Exiguobacteri⁃um、Bacillus与Lysinibacillus)在其他众多文献中被报道为抗砷菌[18,20-21]。不同于以往的研究中仅选用单一培养基及培养方法[22],本研究同时采用了4种培养基及2种培养方法筛选蜈蚣草体内及根际土壤抗砷菌,获得比以往研究更为丰富的菌种资源。富营养培养基(TYEG与BPM)与驯化培养法在筛选抗砷菌方面稍显优势(表3),在未来的抗砷菌分离中可优先采用。同时我们发现假单胞菌属(Pseudomonas)是抗砷菌的重要来源,这与前人研究结果相近。如Krumova等[6]在研究中分离出27株抗砷菌,其中20株都来自假单胞菌属;Ghosh等[13]从蜈蚣草根际土壤中分离到7株菌,其中5株来自假单胞菌属。而侯运楠、潘建华等[23-24]对该5个属的重金属抗性研究中,发现其对外界环境表现出极强的适应力,因此广泛拥有抗砷能力可能是这些微生物适应恶劣环境的表现之一。而针对其他5个属(Cedecea、Pseudochrobactrum、Staphylo⁃coccus、Stenotrophomonas与 Agrobacterium),则鲜有报道其为抗砷菌。
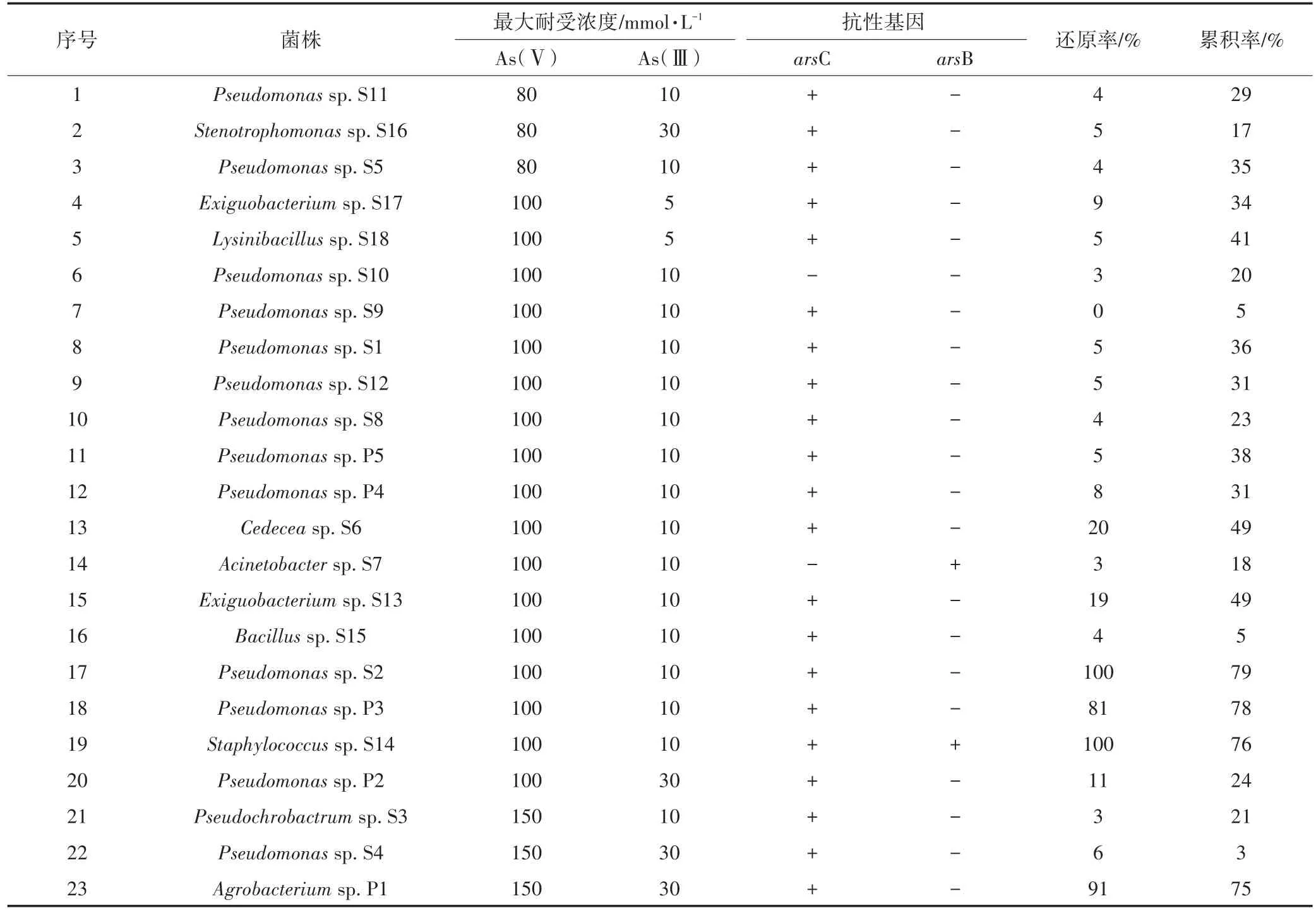
表5 抗砷菌的抗性能力、抗性基因、还原率及累积率Table 5 Arsenic resistance,ars genes,reduction and accumulation rate of resistant strains
从不同分离来源来看,本研究中18株菌分离自根际土壤,仅5株菌为蜈蚣草内生菌,而Han等[25]从蜈蚣草中分离的根际菌和内生菌数量比达到17∶20。两者差异性可能来自于筛选培养基中的砷胁迫浓度不一致。Han等[25]在分离抗砷菌的培养基中添加的砷浓度仅为75 mg·L-1,而本文中为了研究高抗性的砷还原菌,所添加的砷浓度为20 mmol·L-1。此外,分离结果显示67%的根际抗砷菌来源于变形菌门(Proteo⁃bacteria),其中61%属于γ-变形菌纲(γ-Proteobacte⁃ria),其余 33%来源于厚壁菌门(Firmicutes),这与Huang等[26]的研究结果一致,他们同样发现γ-变形菌纲是抗砷菌的主要来源(84%)。但Han等[27]的研究却发现α-变形菌纲(α-Proteobacteria)和β-变形菌纲(β-Proteobacteria)占所分离抗砷菌的80%,并且微生物群落结构组成主要取决于土壤有机质含量而非砷含量。因此,可以推断抗砷菌主要来源的差异可能由分离土壤的性质差异引起的。另一方面发现5株蜈蚣草内生菌全部来自变形菌门,这与前人研究结果也存在一定差异性,如Zhu等[28]从蜈蚣草中分离的内生菌全部归属于厚壁菌门。Rajendran等[29]发现内生菌的不同归属同样与土壤的性质密切相关,认为植物组织的内生菌可能来源于植物根际,并由此进入植物组织的内部,而植物根部长时间与土壤接触,因此土壤的性质差异也会间接影响植物内生菌的群落结构。
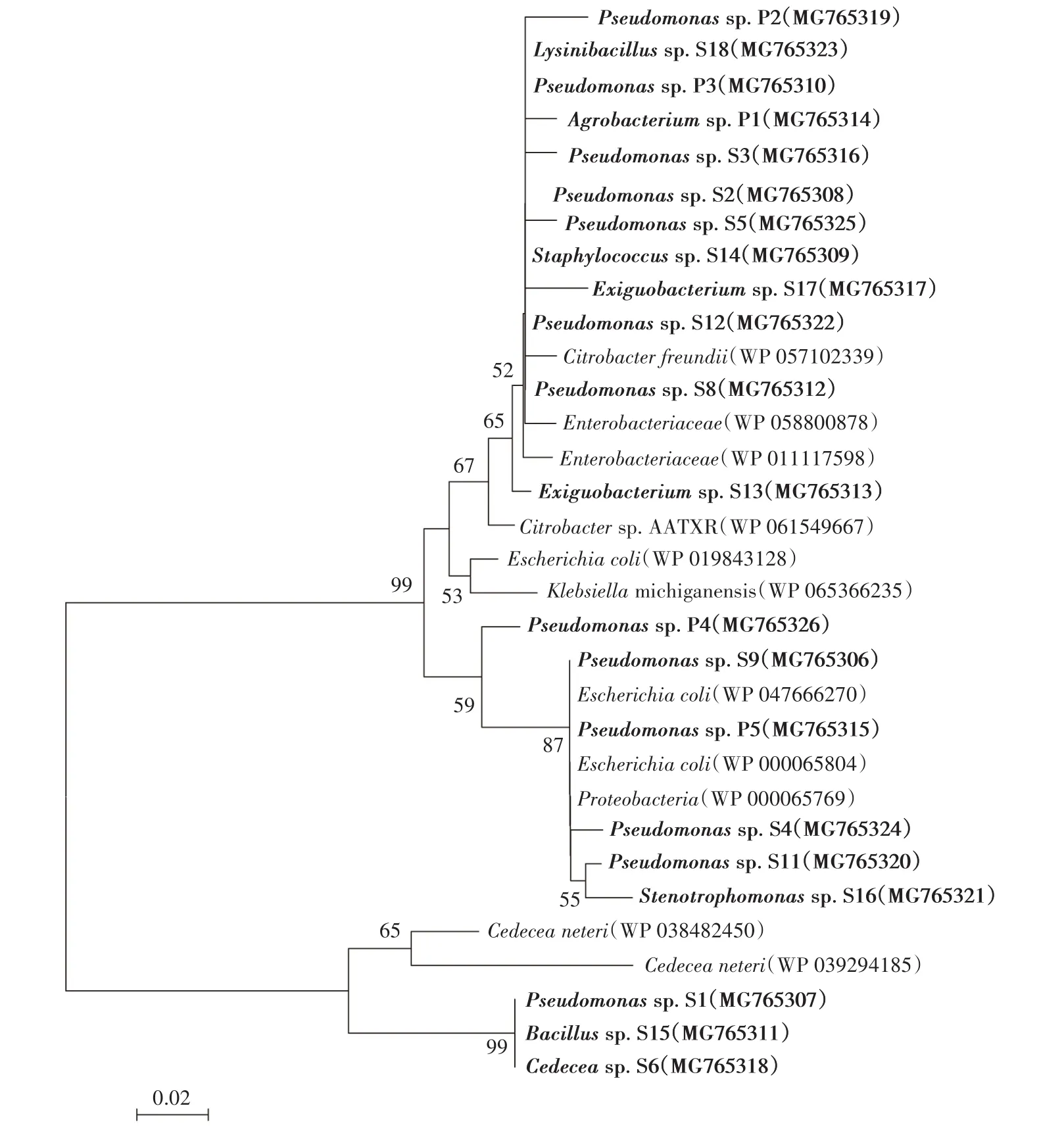
图2 arsC氨基酸序列的系统发育树Figure 2 Phylogenetic tree constructed from arsC amino acid sequences of 21 As(Ⅴ)-resistant bacteria
3.2 高效砷还原菌的砷还原及累积特性
目前对好氧砷还原菌株已有很多报道,但对高效砷累积菌株研究较少。本研究发现4株菌:Pseudomo⁃nas sp.S2、Pseudomonas sp.P3、Staphylococcus sp.S14和Agrobacterium sp.P1除了具有高效的砷还原能力,还可累积75%以上的砷(1 mmol·L-1),远高于其他砷累积菌株。Majumder等[30]发现Bacillus sp.HGH-21在25 mg·L-1的As(Ⅴ)浓度中培养3 d后的累积率仅为25.6%。Takeuchi等[31]发现M.communis在含5 mg·L-1的 As(Ⅴ)培养基中,可积累 2290 μg·g-1As。因此,基于这4株菌表现出的高累积能力,有必要深入探究其累积部位、形态及机理,以及与砷浓度、培养时间等的关系,优化其累积效率并将其应用于砷的生物修复。
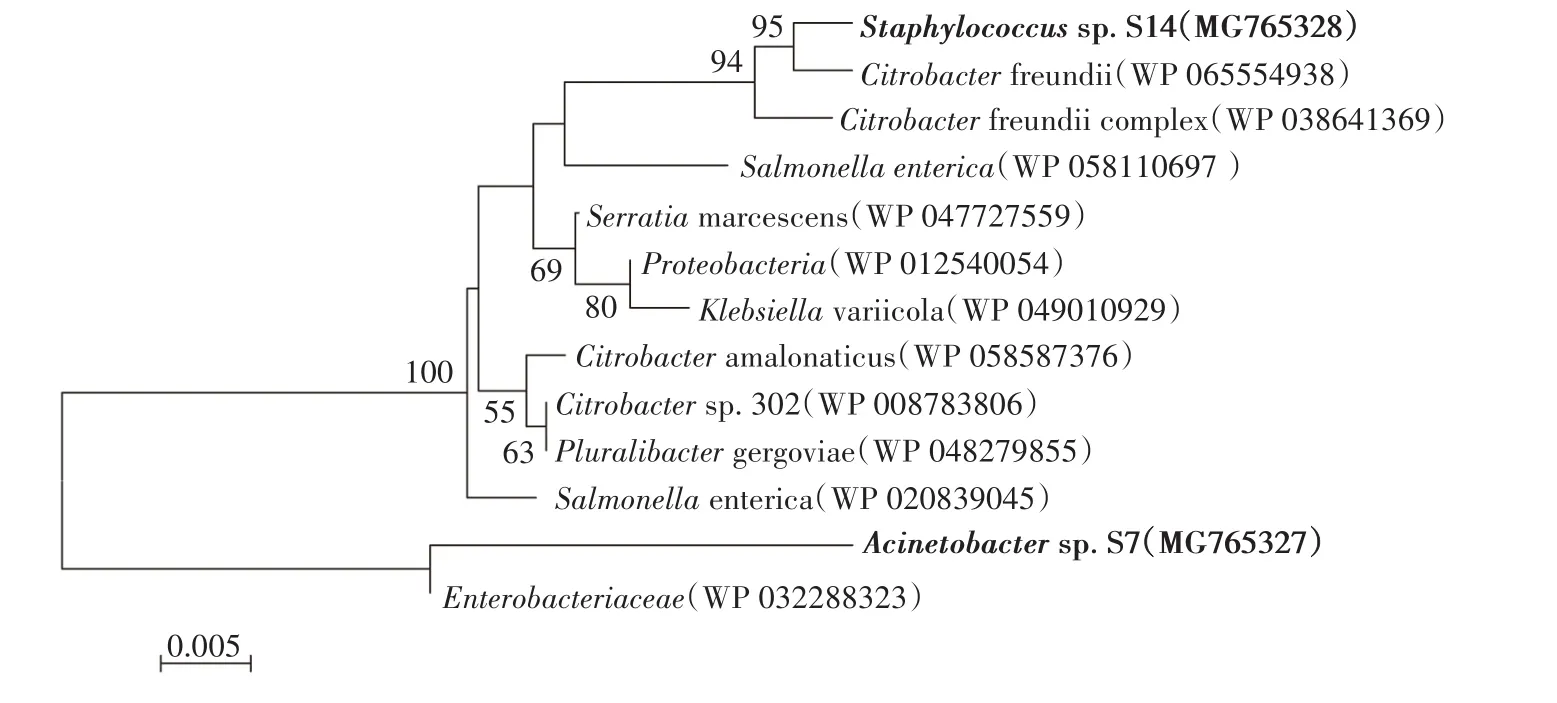
图3 arsB氨基酸序列的系统发育树Figure 3 Phylogenetic tree constructed from arsB amino acid sequences of 2 As(Ⅴ)-resistant bacteria
以往研究发现砷还原菌的还原能力与砷抗性有关。Zhu等[28]发现,在1 mmol·L-1As(Ⅴ)条件下,砷还原能力与抗性呈负相关,而在10 mmol·L-1As(Ⅴ)浓度下,砷还原能力与抗性呈显著正相关。而在本研究中,菌株砷抗性在任何浓度下都并未与砷还原率呈现显著的相关性,可能是由于这些长期处于砷污染环境中的土著细菌,为了保护细胞免于毒害,表达出了特异性蛋白并与砷结合,降低了砷的毒性,进一步增强细胞的抗砷性[12]。另外,Chen等[32]发现甘油醛-3-磷酸脱氢酶(GAPDH)和有机砷化物外排透性酶(arsJ)共同作用也可将As(V)外排。Zhu等[33]发现arsN表达出一种类似乙酰基转移酶的蛋白影响砷抗性。Bacillus sp.CDB3编码的5种蛋白(arsR3TO1O2N)也与砷抗性有关[34]。另一方面,菌株砷还原能力很大程度上并不依赖于arsC基因的表达。本研究虽在21株菌中扩增出arsC基因,但并非均表现出还原功能,因此砷还原能力与相关基因之间可能存在的关系还有待进一步探究。
4 结论
(1)本研究从蜈蚣草内及其根际土壤中共分离到23株砷抗性菌,涉及2个门,10个属,其中假单胞菌属(Pseudomonas)为优势菌群。
(2)在23株砷抗性菌中,4株菌被鉴定为高效砷还原及累积菌,砷还原率和累积率分别达到81%以上和75%以上。
(3)从21株抗砷菌中检测到arsC还原基因,而仅从2株菌中扩增出arsB基因,关于砷还原能力与基因表达之间的关系有待进一步探究。

