美洲大蠊抗肿瘤组分CⅡ-3在肿瘤化疗中的增效减毒作用研究
金家瑞 ,郭美仙,张冰清,刘光明,彭 芳,刘晓波
(大理大学药学与化学学院/云南省昆虫生物医药研发重点实验室,云南大理 671000)
恶性肿瘤目前已成为继心血管系统疾病之后严重危害人类生命健康的第二号“杀手”。目前,化疗是治疗恶性肿瘤的主要方法之一,虽然化疗药物对肿瘤细胞有较好的杀灭作用,但是化疗药物在杀灭肿瘤细胞时,也损伤了机体的正常细胞,引起严重的毒副反应,甚至患者被迫中断治疗,导致治疗失败。因此,如何减轻由化疗药物对肿瘤患者造成的严重不良反应,成为了临床急切需要解决的重大问题[1]。近年来的研究表明[2-5],中药联合化疗药物治疗肿瘤时具有协同抑制肿瘤生长,改善机体的内环境,增强肿瘤患者的免疫力,减轻毒副反应,改善肿瘤患者的生存周期和生存质量,可起到增效减毒的作用。如参芪扶正注射液、康艾注射液、复方苦参注射液等。因此,从中药中寻找对化疗药物有增效减毒作用的活性成分,已成为当前抗肿瘤药物研究的热点。美洲大蠊(Periplanetaamericana)具有补气养阴、理气散结、解毒生肌的功效,本课题组采用现代提取分离技术得到了美洲大蠊中的小分子多肽CⅡ-3[6-7]。前期研究表明,CⅡ-3可以增加外周血中白细胞的数量、增强淋巴细胞转化增殖功能及自然杀伤细胞(natural killer cell,NK)的杀伤活性,从而改善免疫力低下小鼠的免疫功能[8-9],同时CⅡ-3对肝癌、肺癌和胃癌还具有一定的抗肿瘤作用,其抑瘤率可达61.69 %[10-11]。鉴于中药在肿瘤化疗中有良好的增效减毒作用,以及CⅡ-3有改善免疫力和抗肿瘤的作用。因此,本课题组对CⅡ-3在化疗中的增效减毒作用进行探索性研究。本试验在前期研究的基础上,从联合化疗药物治疗肿瘤的角度出发,以抑瘤率、脏器指数、外周血细胞数量、血清中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、白细胞介素-2(interleukin-2,IL-2)、免疫球蛋白A(immunoglobulin A,IgA)的含量及肝脏组织中谷草转氨酶(aspartate transaminase,AST)和谷丙转氨酶(alanine aminotransferase,ALT)的活性等指标来评价CⅡ-3在肿瘤化疗中的增效减毒作用,为CⅡ-3在此领域的应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 Balb/c小鼠(SPF级,雌雄各半,18 g~22 g),湖南斯莱克景达实验动物有限公司提供,许可证编号:SYXK(滇)2011—0004。
1.1.2 药品和试剂 CⅡ-3,大理大学何正春副教授提供;注射用环磷酰胺(cyclophosphamide,CTX),山西普德药业股份有限公司产品;氯化钠注射液,贵州天地药业有限责任公司产品;参芪扶正注射液,丽珠集团利民制药厂产品。
IgA检测试剂盒、AST试剂盒、ALT试剂盒,南京建成生物工程研究所产品;TNF-α试剂盒、IL-2试剂盒,上海沪峰生物科技有限公司产品。
1.1.3 仪器设备 CO2培养箱(5510E型),美国NUAIRE公司产品;酶标分析仪(Gen5型酶标分析仪);倒置显微镜(CKX41/CKX31型),奥林巴斯(中国)有限公司产品;SCANSPEED高速低温离心机(1580MGR型),丹麦LABOGENE公司产品;全自动动物血液细胞分析仪(XFA6130型),南京普朗医疗设备有限公司产品。
1.2 方法
1.2.1 H22荷瘤模型的分组和给药 取60只Balb/c小鼠(雌雄各半)用无菌饲料及灭菌纯净水饲养,环境温度为22℃~25 ℃,湿度为50%~80%。适应环境饲养3 d后,随机分为6组,每组10只。即1组为H22模型组;2组为CTX组,3、4、5组分别为CⅡ-3高、中、低剂量与CTX联合用药组;6组为参芪扶正注射液联合CTX组;其中CⅡ-3灌胃给药高、中、低剂量分别为0.1、0.05、0.025 g/kg[8],给药容量为0.02 mL/g,CTX腹腔注射给药0.02 g/kg,阳性药参芪扶正注射液腹腔注射给药1.25 g/kg,模型组给予相同容量的生理盐水。造模24 h后开始给药,每天首先灌胃给予CⅡ-3,30 min后腹腔注射CTX,隔日称重,连续给药15 d[12]。
1.2.2 CⅡ-3联合 CTX 对H22荷瘤小鼠的增效作用研究
1.2.2.1 瘤块质量与抑瘤率的检测 末次给药24 h后,颈椎脱臼处死小鼠,剥离瘤块,称重,计算肿瘤生长的抑制率[13]。计算公式如下:
肿瘤生长抑制率=(对照组平均瘤重-给药组平均瘤重)/对照组平均瘤重×100%。
1.2.2.2 骨髓有核细胞计数 末次给药24 h后,颈椎脱臼处死小鼠,将其右侧股骨剥离,用生理盐水反复冲洗骨髓腔,在显微镜下进行骨髓有核细胞的计数[14]。
1.2.2.3 脏器重量和脏器指数的测定 末次给药24 h后,颈椎脱臼处死动物,称取体重,剥取脏器并称重,计算脏器指数[13]。
1.2.2.4 外周血细胞测定 末次给药24 h后,眼眶后静脉丛采血20 μL,用全自动血球计数仪测定外周血细胞数量[13]。
1.2.2.5 小鼠血清中TNF-α、IL-2含量的测定 末次给药24 h后,分离小鼠血清,按试剂盒说明书操作,采用酶标仪以ELISA检测,并根据标准曲线方程分别计算样品中TNF-α、IL-2的浓度[15]。
1.2.2.6 小鼠血清中IgA含量的测定 末次给药24 h后,分离小鼠血清,按试剂盒说明书操作,计算多点定标曲线处理,以测定管△A求得IgA含量。
1.2.2.7 小鼠肝脏组织中AST、ALT活力的测定 末次给药 24 h后,取小鼠血分离血清检测ALT、AST,用酶标仪测定各孔OD值,绝对OD值=测定孔OD值-对照孔OD值,查标准曲线可得相应的AST/ALT活力。

2 结果
2.1 CⅡ-3对H22荷瘤小鼠瘤重及抑瘤率的影响
由表1和图1可以看出,与模型组比较,CTX组荷瘤小鼠的瘤块重量显著低于模型组(P<0.01),与单独使用CTX组比较CTX联合CⅡ-3高、中剂量组与CTX联合参芪扶正注射液组的瘤块质量均显著降低(P<0.05,P< 0.01),说明CⅡ-3联合CTX提高H22荷瘤小鼠的抑瘤率,与CTX联合参芪扶正注射液组比较,CTX联合CⅡ-3高剂量组抑瘤率优于CTX联合参芪扶正注射液组。

表1 H22荷瘤小鼠瘤重及抑瘤率
注:与模型组比较,bP<0.01;与CTX组比较,cP<0.05,dP<0.01。
Note:Compared with the model group,bP<0.01;Compared with CTX group,cP<0.05,dP<0.01.

图1 H22荷瘤小鼠瘤块质量
2.2 CⅡ-3对H22荷瘤小鼠骨髓有核细胞的影响
由表2可以看出,与模型组比较,CTX组荷瘤小鼠的骨髓有核细胞数量显著低于模型组(P<0.05),与单独使用CTX组比较,CTX联合CⅡ-3高、中、低剂量组和CTX联合参芪扶正注射液组的骨髓有核细胞数量均显著升高(P<0.01),提示CⅡ-3对由CTX造成的造血系统损伤有明显改善作用。

表2 CⅡ-3对H22荷瘤小鼠骨髓有核细胞的影响
注:与模型组比较,bP<0.01;与CTX组比较,dP<0.01。
Note:Compared with the model group,bP<0.01;Compared with CTX group,dP<0.01.
2.3 CⅡ-3对H22荷瘤小鼠脏器指数的影响
由表3可以看出,与模型组比较,CTX组荷瘤小鼠的肝脏指数、脾脏指数以及胸腺指数均显著低于模型组(P<0.01),与单独使用CTX组比较,CTX联合CⅡ-3高、中、低剂量组与CTX联合参芪扶正注射液组的肝脏指数、脾脏指数以及胸腺指数均显著升高(P<0.05,P<0.01),提示CⅡ-3可以改善由于CTX导致的脏器损伤,可以降低CTX的毒性作用。
2.4 CⅡ-3对H22荷瘤小鼠血细胞数量的影响
由表4可以看出,与模型组比较,CTX组荷瘤小鼠的白细胞、红细胞以及血小板数量均显著低于模型组(P<0.05,P<0.01),与单独使用CTX组比较,CTX联合CⅡ-3高、中、低剂量组与CTX联合参芪扶正注射液组的白细胞、红细胞以及血小板数量均显著升高(P<0.05,P<0.01),提示CⅡ-3可以改善由CTX导致的外周血中血细胞数量的降低,增强免疫力。
2.5 CⅡ-3对H22荷瘤小鼠血清TNF-α、IL-2、IgA含量的影响
由表5可以看出,与模型组比较,CTX组荷瘤小鼠的TNF-α和IL-2的含量显著高于模型组(P<0.05,P<0.01),IgA的含量显著低于模型组(P<0.01),与单独使用CTX组比较,CTX联合CⅡ-3高、中、低剂量组联合用药后TNF-α、IL-2和IgA的含量显著升高(P<0.05,P<0.01),提示CⅡ-3可以增强CTX的抗肿瘤作用,同时提高机体免疫力。
2.6 CⅡ-3对H22荷瘤小鼠肝脏ALT、AST活力的影响
由表6可以看出,各组小鼠之间肝脏ALT、AST活力并无显著性差异(P>0.05),提示CⅡ-3对H22荷瘤小鼠肝脏ALT、AST活力并无影响。
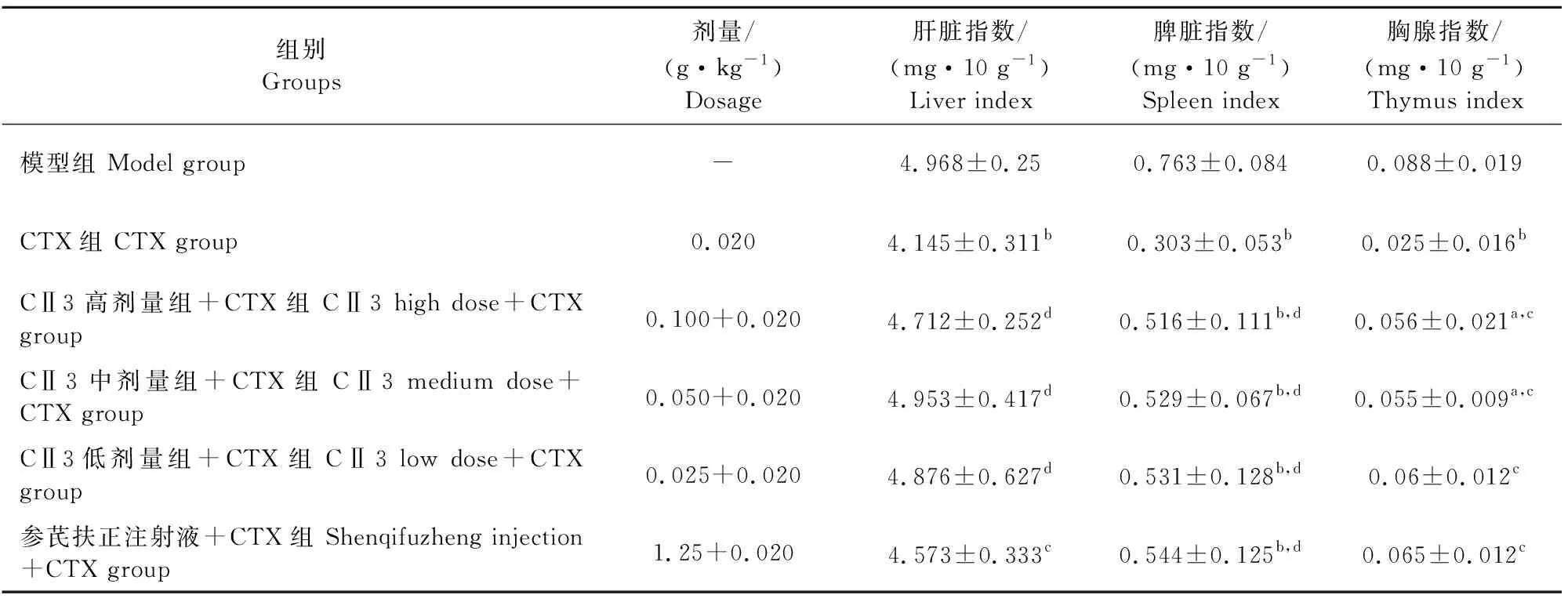
表3 CⅡ-3对H22荷瘤小鼠脏器指数的影响
注:与模型组比较,bP<0.01;与CTX组比较,cP<0.05,dP<0.01。
Note:Compared with the model group,bP<0.01;Compared with CTX group,cP<0.05,dP<0.01.

表4 CⅡ-3对H22荷瘤小鼠血细胞数量的影响
注:与模型组比较,aP<0.05,bP<0.01;与CTX组比较,cP<0.05,dP<0.01。
Note:Compared with the model group,aP<0.05,bP<0.01;Compared with CTX group,cP<0.05,dP<0.01.

表5 CⅡ-3对H22荷瘤小鼠血清TNF-α、IL-2、IgA含量的影响
注:与模型组比较,aP<0.05,bP<0.01;与CTX组比较,cP<0.05,dP<0.01。
Note:Compared with the model group,aP<0.05,bP<0.01;Compared with CTX group,cP<0.05,dP<0.01.

表6 CⅡ-3对H22荷瘤小鼠肝脏ALT、AST活力的影响
3 讨论
化疗作为目前临床上治疗恶性肿瘤的常规手段,其疗效确切,但是化疗药物在杀伤肿瘤细胞时,也对机体产生了严重的毒性,且多次使用后肿瘤细胞也会对其产生耐药性[16],致使治疗失败。如顺铂、CTX对肿瘤细胞缺乏特异性,常常引起免疫功能抑制、骨髓抑制、外周血白细胞和血小板减少,以及肝肾脏器损害等毒副作用[17],这已经成为了限制CTX发挥治疗效果的最大阻碍之一。研究表明[18-19],肿瘤化疗配合中医中药辩证治疗,能减轻化疗药物的毒副反应,增强肿瘤细胞对化疗药物的敏感性,改善肿瘤患者的生存周期和生存质量。目前,在临床上已使用和处于临床试验阶段的增效减毒药物,如参芪扶正注射液、金复康口服液、腾龙补中汤等[20],可见中药联合化疗药治疗肿瘤,已成为抗肿瘤药物研究的热点。
参芪扶正注射液是由党参、黄芪提取的纯中药注射剂,能补中益气、健脾益肺,同时增强机体免疫力,对于肿瘤患者能减轻化疗对骨髓造血功能的抑制,并促进骨髓造血功能的恢复,提高细胞免疫功能,改善患者的生活质量,作为化疗辅佐用药在临床上得到了一定的推广[21-22]。因此,本研究选用参芪扶正注射液作为阳性对照药。研究数据表明,CTX联合CⅡ-3高剂量组对H22荷瘤小鼠的抑瘤率可高达57.90%,其抑瘤效果优于单独使用CTX和CTX联合参芪扶正注射液组。与CTX组比较,联合给药后H22荷瘤小鼠的各脏器指数、外周血细胞数量、骨髓有核细胞数量均有不同程度的提高,可以提高血清中TNF-α、IgA和IL-2的含量(P<0.05,P<0.01),这表明CⅡ-3在增强CTX抗肿瘤作用的同时,还可以降低CTX对机体的毒副作用,改善机体的免疫功能和造血系统功能。与联合参芪扶正注射液组比较,CⅡ-3联合高剂量组在增效减毒作用与提高免疫方面的作用接近联合参芪扶正注射液组,为美洲大蠊抗肿瘤活性组分CⅡ-3在肿瘤化疗中作为辅助用药提供了试验依据。
综上所述,CⅡ-3联合CTX可增强抗肿瘤的作用,同时降低了对CTX所致的骨髓、免疫器官及肝脏的损伤,从而起到增效减毒的作用,同时为美洲大蠊抗肿瘤活性组分CⅡ-3在肿瘤化疗中作为辅助应用提供依据。CⅡ-3在联合化疗药物治疗肿瘤中确有明显的增效减毒作用,但机制尚未明确,因此,将在后期着重对CⅡ-3增效减毒的作用机制进行探讨。

