除草剂莠去津降解菌的筛选及降解效果
刘 限, 李 安, 高增贵, 姚 远
(1.沈阳农业大学生物科学技术学院,辽宁沈阳 110866; 2.沈阳农业大学植物保护学院,辽宁沈阳 110866)
近年来,除草剂大量和高剂量使用对环境和下茬作物的影响越来越受到人们的关注[1-3]。抑制光系统Ⅱ的除草剂莠去津在世界范围内被广泛用来控制玉米和高粱田阔叶及1年生杂草,已经应用长达几十年[4-8]。莠去津一般被认为是不易矿化降解的化合物,其在土壤中的半衰期较长(1~12个月)。莠去津因其在土壤中流动性大,容易在地下水中检测到,一般认为莠去津是土壤或地下水的污染物[9-10]。莠去津虽然在控制农田杂草中发挥了非常大的作用,但已有研究表明莠去津对土壤微生物、水生生物甚至人类健康都有影响[11-14]。目前,土壤和水中有机污染物的清除一般可采用物理化学方法,比如换土、活性炭吸附、热解析、土壤氧化、焚烧等方法,也可以采用具有降解有机污染物的微生物进行生物修复[15]。土壤微生物在化学农药的降解和转化中起着非常重要的作用,微生物可将持久性农药作为能源或营养来利用,也可通过和其他物质共代谢来利用[16]。目前,已经发现诺卡氏菌属(Nocardia)、土壤杆菌属(Agrobacterium)、芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)等19个属的细菌具有降解土壤莠去津的能力[17-20]。这些菌株含有1种或几种不同的降解基因(如atzA、atzB、atzC、atzD、atzE、atzF、atzC-trzD、trzN-atzB等),能将莠去津完全或部分降解[21-25],从而消除莠去津的毒性。但关于莠去津降解酶具体定位(胞内或胞外)的研究还鲜有报道。因此,本研究利用笔者所在实验室保存的各种细菌,分离和筛选具有降解莠去津能力的细菌,并分析这些细菌在培养基和土壤中对莠去津的降解效果,验证获得细菌的莠去津降解酶类的定位,以期为解决土壤中残留莠去津的降解奠定基础。
1 材料与方法
1.1 供试材料
菌株:试验所用40株菌株来自沈阳农业大学植物保护学院免疫研究所保存的细菌(是土壤或植物内生细菌)。
溶菌肉汤(lysogeny broth,简称LB)培养基:胰蛋白胨 10 g,酵母提取物5 g,NaCl 10 g,琼脂18 g,蒸馏水1 000 mL,pH值为7.4~7.6,于121 ℃灭菌30 min,备用。牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂18 g,蒸馏水1 000 mL,pH值为7.0~7.2,于121 ℃灭菌30 min,备用。基础无机盐培养基:KH2PO40.45 g,K2HPO41.79 g,Mg2SO40.10 g,NaCl 0.40 g,琼脂18.00 g,蒸馏水1 000 mL,pH值为7.5,于 121 ℃ 灭菌30 min,备用。Biolog通用生长(Biolog univcrsal growth,简称BUG)培养基:BUG琼脂培养基57.0 g,蒸馏水1 000 mL,pH值为 7.3±0.1,于121 ℃灭菌15 min,备用。
除草剂:莠去津原药,有效成分大于97%,购自山东淄博新天地农业机械有限公司。
1.2 试验方法
1.2.1 莠去津降解菌株的筛选及鉴定
1.2.1.1 含药培养基配制 准确称取1 g莠去津原药,加入10 mL无菌水,配制成莠去津母液,在99 ℃恒温水浴锅中水浴加热,边水浴边不停搅拌,并滴入适量吐温-80,至药品粉末完全溶解。取900 μL莠去津母液加入到150 mL培养基中,摇匀,制成莠去津含量为600 μg/L的培养基。
1.2.1.2 耐药性和可利用莠去津菌株的筛选 用LB培养基将待筛菌株活化培养2代,挑取活化后的菌株用无菌水稀释菌液,使其D600 nm=1。将LB培养基制成平板,取200 μL菌液均匀地涂在平板上。以不含除草剂的LB培养基平板为对照,于30 ℃培养2 d后观察细菌的菌落生长情况。每组3次重复。在LB培养基初筛基础上,在只含有莠去津为碳源的基础无机盐培养基上进行进一步筛选,取200 μL菌液(D600 nm=1)均匀地涂在以莠去津为碳源的基础无机盐培养基平板上,培养2 d后调查细菌菌落数。以常规的基础无机盐培养基(不含莠去津)为空白对照。每组3次重复。
1.2.1.3 细菌菌种鉴定 将筛选获得的能利用莠去津为唯一碳源的菌株进行革兰氏染色,鉴定该细菌是阴性菌还是阳性菌。将菌株用BUG培养基培养24 h,用棉签蘸取微量纯培养菌,接入细菌鉴定用革兰氏阴性/阳性接种液(GN/GP-IF)中,混匀。用浊度计测浑浊度,当透光率达到98%时为最适。将接菌后的接种液倒入加样槽,用八排道移液器快速接入Gen Ⅲ鉴定板中,于30 ℃恒温培养16~24 h后,进行微平板读数,分析鉴定结果。
1.2.2 菌株N1和N34对莠去津降解效果
1.2.2.1 实验室液体培养条件下的降解效果 取20 mL菌液(D600 nm=1)接入150 mL含药(600 μg/L)的LB液体培养基中,置于28 ℃、120 r/min的摇床上连续培养7 d,分别于12、24、48、72、96、120、144 h取样。设3次平行试验。
取5 mL培养液于25 mL具塞试管中,加入等体积的乙酸乙酯,在翻转摇匀仪上充分振荡提取10 min,静置分层,取乙酸乙酯上层,收集的乙酸乙酯用旋转蒸发仪于42 ℃浓缩近干,用色谱级甲醇定容至1 mL,过0.2 μm有机滤膜。
将分离纯化的提取液于岛津高效液相色谱仪中进行测定,莠去津液相色谱分析条件:色谱柱为Agilent Zorbax SB-C18色谱柱(250 mm×4.6 mm×5 μm),柱温为30 ℃,波长为222 nm,流动相为甲醇 ∶水=70 ∶30(体积比);流速为 0.8 mL/min;进样量为10 μL。然后根据下面的公式计算土壤样本中莠去津的含量:
式中:R为样本中莠去津残留浓度,mg/L;S样为样本峰面积,mV·min;C标为标准溶液浓度,mg/L;V样为样本定容体积,mL;S标为标准溶液峰面积,mV·min;W为采样量,L。
莠去津降解率的计算公式:
莠去津降解率=1-实测莠去津含量/莠去津添加量×100%;
莠去津绝对降解率=(Vt-VCK)/(1-VCK)×100%。
式中:Vt为接菌处理培养基中莠去津的降解率;VCK为未接菌处理培养基中莠去津的降解率。
1.2.2.2 实验室土壤中的降解效果 取沈阳农业大学连续3年没有施过除草剂的表层10 cm土壤,在室内通风处自然风干后,过100目筛。将土壤分装成100 g/瓶,并保持土壤湿度在60%左右。分装后的土壤分为2组,一组瓶装土壤于121 ℃、30 min灭菌2次,另一组不灭菌。分别设不添加除草剂的对照处理和莠去津处理(终浓度为2 000 μg/kg)。将纯化后的菌株用LB培养基活化2代,并稀释为菌悬液,使其D600 nm=1,每瓶土壤接入20 mL菌悬液,每个处理3次重复。于室温条件下培养,分别在1、3、5、7、14、21、28、35、42、49 d取样,用于莠去津残留量检测。
超声提取:准确称取10 g土壤样品于50 mL具塞离心管中,加入20 mL提取液混匀后,用超声波清洗器超声提取 30 min,再振荡提取30 min后,加入5 g氯化钠,于 5 000 r/min 离心5 min,取10 mL上清液于50 mL离心管中,在50 ℃水浴锅中减压旋转蒸干,加入2 mL甲醇溶解,待净化。
净化:将5 mL甲醇移入石墨炭GCB小柱(小柱活化)后,移入2 mL样品,再移入10 mL甲醇收集,50 ℃水浴旋转蒸干后,加入1 mL甲醇定容,过0.22 μm有机相针式滤器于进样小瓶中待测。液相检测和降解率计算方法同“1.2.2.1”节。
1.2.3 细菌菌株N34中莠去津降解酶的定位
1.2.3.1 胞内(外)粗酶液提取 将菌株N34接种于含有 1 000 mg/L 莠去津的牛肉膏蛋白胨液体培养基中,于 180 r/min、30 ℃恒温摇床培养48 h,取培养液于5 000 r/min离心15 min,取上清液并收集菌体。向上清液中加入硫酸铵,边加入边不停搅拌至硫酸铵饱和度达100%,盐析过夜。于 4 ℃、10 000 r/min离心30 min,收集沉淀,将沉淀溶于pH值为7.0的0.05 mol/L Na2HPO4-NaH2PO4缓冲液中透析至无硫酸根,得到胞外粗酶液。细菌菌体用20 mL pH值为7.0的0.05 mol/L Na2HPO4-NaH2PO4缓冲液洗涤2~3次。取菌体,加入3倍体积的缓冲液将菌体悬于缓冲液中。将菌悬液置于冰浴中用超声波细胞破碎仪进行破碎处理,超声波破碎5 s,停5 s,共25个循环。于4 ℃、10 000 r/min离心30 min,取上清液,得到胞内粗酶液。
1.2.3.2 胞内(外)降解酶对莠去津降解效果的测定 为了确定莠去津降解酶是属于胞内酶还是胞外酶,取2.8 mL含 50 μg/L 莠去津、pH值为7.0的0.05 mol/L Na2HPO4-NaH2PO4缓冲液,在30 ℃预热,再加入200 μL预热的胞内(外)粗酶液,使酶反应体系的总体积为3.0 mL;30 ℃水浴保温2 h,加入0.2 mL 1 mol/L盐酸中止酶反应。每个处理3次重复,同时设不加酶液的处理为空白对照。然后用9 mL甲醇分3次萃取反应液中剩余的莠去津,最后定容到10 mL,于 50 ℃ 水浴中旋转蒸干,取1 mL甲醇定容,过0.22 μm滤膜,用液相色谱测定莠去津的含量,并计算降解率。
1.2.4 数据分析方法 将所得数据通过Excel和SPSS 10.0进行统计分析。
2 结果与分析
2.1 莠去津降解菌株的筛选及鉴定
将细菌稀释液涂布到含有莠去津的LB培养基上过夜培养后,发现菌株N1和N34可以在含莠去津的培养基上生长(图1),而其他38株细菌均不能在含莠去津的培养基上生长。进一步在含有莠去津而未加其他碳水化合物的基础培养基上进行培养,发现在以莠去津为碳源的情况下,这2株细菌都可以正常生长,细菌菌株N1和N34的菌落数分别为254、462个(图2),由此可以看出这2株细菌都能降解或利用莠去津。
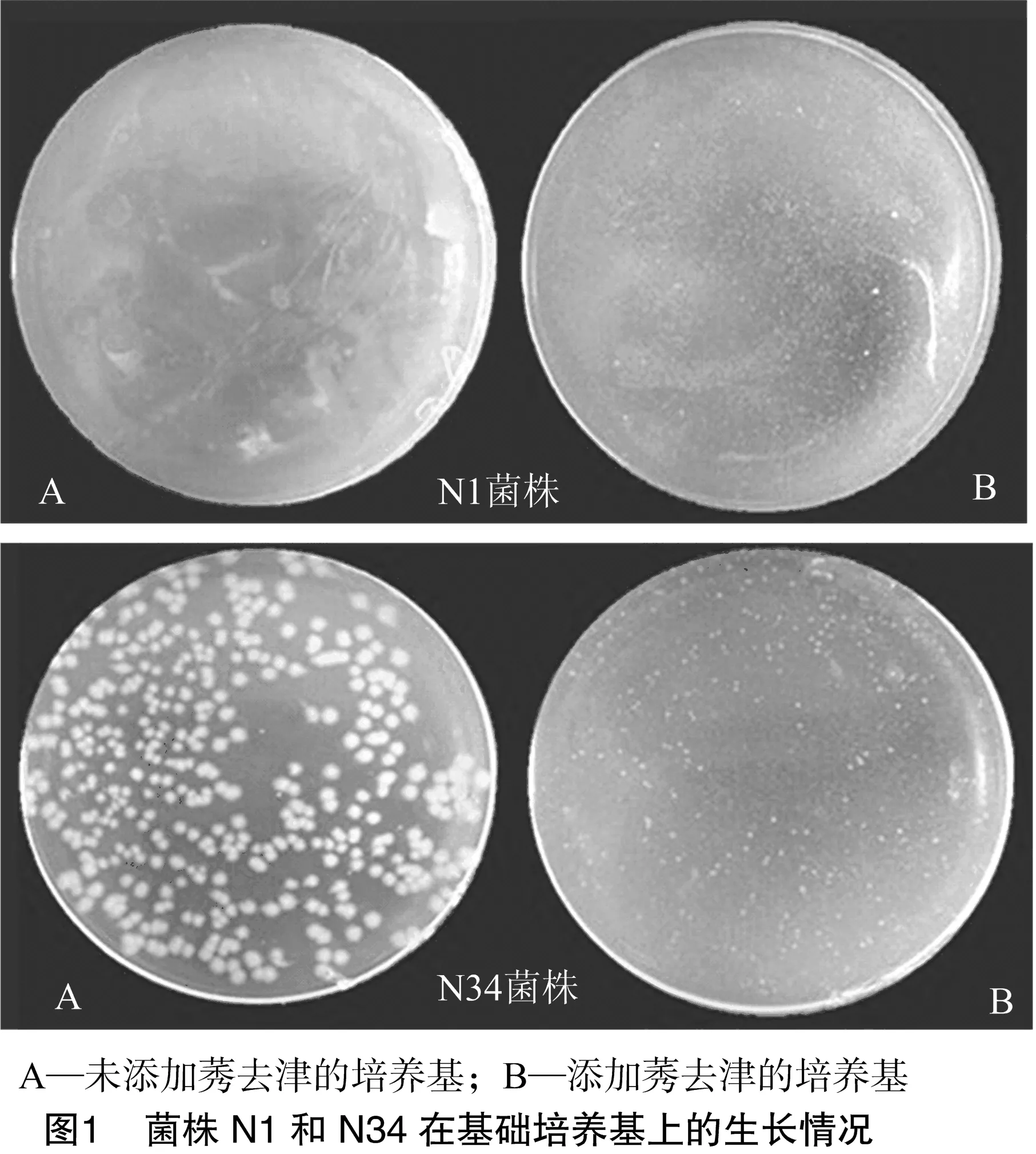

经革兰氏染色发现,菌株N1和N34均呈阳性反应,均为革兰氏阳性菌。利用Biolog微生物自动鉴定仪对2株菌株进行菌种鉴定,结果如表1所示,鉴定得出菌株N1为腐叶芽孢杆菌(Bacillusdecisifrondis),菌株N34为弗雷尼棒状杆菌(Corynebacteriumfreneyi)。

表1 用Biolog微生物鉴定仪对2株菌株的鉴定结果
2.2 菌株N1和N34对莠去津的降解效果
在农药残留分析中,常用添加回收率和相对标准差来衡量准确度和精密度。本试验分别分析了莠去津在无机盐培养基和土壤中的回收率。按照建立的样本提取方法和色谱条件对样本进行测定,并用相近浓度的基质标准溶液单点校正。由表2可知,莠去津在无机盐培养基中的平均回收率为83.54%~95.31%,相对标准差为1.23%~5.98%;莠去津在土壤中的平均回收率为90.23%~113.29%,相对标准差为3.32%~4.81%,符合农药残留分析要求。
表2 莠去津在无机盐培养基和土壤中的添加回收率
由表3可知,在无机盐培养基中莠去津自然降解率在144 h只有27.58%,加入莠去津降解菌后,降解率明显提高。菌株N1对莠去津的降解率在12~72 h持续上升,在72 h时绝对降解率达55.34%,之后上升幅度变小,在96 h后绝对降解率维持在62%左右。菌株N34对莠去津的降解率在48~96 h上升幅度较大,在96 h时绝对降解率达90.39%,之后降解率变化幅度较小,由此可以看出菌株N34对莠去津的降解作用明显优于菌株N1。
在无机盐培养基中菌株N34对莠去津的降解效果明显好于菌株N1,因此检测菌株N34在土壤中对莠去津的降解作用。由表4、表5可知,无论在灭菌土壤还是未灭菌土壤中,除草剂莠去津的自然降解速度均较快,但加入菌株N34后降解速度更快。在灭菌土壤中菌株N34对莠去津的降解率在28 d时就达到了90%左右,绝对降解率在49 d时为 62.33%;在未灭菌土壤中,在21 d时菌株N34对莠去津的降解率就达到了90%以上,绝对降解率最高,为62.80%。由此可以看出菌株N34对除草剂莠去津具有明显的降解作用,可以用作田间土壤中莠去津的清除。同时研究发现,未灭菌土壤中莠去津的自然降解率基本均高于灭菌土壤中莠去津的自然降解率,说明土壤中存在的微生物对莠去津也有降解作用。

表3 菌株N1和N34在无机盐培养基中对莠去津的降解率

表4 菌株N34在灭菌土壤中对莠去津的降解率

表5 菌株N34在未灭菌土壤中对莠去津的降解率
2.3 莠去津降解酶定位
由表6可知,胞外粗酶液对莠去津的降解率与对照相似,说明细菌N34菌株不分泌莠去津降解酶于培养液中;而胞内粗酶液对莠去津有明显的降解活性,降解率达到99.00%。由此可见,菌株N34产生的降解酶主要位于细胞内,说明细菌N34应该是通过生长利用代谢来降解莠去津的。

表6 菌株N34胞内(外)降解酶对莠去津的降解作用
3 结论与讨论
微生物对除草剂的反应是多种多样的,现有研究表明,除草剂对土壤微生物有刺激生长和抑制生长的作用[26-28],说明不同微生物对除草剂具有不同的响应机制。本研究也发现,不同细菌菌株对莠去津的响应不同,有的菌株对莠去津非常敏感,在含莠去津的培养基上不能生长,有的菌株能够生长,但不能利用莠去津,达不到降解莠去津的效果。本研究从40株细菌中筛选出2株莠去津降解菌,分别为菌株N1和N34,而且2株菌株的降解能力也有一定差距,因此除草剂降解菌的筛选最好能够在含有除草剂为唯一氮源或碳源的培养基上进行,提高获得降解菌的效率。另外,微生物降解除草剂主要通过2种机制来进行,一是通过生长代谢,微生物直接利用除草剂为氮源或碳源来降解;另一种是通过共代谢作用,微生物需要其他碳氮源来生长,通过改变难降解除草剂的化学结构来分解,而且往往须要诱导作用才能发挥作用[29-31]。本研究发现,菌株N34并不是通过分泌降解酶来降解莠去津,而是通过生长代谢来达到目的。
灭菌土壤中莠去津的降解效果不如未灭菌土壤,这可能与土壤中的微生物有关[32]。很多研究表明,微生物在莠去津残留土壤修复中起着重要的作用[33],本研究中筛选得到的菌株N34在培养基和土壤中对莠去津的绝对降解率都达到了60%以上,说明该菌株可以用来修复莠去津残留土壤。另外,微生物修复除草剂污染土壤过程中还受到土壤中有机质和其他营养成分的影响[34],因此提高菌株N34对莠去津的降解效果还须要进一步进行相关研究,以提高菌株N34对莠去津的降解作用。
——化工原料、农副产品

