基于聚合酶链式反应的肠道病原菌检测技术
陈 莹(CHEN Ying),胡 蕊(HU Rui),刘颖勋(LIU Ying-xun),王真真(WANG Zhen-zhen),张林艳(ZHANG Lin-yan),顾 兵(GU Bing),李 颖(LI Ying),王 鑫(WANG Xin)
(1徐州医科大学医学技术学院,江苏 徐州 221004;2西安交通大学医学部基础医学院,陕西 西安 710061;3南京巨鲨显示科技有限公司市场管理部,江苏 南京 210036)
肠道感染性疾病重要病原菌,如志贺菌和沙门菌等感染发病率高、传播速度快、耐药发生率也高[1-2]。据文献报道,肝硬化[3]、HIV 感染[4]、炎 症性肠道病[5]以及血糖调节[6]等均与肠道菌群失调有关。此外,引起胃肠道感染的食源性致病菌是食品安全的严重隐患[7],可引起胃肠炎、败血症等疾病。因此,快速检测威胁人类健康的病原菌刻不容缓。目前,临床常规的病原菌检测技术多采用传统细菌培养并进行生化反应及血清学鉴定等,耗时繁琐,检测灵敏度低,且检测技术人员的操作水平和经验也对检测结果的准确性有重要影响[8]。研发灵敏度高、特异性强的检测技术进行病原菌的快速检测,在疾病预防以及临床诊断、指导用药等方面具有重要意义。1985年美国Kary mullis首次提出聚合酶链式反应(polymerase chain reaction,PCR)技术,该技术因其高效、灵活以及快速等特点被广泛应用。由于传统PCR技术存在一定缺陷,为弥补该检测方法的不足,一系列基于PCR原理的新型检测技术不断研发,为肠道病原菌的鉴定提供了有效的指导与技术支持。本文就基于PCR技术原理的肠道病原菌检测技术进行归纳综述,并分析比较各类方法的优缺点。
1 PCR技术的基本原理
传统PCR技术的基本思路与DNA的天然复制过程相似,包括变性、退火和延伸。扩增过程中,以单链DNA为模板,寡核苷酸为引物,在DNA聚合酶的作用下沿5’→3’方向扩增DNA片段,使目的基因得以大量复制[9](见图1A)。以肠道病原菌特异性靶基因为研究对象,通过PCR引物的设计与合成,以临床微生物样本的基因组DNA为模板,可实现肠道病原菌特异性靶基因的PCR快速检测。通过该技术,可以进行12种志贺菌毒力因子的快速检测[10]以及该肠道病原菌的耐药性检测[11]。尽管传统PCR技术具有高效、灵活以及快速等优点(见表1),但是该技术仍受采样过程中无菌操作、样品预处理以及定量不准确等因素的影响,而作为对传统PCR技术的补充,基于PCR原理的衍生检测技术为肠道病原菌的鉴定提供了有效指导与技术支持。

图1 PCR原理图

表1 不同PCR方法的优缺点比较
2 基于PCR技术的肠道病原菌检测
2.1 多重PCR(multiplex PCR,mPCR) Chamberlain于1988年首次设计并命名了多重PCR,该方法是普通PCR技术的延伸,旨在一个扩增体系中添加多对引物,完成多个目的片段的扩增,达到同时进行多种靶基因检测的目的(见图1B)。通过多重PCR技术,研究者对志贺菌、侵袭性大肠埃希菌及艰难梭菌进行了快速检测[12-13]。孟相秋等[14]应用该方法,对肠毒性大肠埃希菌(ETEC)的肠毒素基因STa、STb、LT-I和LT-II同时进行检测,检测结果证明了该方法的高效性与特异性。Van等[15]成功建立了食源性大肠埃希菌O157∶H7 stx1、stx2靶基因的快速检测技术,与传统培养方法相比,该方法可将检测时间缩短至2 d。此外,与传统血清学方法相比,肠道病原菌如沙门菌、大肠埃希菌等分型繁多,多重PCR既可以较大程度地提高致病菌的检出率,同时还可以鉴定其型别及突变。张晓云等[16]对比多重PCR与血清凝集法鉴定志贺菌,结果显示,前者的检出率(55.00%)高于后者(33.33%),表明多重PCR技术有助于提高肠道病原菌检测的准确性及有效性。此外,有研究团队[17]结合多重PCR技术与基因芯片技术,进一步尝试致病菌的高通量检测。理论上,相较于传统PCR而言,多重PCR更高效,但李新福团队在对比传统和多重PCR检出限时,发现多重PCR的灵敏度明显下降[18]。因此,我们通常需要对多重PCR的反应体系,如引物浓度、退火温度、退火时间以及DNA聚合酶含量等参数进行优化。
2.2 实 时 荧 光 定 量 PCR(real-time fluorescent quantitative PCR,RTFQ-PCR) RTFQ-PCR 是一种能将核酸放大并同时进行核酸产物检测的方法,以TaqMan探针技术为例,探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’→3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,荧光信号产生,即每扩增一条DNA链,就有一个荧光分子形成,荧光信号的累积与PCR产物的形成完全同步(见图2A)。该技术实现了PCR从定性到定量的突破,具有更高的灵敏度、特异度及精确性。与传统PCR方法相比,该方法最大的优势是全封闭操作以及不需要后续的分析过程,显著缩短了检测时间,并减少了标本污染的可能性。Barletta研究团队曾利用该方法对志贺菌、沙门菌和弯曲杆菌进行了识别[19]。胡慧等[20]使用该技术对大肠埃希菌O157∶H7特异性基因进行检测,结果显示纯菌检测的灵敏度可达2×10 CFU/mL,同时假阳性率降低,其检出率是普通PCR的两倍多。高春燕团队针对志贺菌属侵袭性质粒抗原H基因(ipaH)建立了志贺菌快速敏感的荧光定量PCR检测方法,检测下限可达200拷贝/mL[21]。刘生峰等[22]使用基于TaqMan探针的荧光PCR技术检测肠出血性大肠埃希菌O157∶H7,实验显示该方法的线性范围为102~108CFU/mL,检测限达20 CFU/mL。麻丽丹团队将 Taqman MGB(Minor Groove Binder)探针技术与实时PCR相结合,于2 h内完成水产品中沙门菌的检测,纯菌检测限达13 CFU/mL[23]。
2.3 数字PCR(digital PCR,dPCR) dPCR是一种定量分析技术(见图2B),扩增前首先对样品进行预处理,使含有核酸分子的反应体系被划分为成千上万个独立反应室,每个反应室中含有零、一个至数个待检靶核酸分子。经PCR扩增后,通过检测每个反应室,含有单个模板分子的反应室产生阳性信号,其数量可通过绝对定量的方式读出,根据泊松分布原理及阳性微滴的个数与比例,即可得出靶分子的起始拷贝数或浓度。该方法确保了痕量核酸也可获得高拷贝的定量结果[24-25]。

图2 衍生PCR技术原理图
董莲华等[26]通过该方法建立了大肠埃希菌O157∶H7的检测体系,检出限可达10 CFU/mL。此方法除灵敏度高,特异性强外,更有无需核酸标准品的优点。王静团队将叠氮溴化丙锭与微滴数字PCR技术(ddPCR)相结合,对沙门菌进行检测,检出限为8.0拷贝/20μL,在检测人工污染鸡肉样品时,最低可检出102CFU/mL的沙门菌[27]。Bian等[28]另选择了油饱和的聚二甲基硅氧烷与ddPCR技术相结合,对致病性大肠埃希菌O157和单核细胞增生李斯特菌进行检测,同时对比RTFQ-PCR技术,结果显示,前者具有高灵敏度的特点,最低检测限达10 CFU/mL,但该方法的缺点是稳定性和精密度略低于后者;Suo等[29]成功验证此法,针对大肠埃希菌O157∶H7、肠炎沙门菌、单核细胞增生李斯特菌和空肠弯曲杆菌的不同70聚体寡核苷酸,开发了病原体微阵列检测技术,结合多重PCR扩增,成功区分了4种病原体,其检测灵敏度为1×10-4ng(约20拷贝)/每个基因组DNA。
2.4 随机扩增多态性 PCR(random amplified polymorphic DNA PCR,RAPD-PCR) 1990年,由Williams建立起来的一项DNA多态检测技术—RAPD-PCR,进入广大研究人员视野,该技术具有多态性检测的特点,打破了传统PCR技术使用特定核苷酸序列作为引物的惯例,采用一系列人工合成的随机寡核苷酸链,对所研究的基因组DNA进行PCR扩增(见图2C),通过该技术可有效研究肠杆菌亚群之间的遗传性差异,以及尿路感染(UTI)大肠埃希菌多重耐药分离株的遗传分型[30-31]。此外,Alni等[32]利用该技术对人、牛和食品样品中分离的金黄色葡萄球菌进行基因分型,确定分离株之间的遗传关系,从而进行感染流行病学的监测与控制。
2.5 基因组重复序列 PCR(repetitive element PCR,rep-PCR) rep-PCR是利用设计好的引物扩增目标DNA间高度保守的重复序列,得到不同区域间的扩增图谱,分析目标基因组的多态性。该方法具有高分辨力,常用于病原菌的分子分型、基因图谱制作、溯源性的系统分析等,其中肠杆菌基因间重复共有序列-PCR(ERIC-PCR)是重要的检测方法之一。Ranjbar等[33]应用ERIC-PCR对地表水大肠埃希菌菌株的基因组指纹图谱进行分析;Abakpa研究小组应用该方法对从蔬菜、灌溉水等440份样本中分离的耐药性大肠埃希菌O157∶H7进行指纹图谱分析,揭示了发展中国家耐药性菌株的传播威胁[34]。张辉团队利用此方法对分离自食品及住院患者的大肠埃希菌菌株进行检测,为防控食源性大肠埃希菌引起的疾病提供了有力的实验依据,但该方法也有不足之处,如对反应体系要求较高[35]。
2.6 不对称 PCR(asymmetric PCR,aPCR)aPCR技术其反应原理和操作步骤与传统PCR相似,主要区别是体系中添加了不等量的一对引物。在DNA聚合酶的催化下,通过对不等量引物结合的DNA片段进行扩增,在扩增前期其产物主要是双链DNA,而扩增后期则为大量单链DNA[36]。因不存在互补双链的竞争性结合,使得该方法的杂交效率及检测灵敏度提高[37-38]。王小强团队利用多重不对称PCR技术结合基因芯片技术,建立了一种可同时检测7种常见食源性致病菌的方法,并使基因组DNA的检测灵敏度达0.1~1 pg,该方法提供了一种特异性检测单一和混合感染目标菌的手段[39]。
2.7 免 疫 捕 捉 PCR(immuno-capture PCR,ICPCR) IC-PCR是免疫捕捉与传统PCR相结合的一门技术,在传染病诊断、流行病学调查等诸多领域有着广阔的应用前景。该方法首先将特定抗原微生物通过固相或均相抗体特异性捕捉,之后通过加热等步骤完成PCR模板的制备,再利用基因组序列特异性引物进行PCR扩增,从而对样本中的病原微生物进行定性或定量分析(见图3A)。张体银等[40]采用免疫捕捉-通用引物PCR(IC-UPPCR)对食品中的沙门菌进行检测,检测灵敏度可达2×102CFU/mL,该技术表现出特异性好、灵敏度高和高通量等特点,适用于食品卫生监管以及临床诊断等领域。高涛团队将免疫磁珠捕获-通用引物PCR(IMC-UPPCR)与传统培养法进行比较,结果显示免疫捕捉PCR与传统培养法符合率达93.22%[41],说明该方法还有进一步的发展空间和广阔的应用前景。
2.8 巢式PCR(nested-PCR) nested-PCR又称套式PCR,即通过两对PCR引物进行两轮PCR扩增,得到完整的目的片段。利用第一对PCR引物进行常规PCR扩增,之后利用第二对引物(即巢式引物,设计于第一次PCR扩增产物的内部)进行二次扩增,第二对引物可结合在第一次PCR产物的内部,使得第二次PCR扩增片段短于第一次扩增片段(见图3B)。该方法特异性强、灵敏度高,可避免由于环境污染造成的假阳性结果,成本也相对较低。樊琛研究小组通过套式PCR技术检测了10株大肠埃希菌的iss基因,并探讨该技术的检测缺陷和改进方法[42]。陈爱平等[43]通过该方法对外环境水中的致病霍乱弧菌进行监测,在保证霍乱监测数据灵敏度的同时,有助于追踪霍乱的传播趋势。樊晓琳等[44]通过nested-PCR对水产品中的副溶血弧菌进行快速检测,结果表明该方法对副溶血弧菌纯培养物的检测限为6.62 CFU/mL,对 DNA 的检测限为200 fg,且该方法与国家标准检测方法结果一致,但检测时间更具优势。
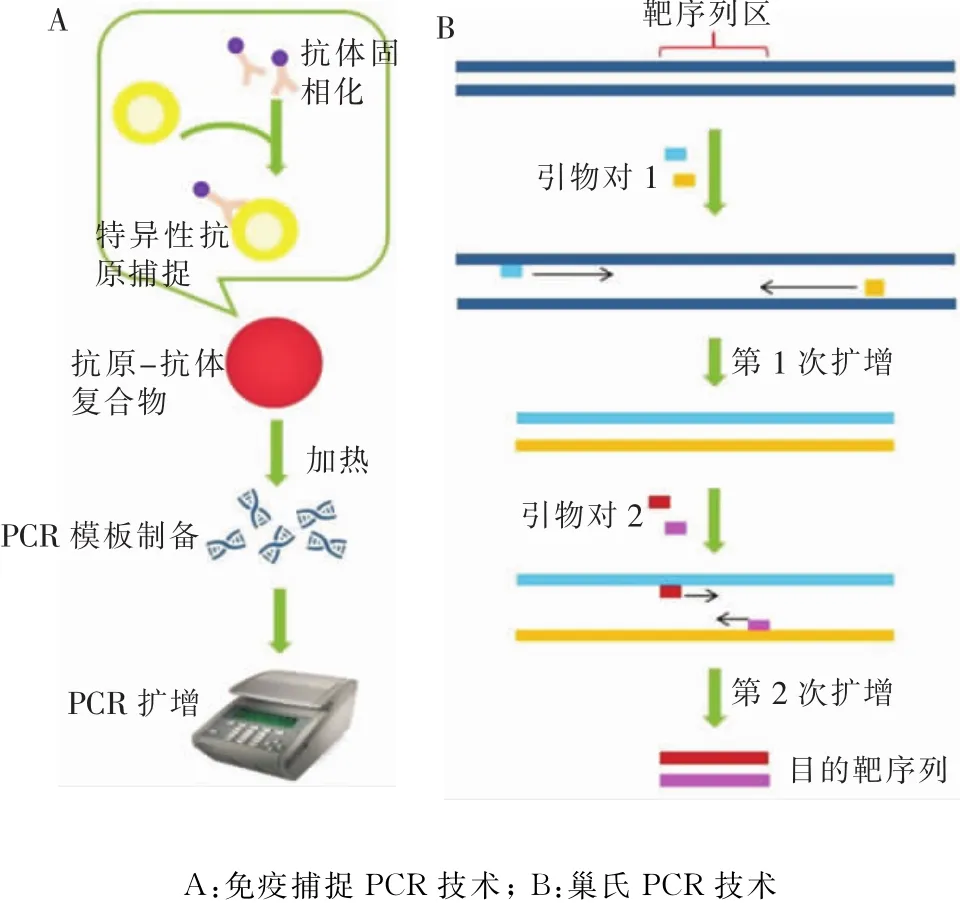
图3 衍生PCR技术原理图
2.9 双启动寡核苷酸PCR(dual priming oligonucleotide PCR,DPO-PCR) DPO-PCR 是一种融合新型引物设计方法,进行靶基因快速检测的新技术。在该技术中,DPO引物由三个区域组成:较长的5’-区段、较短的3’-区段,以及桥接5’-和3’-区段的聚肌苷酸[poly(I)]连接物[45]。该检测技术可以有效消除错配引发,从而提高PCR扩增的特异性,其检测结果要比传统PCR方法更精确。该方法可有效检测肠出血性大肠埃希菌O157∶H7,其检测灵敏度低至94 CFU/mL[46]。针对致病性大肠埃希菌,李丹丹研究小组建立的DPO-PCR检测体系,其灵敏度为97 CFU/mL[47],上述实验为精准、快速检测大肠埃希菌提供了新的检测思路。此外,基于DPO-多重PCR技术可以同时进行沙门菌、空肠弯曲杆菌、金黄色葡萄球菌、单核细胞增生李斯特菌、志贺菌及小肠结肠炎耶尔森菌的快速检测,为食源性病原菌的快速检测提供了有效检测手段[45]。
3 其他PCR技术
其他基于PCR原理的肠道病原菌检测技术包括与新兴检测技术结合的检测方法,如随机PCR结合基因芯片技术[48]、多重PCR结合基因芯片技术[17,49]、传统PCR与变性高效液相色谱法结合的多重PCR-DHPLC技术[50-51]、PCR 技术结合免疫层析技术(PCR-ICT)[52]和多重荧光PCR结合 Allglo探针技术[53],上述技术在肠道致病菌,如致泻性大肠埃希菌、艰难梭菌等的快速检测中发挥着重要作用。
4 讨论
PCR技术自问世以来,在医学检验等领域,如临床疾病诊断,细菌、病毒以及寄生虫定性和定量检测等方面取得了巨大成就[54-57],并成为常用临床快速检测方法之一。由于传统PCR技术存在易交叉污染、产生假阳性及定量不准确等缺点,已经不能满足人们的检测需求。研究人员研发的各种基于PCR原理的衍生技术,可针对PCR各方面的性能进行不断地突破:如将变性高效液相色谱及量子点免疫层析技术与 PCR 技术相结合[50,58],提高了检测速度与灵敏度;将传统琼脂糖电泳替换成基于测序仪的荧光毛细管电泳,提高了分辨性[59-60],解决反应产物处理后的污染问题;将荧光基团引入引物扩增便于进行实时监测,改进了时效性[61]并避免相关物质的干扰。尽管现有PCR衍生技术自身仍存在不足,还需要在检测成本、稳定性等方面进行优化,然而在医学检验诊断中,这些方法因其具有的显著优势,仍将发挥重要的作用。总之,随着创造性地将PCR及其衍生技术与现代分子生物学检测新技术相结合,以及生物芯片、质谱、拉曼光谱等新技术的不断推广及检测水平的不断提升,PCR技术的限制正在逐渐被打破,在肠道病原菌检测方面的应用价值也得到了更大程度的体现,并在感染控制、卫生预防、食品安全监测等领域发挥着巨大作用。

