肝脾同治方对哮喘小鼠Th17/Treg及Foxp3/ RORγt的影响
徐 丽,郭振武,贾连群,张 哲,王 英,张会永,宋 囡,岳志军,李 然,王 巍,赵 娜,秦文艳,甘 雨,李 爽
(1.辽宁省中医药研究院,沈阳 110034;2. 辽宁中医药大学附属第二医院,沈阳 110034;3.辽宁中医药大学,沈阳 110032;4. 辽宁中医药大学附属医院,沈阳 110034)
支气管哮喘是由多种炎性细胞、结构细胞等共同参与的一种慢性气道炎症性疾病,是儿科最常见的变态反应性疾病。随着气候环境等因素的改变,其发病率呈逐年上升的趋势,严重影响儿童的身心健康,给家庭和整个社会带来了极大的负担[1-2]。支气管哮喘有着强烈的遗传免疫因素特点,T 淋巴细胞亚群表达异常与哮喘气道炎症反应相关。以往文献及课题组研究显示Th1 /Th2失衡是哮喘的重要免疫机制之一[3-4]。但随着国内外研究的不断深入,Thl/Th2失衡不能完全解释哮喘的发生机制,Thl7细胞和调节性T细胞(Regulatory Tcell,Treg)及其代表性细胞因子IL-17、IL-10等与哮喘的发生机制存在着明显相关[5-6]。RORγt是Thl7细胞分化的关键转录因子,Foxp3是Treg细胞调节功能关系密切的特异性转录因子,为进一步在Th17/Treg及转录后基因调控方面进行研究,本实验旨在探讨肝脾同治方是否与Th17/Treg及调控转录因子Foxp3/RORγt相关,观察肝脾同治方对哮喘小鼠免疫失衡及可能的作用机制,以期证实肝脾同治方是否通过调节转录因子Foxp3/RORγt的失衡从而发挥临床疗效。
1 材料
1.1 动物 SPF级雌性 BALB/c 小鼠70只,体量(19.3±1.1)g,鼠龄6周 [ 辽宁长生生物技术有限公司,SCXK(辽)2015-0001]。随机分为 6组:空白组、模型组、肝脾同治方低剂量组(简称低剂量组)、肝脾同治方中剂量组(简称中剂量组)、肝脾同治方高剂量组(简称高剂量组)、地塞米松组,10 只 /组。
1.2 干预药物 肝脾同治方:陈皮、苦杏仁、麻黄、川贝等中药共 121.5 g 减压浓缩到 250 mL,终浓度为0.486 g/mL,参考文献加水煎煮 3 次合并后过滤[7],低温放置备用。
1.3 试剂与仪器
1.3.1 主要试剂 氢氧化铝(国药集团化学试剂有限公司,批号:20141104);卵清白蛋白(OVA,美国 Sigma);高纯总RNA快速提取试剂盒(北京BioTeke公司);Primer设计合成(生工生物工程(上海)有限公司);SYBR Green (北京Solarbio公司);Super M-mLV反转录酶(北京BioTeke公司);2×Power Taq PCR MasterMix (北京BioTeke公司)RNase固相清除剂(北京天恩泽基因科技有限公司);小鼠IL-10、IL-17A、 TGF-β1酶联免疫试剂盒(美国R&D 分装);PBS 缓冲液(pH = 7.4)、生理盐水、蒸馏水实验室自制。
1.3.2 主要仪器 YLS-8A 多功能诱咳引喘仪(山东省科学院设备站);JJ2000Y 型电子天平(常熟市双杰测试仪器厂);微量移液器(芬兰BIOHIT公司,Proline);荧光定量PCR仪(韩国BIONEER公司,Exicycler96);超微量分光光度计(美国Thermo公司,NANO 2000);旋涡震荡仪(海门市其林贝尔仪器制造有限公司,QL-901)。
2 方法
2.1 模型复制 建立 OVA 诱导的哮喘小鼠模型[8-9]。致敏阶段:第1 天和第14天共2次,模型组与各药物组每次每只小鼠给予2 mg 氢氧化铝的混悬液0.2 mL与10 μg OVA腹腔注射,空白组给予生理盐水腹腔注射;激发阶段:第 28 ~34 天,空白组小鼠予生理盐水雾化吸入激发,其他组予 1% OVA 溶液雾化吸入激发,1 次/d,每次 20 min。模型复制过程中,低剂量组小鼠死亡 1 只,经解剖为腹腔注射操作不当导致动脉出血所致。
2.2 干预方法 在小鼠造模激发阶段,每次激发前30 min 称重,进行灌胃干预,干预药物、剂量及时间见表 1。

表 1 干预药物、剂量及时间

空白组 10 19.4±1.3 蒸馏水 - 实验第28天 7模型组 10 19.3±1.3 蒸馏水 - 实验第28天 7低剂量组 9 19.3±1.6 肝脾同治方 3.95 实验第28天 7中剂量组 10 19.3±1.6 肝脾同治方 7.90 实验第28天 7高剂量组 10 19.3±1.6 肝脾同治方 15.80 实验第28天 7地塞米松组 10 19.4±1.1 地塞米松片 1.56×10-3 实验第28天 7
2.3 标本采集 行支气管插管,用冰的 PBS 灌洗 3 次, 1 mL/次,回收率80% 以上为合格,离心,收集肺泡灌洗液上清液,于-20℃冰箱内冷冻保存。取下肺组织,生理盐水冲洗后,迅速置于液氮中冷冻,后-80℃冻存,备用。
2.4 ELISA 法检测血清 IgE、支气管肺泡灌洗液 IL-10 、IL-17A、 TGF-β1水平变化。Real-time PCR检测Foxp3/ RORγt基因表达:1)组织总RNA提取:根据试剂盒,各组样本数值在1.8~2.2之间,OD260/OD280 nm下检测。2)将提取的总RNA逆转录进行cDNA合成:反应体系:RT Primer(1 μM)1.2 μL,dNTP(2.5 mM each)0.75 μL,5×Buffer 4 μL,RNasin 0.25 μL,加ddH2O至总反应体系为19.8 μL。3)实时荧光定量PCR反应:Foxp3/ RORγt基因及β-actin内参基因引物顺序如下表2,反应体系:cDNA模板1 μL,上下游引物(10 μM)各 0.5 μL,SYBR GREEN mastermix10 μL,用ddH2O补足至20 μL。反应条件:95 ℃ 10 min,1 个循环;95 ℃ 10 s,60 ℃ 20 s,72 ℃30 s,40个循环, 25 ℃ 5 min,1个循环。本实验结果分析方法利用 2 - △△ CT 方法 。

表2 各基因引物序列
2.5 统计学分析 每组3个样本,每个样本设4个复孔平行实验,舍去误差较大数值,剩下数值的平均值作为最终保留数据,应用SPSS 17.0进行统计学分析。
3 实验结果
3.1 哮喘小鼠一般状态 空白组小鼠无明显症状,精神状态良好,呼吸平稳。模型组小鼠出现烦躁不安,易惊,毛色无光泽,头面部瘙痒,抓鼻抓腮,点头样喘息,呼吸急促困难,呼吸程度加深,有明显的腹式呼吸等哮喘发作症状[3]。
3.2 肺组织病理学观察 空白组肺泡形态结构完整,无炎症细胞浸润,管腔内无脱落的支气管上皮细胞及渗出物。模型组:肺泡壁变薄,排列紊乱,支气管及其伴行气管周围有大量炎症细胞浸润,支气管上皮黏膜脱落,黏膜褶皱增多,管腔内炎症分泌物增多,支气管管壁及气道平滑肌层明显增厚[3]。
3.3 各组 IL-17A、IL-10、TGF-β1的测定结果 见表3。
与空白组比较,模型组和各药物治疗组支气管肺泡灌洗液IL-17A、TGF-β1值显著升高(P<0.05),IL-10值显著降低(P<0.05);与模型组比较,各药物治疗组IL-17A、TGF-β1值显著降低(P<0.05),IL-10值显著升高(P<0.05)。
表3 哮喘小鼠IL-17A、IL-10、TGF-β1的测定结果(± s ) pg/mL
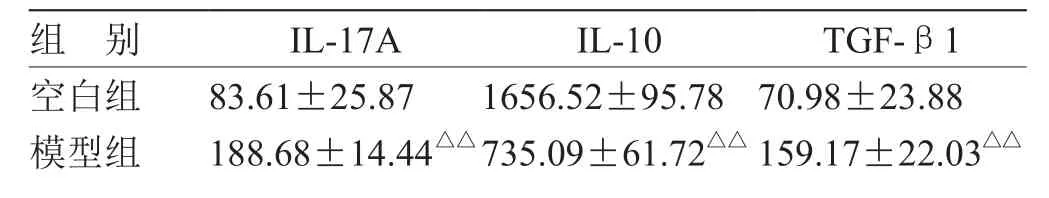
表3 哮喘小鼠IL-17A、IL-10、TGF-β1的测定结果(± s ) pg/mL
组 别 IL-17A IL-10 TGF-β1空白组 83.61±25.87 1656.52±95.78 70.98±23.88模型组 188.68±14.44△△735.09±61.72△△ 159.17±22.03△△

注:与空白组比较,△P<0.05,△△P<0.01;与模型组比较,# P<0.05,## P<0.01
3.4 小鼠肺组织中Foxp3/ RORγt的表达情况 与空白组比较,模型组Foxp3表达显著降低(P<0.05);与模型组比较,各剂量组、地塞米松组的Foxp3表达量显著升高(P<0.05);其中高剂量组Foxp3表达量最高。与空白组比较,模型组RORγt表达显著升高(P<0.05);与模型组比较,各剂量组、地塞米松组的RORγt表达量显著降低(P<0.05),地塞米松组RORγt表达量最低,高剂量组RORγt表达量低于其余剂量组,结果见表4。
表4 肺组织Foxp3/ RORγt mRNA表达的情况(± s )

表4 肺组织Foxp3/ RORγt mRNA表达的情况(± s )
组 别 n Foxp3 RORγt空白组 3 1.87±0.35 0.58±0.09模型组 3 0.92±0.15△△ 2.09±0.20△△低剂量组 3 1.08±0.02# 1.61±0.24##

注:与空白组比较,△P<0.05,△△P<0.01;与模型组比较,# P<0.05,## P<0.01
4 讨论
小儿哮喘是儿科常见的呼吸系统疾病,以反复的咳喘、呼吸困难等为主要症状[10]。哮喘的发病机制复杂,至今尚无完整学说可以阐明[11]。临床上,在非急性发作期时,多数情况下患儿咳喘表现虽然不重,但是存在症状消失缓慢、病程较长或者反复出现咳喘等情况,给患儿的学习生活带来诸多不便[12]。目前西医治疗常用糖皮质激素、白三烯受体拮抗剂等抑制哮喘炎症,但远期疗效并不满意,并且安全性存在一定的问题[13-14]。中医治疗本病具有独特的优势,根据小儿“肝常有余”“脾常不足”的生理特点及五脏相关理论,肝脾同治方用于治疗小儿哮喘,具有一定的理论基础和临床意义。哮喘慢性气道炎症发病机制复杂,促炎的Thl7细胞和抑炎的Treg细胞相互对立,相互制约以维持动态平衡,一旦Thl7/Treg平衡失调,Thl7分化增多,出现相关炎性反应的病理形式,导致哮喘的发生。本实验结果发现模型组小鼠IL-17A值显著升高,IL-10值显著降低,在某种程度上证实了Th17/Treg免疫失衡是哮喘慢性气道炎症的重要环节之一,与文献报道[15-16]哮喘小鼠IL-17A细胞数量增多而IL-10细胞数量减少结果一致。
Foxp3是Treg细胞特异的关键转录因子, RORγt是Thl7细胞分化必不可少的转录因子, Foxp3和RORγt最终决定了Treg/Thl7分化方向。Foxp3是转录因子forkhead/ winged-hellx(叉头样/翼状螺旋)家族的成员[17],Foxp3在调节性T细胞的发育和功能中起着决定性作用。RORγt是维甲酸相关核孤儿受体(retinoid-related orhan receptors,ROR)的家族成员之一,是Thl7分化的特异性关键转录因子,仅在淋巴细胞中表达,受STAT3的调控,RORγt的缺失会导致Thl7的分化缺失。
哮喘小鼠肺组织中RORγtmRNA高表达,提示小鼠在致敏原的刺激下,肺组织中单核巨噬细胞、上皮细胞等分泌大量的TGF-β,TGF-β是影响Thl7细胞分化过程中的关键的细胞因子,同时也是影响Treg分化的重要调节因子。在TGF-β等局部炎症的作用下,引起RORγt基因高表达,诱导初始T细胞向Thl7分化。IL-l7与上皮细胞、嗜酸性粒细胞、中性粒细胞等炎性细胞表面的IL-l7受体结合,进一步释放各种炎症因子、趋化因子,进一步促进炎症的发生。通过实验我们证实了哮喘小鼠慢性气道炎症与Foxp3/RORγt平衡一致的Treg/Thl7相关,哮喘小鼠Foxp3/RORγt转录因子的失衡表达,很可能导致Th0向Thl7优势分化,引起哮喘的免疫失衡状态。各剂量组均表现出Foxp3mRNA水平的升高和RORγtmRNA水平的降低,以高剂量组最为明显。提示肝脾同治方可能通过升高了血清中IL-10水平、降低血清中IL-17、TGF-β1水平,降低肺组织RORγtmRNA水平,升高肺组织Foxp3mRNA水平而起到良性调节Thl7/Treg平衡机制的效应,起到调节哮喘小鼠慢性气道炎症的作用。

