基于环境友好的酸浸煤矸石制备α-氧化铁研究*
刘成龙 ,李 艳 ,梁 浩 ,夏举佩 ,叶 飞 ,马新贤
(1.宁夏师范学院化学化工学院,宁夏固原756000;2.宁夏师范学院物理与电子信息工程学院;3.昆明理工大学化学工程学院)
α-Fe2O3(氧化铁红)是一种重要的化工原料[1-4],具有较好的物化稳定性,在颜色多样性、高遮盖力以及无毒性等方面亦有出色的性能,因此被广泛用于颜料、建材、橡塑、磨料、催化剂、传感和磁性材料等领域[5]。形状不同的α-Fe2O3导致其所具有的性质不同,故而其应用领域也不同,如球形α-Fe2O3的薄膜气敏性能比椭球形薄膜高[6],而棒状 α-Fe2O3催化形成的碳纳米管比颗粒状催化得到的纯度高[7]等。目前已制备出的不同形貌α-Fe2O3,除了常见的球形外还有很多其他形状,如针状、棒状、花生状、立方形、双椭球形、纺锤形等[8]。
α-Fe2O3制备方法有湿法和干法。湿法研究较多的有空气氧化法[9]、溶胶-凝胶法[10]、水热法[11]、强迫水解法[12]、吸附法[13]、微波法[14]等。 干法主要有激光气相法[15]、固相法[16]等。 研究发现,干法制备过程对设备的要求较高,且产品质量也无法与湿法相比,因此工业生产一般采用湿法制备氧化铁红。
中国生产的氧化铁红在全球总产量中占有较大的份额,因此对氧化铁红的生产进行不断的研究和改进,将更利于促进中国氧化铁红颜料产业稳定持久的发展。笔者将以固体废弃物煤矸石为原料,基于环境友好的绿色化工工艺对煤矸石进行酸浸,并以浸出的铁盐溶液为母液制备α-Fe2O3。该方法不仅能够提高煤矸石综合利用的附加值,而且对生产氧化铁红的原料在一定程度上起到辅助拓展的效果,也为固体废弃物煤矸石制备α-Fe2O3的绿色工艺提供理论和实验依据。
1 实验部分
1.1 原料和试剂
原料:煤矸石来自宁夏固原王洼某煤矿,其化学组成见表1。
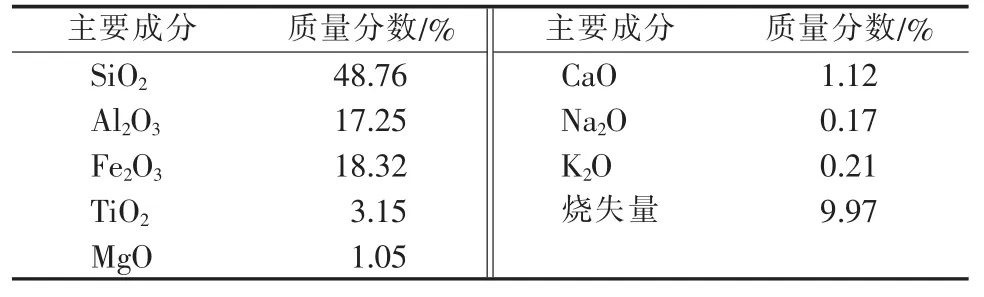
表1 煤矸石化学组成
试剂:硫酸、盐酸、磷酸、碳酸钠、氨水、乙二胺四乙酸二钠、二苯胺磺酸钠、氯化锡、氯化汞、重铬酸钾、焦硫酸钾、三氯化铁,均为分析纯。
1.2 实验方法
将煤矸石按照1∶5的固液质量比加入到质量分数为20%的硫酸溶液中,在80℃条件下反应1 h,过滤所得滤液作为制备液。取一定量制备液置于250 mL三口烧瓶中,置于恒温水浴中,滴加一定浓度的Na2CO3溶液并搅拌,同时通入空气,控制体系终点pH持续2 h不变,使滤液中的Fe2+转变为Fe3+进而形成Fe(OH)3凝胶,从而与 Al3+分离。 将 Fe(OH)3凝胶在室温下陈化4 h,洗涤、烘干、研磨,粉体经800℃煅烧1.5 h,即得α-Fe2O3产品。
1.3 检测方法
根据GB/T 1863—2008《氧化铁颜料》的要求对产品的相关性能进行分析。用D8系列X射线衍射仪对产品的物相进行定性分析。用S4800扫描电子显微镜观察产品表面的微观形貌,并用S4800扫描电子显微镜自带的能谱仪对产品的表面微区成分进行定性分析。
1.4 实验原理
通过控制制备液pH,使得体系中Fe3+与 Al3+通过分步沉淀的方法有效分离[17]。 查表得到Ksp[Fe(OH)3]=2.794×10-39,Ksp[Al(OH)3]=1.3×10-33,计算可知 Fe(OH)3沉淀 pH 范围是 1.31~2.80,而Al3+开始沉淀时所需pH为3.42,因此控制体系终点pH≈3.0,即可达到 Fe3+与 Al3+的分离。
2 结果与讨论
2.1 单因素实验
2.1.1 沉淀剂Na2CO3质量浓度及反应温度对产品纯度的影响
取150 mL制备液(Fe2+质量浓度为15.23 g/L),在反应温度为45℃、反应时间为1.5 h条件下,考察沉淀剂 Na2CO3质量浓度(25、40、55、70、85 g/L)对氧化铁红产品纯度的影响,结果见图1a。由图1a可以看出,随着Na2CO3质量浓度增加,产品纯度随之升高。当Na2CO3质量浓度从25 g/L增加到70 g/L时,产品纯度提高约10%。但是随着沉淀剂质量浓度继续增大,产品纯度出现降低趋势。这可能是由于沉淀剂浓度升高后,导致整个反应体系pH变化幅度较大,引起局部溶液产生凝胶过快而包裹其他杂质进而出现产品纯度下降。因此,选择沉淀剂质量浓度为70 g/L。
取150 mL制备液(Fe2+质量浓度为15.23 g/L),在Na2CO3质量浓度为70 g/L、反应时间为1.5 h条件下,考察反应温度(25、35、45、55、65 ℃)对氧化铁红产品纯度的影响,结果见图1b。由图1b可知,随着反应温度从25℃升高到45℃,产品纯度提高约15%。这是由于,在较低温度条件下Fe2+氧化反应速率较低,凝胶生成效率低,从而使产品纯度偏低;而升高温度后反应速率加快,凝胶生成效率高,从而使产品纯度提高。但是,继续升高反应温度反而使产品纯度下降。这是由于,温度偏高的体系中容易引起Fe2+与氢氧化铁凝胶晶核化合生成磁性氧化铁从而影响产品纯度。因此,选择反应温度为45℃。
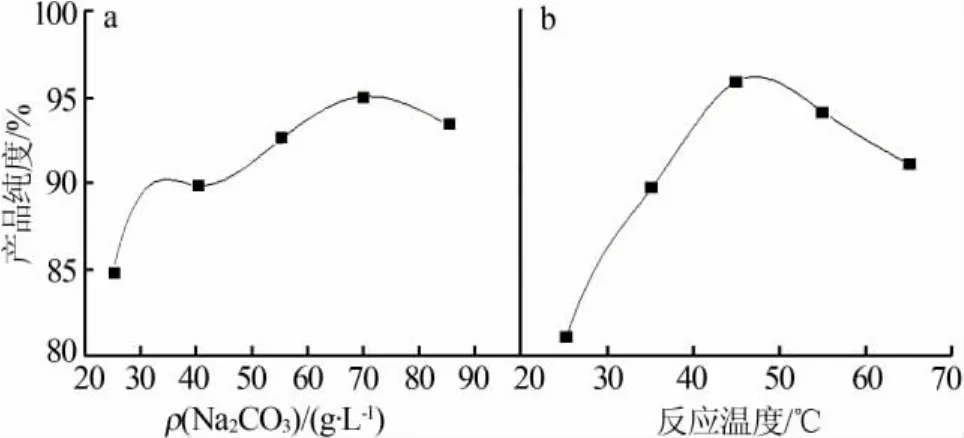
图 1 Na2CO3质量浓度(a)和反应温度(b)对氧化铁红产品纯度的影响
2.1.2 Fe2+质量浓度及反应时间对产品纯度的影响
取150 mL制备液,在反应温度为45℃、沉淀剂质量浓度为70 g/L、反应时间为1.5 h条件下,通过稀释或加入FeSO4调整体系Fe2+质量浓度,考察Fe2+质量浓度(7.92、11.80、15.23、18.06、21.39 g/L)对氧化铁红产品纯度的影响,结果见图2a。由图2a可知,随着Fe2+质量浓度从7.92 g/L升高到18.06 g/L,产品纯度提高约16%;之后随着Fe2+质量浓度继续升高,产品纯度下降。这是由于,在Fe2+质量浓度较低时,加入一定浓度的沉淀剂,使得凝胶快速生成,引起胶粒团聚过程中包裹体系中的其他杂质,影响产品纯度;当体系中Fe2+质量浓度过大时,加入沉淀剂导致大量凝胶在体系中生成,反应体系变得黏稠且将部分Fe2+包裹,不利于氧化反应充分进行,致使产品纯度出现下降趋势。因此,选择Fe2+质量浓度为18.06 g/L。
取150 mL制备液,在反应温度为45℃、沉淀剂质量浓度为70 g/L、Fe2+质量浓度为18.06 g/L条件下,考察反应时间(1.0、1.5、2.0、2.5、3.0 h)对氧化铁红产品纯度的影响,结果见图2b。由图2b可知,随着反应时间延长,产品纯度没有发生明显的变化。这是由于,体系涉及到的氧化反应达到平衡后转化率不再提高,因此反应时间过长对整个体系的反应并无好处。从节约时间和降低能耗方面考虑,选择反应时间为2.0 h。
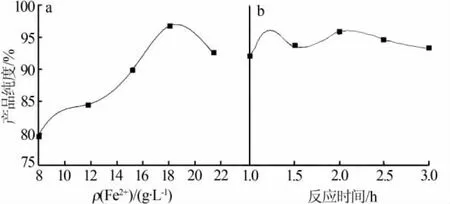
图2 Fe2+质量浓度(a)和反应时间(b)对氧化铁红产品纯度的影响
2.2 正交实验
以氧化铁红产品纯度作为考察指标,以沉淀剂质量浓度、反应温度、Fe2+质量浓度和反应时间为考察因素,在单因素实验优化点附近选取正交实验点,通过L9(34)正交表进行正交实验,对各因素进一步优化。正交实验因素与水平见表2,实验方案及结果见表3。

表2 正交实验因素与水平
表3结果表明,影响氧化铁红产品纯度的因素由大到小的顺序为CABD,最优制备条件为A2B1C2D2,即Na2CO3质量浓度为70 g/L、反应温度为45℃、Fe2+质量浓度为18.06 g/L、反应时间2.0 h。
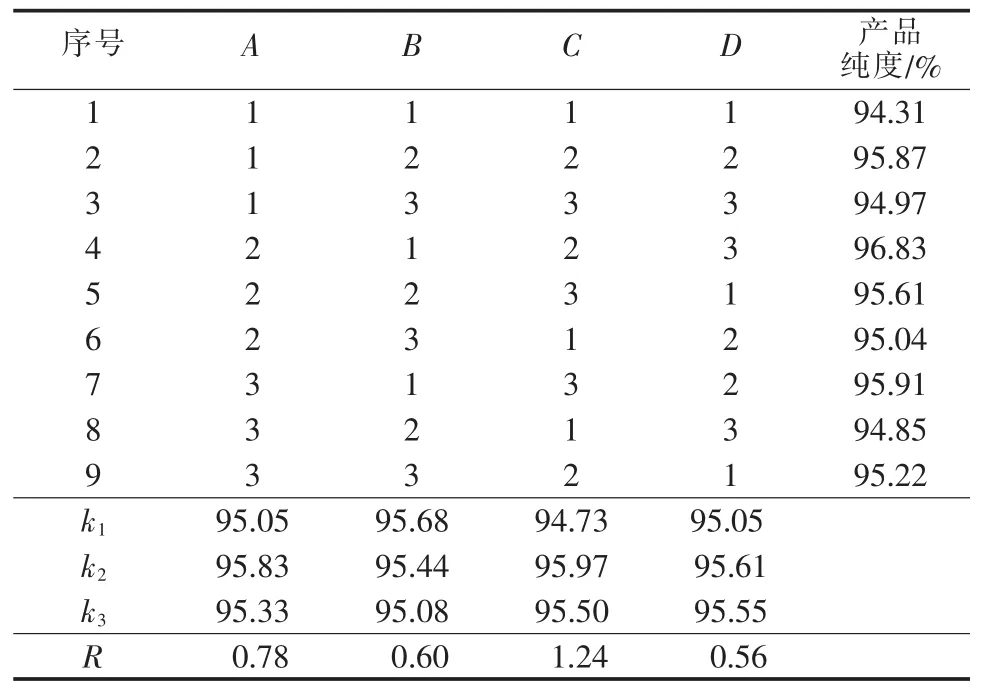
表3 正交实验方案及结果
按最优制备条件进行3次平行实验,结果见表4。由表4看出,氧化铁红产品纯度的平均值达到97.12%,均高于正交实验中的产品纯度。因此可以确定Na2CO3质量浓度为70 g/L、反应温度为45℃、Fe2+质量浓度为18.06 g/L、反应时间为2.0 h为产品最优制备条件。

表4 最优制备条件验证实验结果
2.3 产品分析与表征
将最优条件下制备的氧化铁红产品按照GB/T 1863—2008《氧化铁颜料》A级要求进行分析,结果见表5。由表5看出,氧化铁红产品Fe2O3质量分数为97.09%,其他指标也达到A级要求。

表5 氧化铁红产品分析结果
图3为氧化铁红产品XRD谱图。由图3看出,制备的氧化铁红产品出现α-Fe2O3特征衍射峰,峰宽度较窄、强度较强,表明制备的氧化铁红产品是结晶度较好的α-Fe2O3。
图4a、b为氧化铁红产品SEM照片。从图4a、b可以发现,产品的微观形貌为球形,经过点位EDS分析,结果与化学分析结果相一致(见图4c),进一步验证了采用GB/T 1863—2008《氧化铁颜料》A级方法对产品的分析结果。
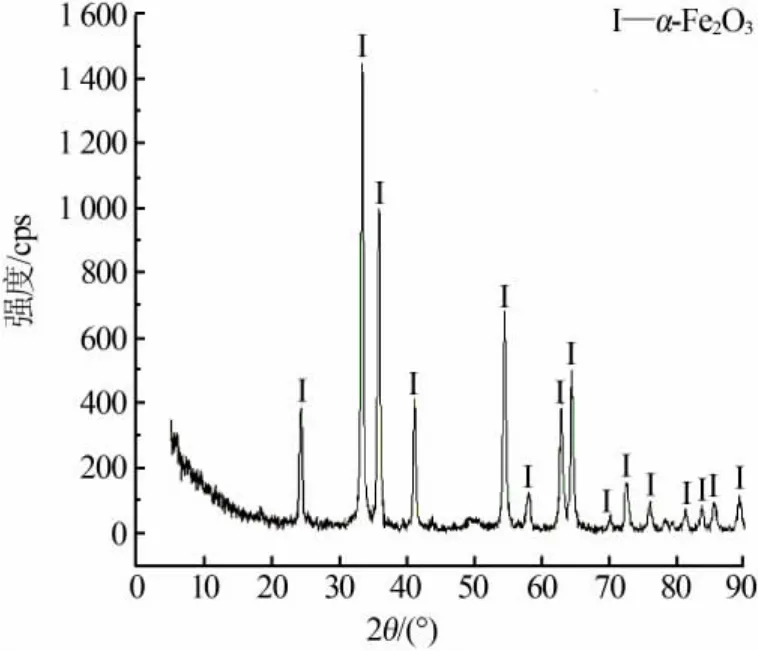
图3 氧化铁红产品XRD谱图

图4 氧化铁红产品SEM照片(a、b)及EDS图(c)
3 结论
基于环境友好的煤矸石资源化利用,采用低酸度浸出煤矸石中的有价元素,并以温和条件对浸出铁盐溶液进行氧化、沉淀制备氧化铁红产品。在单因素条件实验基础上利用正交实验优化了工艺条件,通过XRD、SEM和EDS等表征手段分析了产物的物相结构和外观形貌,得出以下结论。
1)优化工艺条件:Na2CO3质量浓度为70 g/L、反应温度为45℃、Fe2+质量浓度为18.06 g/L、反应时间为2.0 h。在该条件下制备的氧化铁红产品纯度达到97%,符合GB/T 1863—2008《氧化铁颜料》A级产品的要求。2)经800℃煅烧得到的氧化铁红产品是结晶度较好的α-Fe2O3,微观形貌为球形。3)采用低酸度浸出煤矸石中的有价元素,并以温和条件对浸出铁盐溶液进行氧化、沉淀、煅烧制备α-Fe2O3产品,符合绿色化工发展趋势,为煤矸石资源化制备氧化铁红产品提供了实验和理论依据。

