海洋酸化的生理生态效应及其与升温、UV辐射和低氧化的关系
高坤山
(厦门大学 海洋与地球学院,近海海洋环境科学国家重点实验室,福建 厦门 361102)
人类活动及矿物燃料的使用导致大气CO2浓度(以CO2分压(pCO2)表示)从工业革命(18世纪60年代)前的28 Pa升高至41 Pa (2016 年11月),增长了约46%,并仍以每年0.5%的速率继续增长[1],从而导致全球变暖,并引起海洋升温.同时,大量CO2溶入海水使pH下降,导致海洋酸化,扰动海水化学环境.另一方面,海洋升温使上部混合层变浅,导致该层内营养盐减少(由下向上的输送量减少),浮游生物接受UV辐射量增加(因为混合路径变短),且海水O2溶解度降低,引起全球海洋低氧化,并使缺氧区不断扩展.
迄今,有关海洋酸化的生物影响与生态效应研究多数基于单个种类、单种条件下的受控实验,而对生物群落和生态系统水平上的响应、多重环境震荡下酸化与升温的生理生态效应等方面研究极少[2].海洋全球变化直接或间接地影响生物代谢、生存及相关生态与生物地球化学过程,在不同海域产生不同的环境效应与生态效应,进而调控碳的汇源过程.因此,认知海洋酸化、升温与低氧化等多重环境影响下的生态系统过程变化并阐明相关机制非常重要,但目前仍存在技术与方法瓶颈[3].本文综述了海洋酸化、升温、UV辐射和低氧化及其叠加对生物的影响.
1 海洋酸化对生物的影响
自工业革命以来,随着大气pCO2的升高,海洋不断吸收人类排放的CO2,其吸收速率(平均)达每小时100万t以上[4],这对缓解全球变暖起着重要的作用,却使海水碱性下降而引起海洋酸化.目前海洋酸化速率是过去3亿年以来最快的[5].有关研究发现,距今2.52亿年前的海洋物种大灭绝与古海洋酸化事件相关[6].在浅海CO2喷口处,随着pH下降,生物量明显减少,生物多样性也降低[7].然而海洋酸化在多重环境压力下对不同物种、不同生态系统或过程的影响尚存在很大的不确定性[2],亟需研究其影响过程与机制以预测其影响趋势.
据预测,至21世纪末,海洋酸化将使上层海水平均pH下降0.4 (H+浓度升高150%)[8],近海水域pH下降0.45[9],危及海洋生物及生态系统服务功能[10].已有研究表明,胶州湾表层海水pH[11]和南海表层pCO2[12]存在明显的季节变化,南海近海及珊瑚礁系统的海水pH昼夜变动明显[13-14],渤海夏季低氧区pH与同年6月相比下降0.29(H+浓度增加1倍)[15].在2012年召开的第419次香山会议上,海洋酸化问题得到充分讨论,其对我国海洋生物与水产资源的潜在危害得到广泛关注[16].
1.1 对典型生物过程的影响
海洋酸化会减少珊瑚类的钙化及珊瑚礁系统的生物多样性[17],降低珊瑚礁系统的净钙含量[18];同时可降低造礁珊瑚藻类的钙化量[19-20]及贝类的钙化量与孵化率[21-22],使得太平洋牡蛎(Crassostreagigas)的血细胞凋亡和活性氧(ROS)增加,消化腺中的谷胱甘肽(GSH)水平降低[23].此外,海洋酸化可导致虾类触须变短、生长缓慢[24],提高浮游动物的呼吸速率[25],并影响其捕食率与消化功能[26];同时会增加有害物种的繁殖[27],恶化病毒对藻类的攻击[28],影响鱼类的嗅觉、听觉与视觉系统[29-32].
1.2 对浮游植物的影响
海洋光合生物同化将无机物合成有机物,发挥着重要的碳汇作用.在大洋海域58个站位2 000~4 000 m处的观测结果显示,以硅藻为主的浮游植物从真光层向深海的沉降速率为124~732 m/d[33].在南海不同水域,硅藻丰度决定浮游植物的丰度,是海洋生物碳泵的主要驱动者[34].海洋酸化可能降低硅藻的生物硅含量[35-36],进而影响浮游动物对硅藻的捕食率及粪粒量[37],因此海洋酸化可能通过影响硅藻的硅化作用而间接地影响颗粒有机碳的沉降量.在酸化条件下,南海表层硅藻丰度下降,单位水体或单位叶绿素的固碳量明显下降;且不同深度的硅藻类因受光量不同对酸化的响应可能不同,在低光下促进生长,而在高光下抑制生长[38].对海链藻属(Thalassiosira)不同种类的研究表明,近海水域的威氏海链藻(T.weissflogii)与分布在大洋的大洋海链藻(T.oceanica)对酸化的响应完全不同:酸化可促进威氏海链藻的呼吸作用进而提高其同化速率,但对其生长没有影响;而大洋海链藻的生长速率明显受到酸化的抑制[39].酸化还可使苯酚类毒性化合物在浮游植物细胞内和桡足类体内的含量升高,显示出潜在的食物链效应[40].
1.3 对异养细菌的影响
海洋异养生物,主要是不能进行光合作用与化能合成作用的细菌类,其降解有机物过程中释放的CO2可增强海水酸化[9].有关酸化如何影响细菌异化作用的问题目前尚缺乏科学认识[41].夏威夷ALOHA站的细菌生产力滞后于初级生产力1~2个月,对升温有明显的响应,却不受短期海水酸化的影响[42].然而,另有研究显示海洋酸化可使细菌消耗额外的能量,上调与质子泵相关基因的表达,可能会影响微生物碳泵效率[43].在亚热带沿岸富营养化水域,细菌群落结构则不受酸化的影响[44].尽管如此,pH的变化会影响细菌、藻类等与病毒的关系,从而影响物质生产及其降解过程,相关的生物地球化学过程也会发生变化.
1.4 对病毒的影响
早在20世纪30年代,研究者们就开始探讨病毒对pH变化的响应,发现有些病毒即使在pH<3时也不受影响,而另一些病毒在pH<7时则变得不稳定[45-47].关于海洋酸化对病毒直接影响的研究报道不多.在酸化对病毒与宿主相互作用的影响方面,感染聚球藻(Synechococcus)的病毒Cyanophage S-PM2的隐蔽期随着pH的降低而变长,而其潜伏期却正好相反,单位细胞裂解量也随pH的降低而下降[48].在真核藻类与病毒关系方面,当pH从8.1降到7.7时,病毒PgV可引起球形棕囊藻(Phaeocystisglobosa)的光合作用下降,呼吸作用升高,单位细胞裂解量下降;此外,酸化可使赫氏颗石藻(Emilianiahuxleyi)受病毒EhV感染后的裂解时间延长[49].
总之,海洋酸化会直接或间接地引起有机物同化和异化过程的变化,影响颗粒有机碳(POC)和溶解有机碳(DOC)的产量,因此,会使得海洋吸收CO2及碳输送量发生变化[50].然而,该假设需要在不同海域放大实验规模进行研究,认识机制并获得较可靠的量化指标进行集成分析后方能验证.目前存在如下几方面的趋势:1) 注重多种环境因子影响下的酸化效应;2) 注重海洋酸化的区域性影响;3) 注重不同尺度水平上的对比;4) 注重长期观测及生态系统过程的研究.
2 海洋升温对生物的影响及其与酸化的复合效应
自工业革命以来,大气中CO2的增加与全球平均升温呈线性相关[51].自20世纪70年代以来,海洋吸收了90%以上的地球热增量,导致全球变暖、海洋升温[8].海洋升温已经辐射到1 000 m深度[52].全球海洋表层平均温度在过去的100多年里升高了1 ℃左右[53];到21世纪末预计可增加2~4 ℃[8].过去20年间,厄尔尼诺事件发生明显变化,全球变暖1 ℃可导致台风事件增加高达25%[54].我国东海、南海边缘海域在过去50年间,与全球相比升温速度较快[55-56].
2.1 海洋升温对生物的影响
温度是影响生物代谢的重要因子.由于各种酶的活性在一定范围内与温度变化密切相关,生物代谢速率通常会随着温度的上升而升高,在达到最高值后又快速下降.海洋生物在不同时空尺度上经受着温度的连续性(昼夜、季节)或突发性变化,涉及到温跃层、潮汐、台风事件,云或太阳辐射的日变动,以及自然气候循环和人类活动影响所导致的长期变化[51].海洋升温影响生物的适温范围[57]及生理行为[58]可引起多种生物生态位的变化、优势浮游生物种群的季节性变迁、浮游生物群落结构的变化以及全球生产力格局的变化[59-60].如潮间带的贝类,夏季在高温时段耐受其他环境胁迫的能力下降,体内能量水平下降,相关调节因子的表达升高,但不足以应对热胁迫,最终大量死亡[61-62].贝类中苹果酸脱氢酶在不同温度下的稳定性和柔性变化,与其适应生境温度变化能力有关,决定了不同种类对升温的生理学响应及其分布[63].
光合生物在不同海域对升温的响应不同,随着海洋的全球性变化,初级与次级生产力正在发生变化[64].尽管升温在实验室或局部水域可促进浮游植物的生长[65],但从全球规模来看,海洋升温会导致初级生产力下降,异养微生物的降解作用加强,海洋碳汇量下降[64].连续50年(1960—2009)的观测发现,大西洋东北部和北海的甲藻丰度因为海洋升温而降低[66].在一个中尺度生态系统实验中,高温和高光强的叠加明显加速了春季藻华的爆发,也导致优势种群的改变[67].然而,这些现象的内因不一定完全与温度变化直接相关,可能是多种因素的复合效应.阳光辐射增强、平流层臭氧浓度降低(UV-B辐射增高)往往与温度升高同时发生,而温度升高会导致上部混合层变浅及该层内营养盐浓度下降,因而导致浮游植物生物量下降,群落结构中优势种向粒径小的方向演化[64].
异养细菌在海洋碳循环中起着重要的作用[43,68].对东海2000—2001年与黄海春、秋季的研究发现,细菌丰度与生产力主要受温度与溶解有机物的调控[69].然而,近期研究发现细菌生产力在南海水域受磷的限制[70],其代谢需要额外能量以应对海洋酸化[43].一方面,海洋升温会与其他环境变化发生复合或叠加作用,影响细菌生产力;另一方面,细菌的丰度又受病毒的调控.海洋升温会影响海洋病毒蛋白的结构、酶活性、膜酯等生物分子的弹性(如热变形、敏感性等)[71],而不同种类(甚至不同品系)的病毒,其生物分子组成和特性有所差异[72],温度变化对它们的影响程度也各不相同.在水温高于30 ℃时,多数噬菌体的量会下降[72].温度升高能增加环境中胞外酶(如蛋白酶和核酸酶)的活性,从而促进病毒的降解[73].
2.2 海洋酸化与升温对生物的复合效应
海洋酸化及全球变暖与人类CO2排放有密切的关联,进而影响生物地球化学过程及生态系统.近海生态系统在人类活动及海洋全球变化影响下也许会发生演变,然而这些可能的宏观变化需要机制性的阐释,以期提升预测的可靠性.为此,需要在研究单因子影响的基础上探讨双因子或多因子的复合效应.多因子的复合效应有时可同时发生,有时是序列性发生,其复合、叠加或促进效应取决于环境胁迫前后或同时发生的时间与持续时间的长短[74].
处于表层或上部混合层内的浮游生物,无论是近海还是大洋海域,均经受着昼夜与季节性的温度变化.海洋升温会影响表层温度的变化幅度,进而引起上部混合层变浅,由下向上的营养盐输送减少等.因此,上层海洋中的生物面临酸化、升温、营养盐减少(临近人类居住地的沿海水域除外)以及暴露UV辐射量增加等多重环境的胁迫.这些环境变化的复合效应是未来海洋环境科学研究的热点之一.
实验室研究显示酸化与升温对不同物种产生的生理生态效应不同.例如:对微微型浮游植物聚球藻和原绿球藻(Prochlorocoecus)的研究表明,升温与酸化协同促进了前者的生长,对后者却没有影响[75];酸化和升温4 ℃协同促进了硅藻类骨条藻(Skeletonema)的生长[76],却对海链藻、角毛藻(Chaetoceros)影响不明显[77];进行钙化作用的颗石藻类,在酸化与升温条件下生长速率下降[78];酸化和升温协同降低了赫氏颗石藻的最适生长温度与最大生长速率[79];在2~608 PapCO2范围内,升温可使赫氏颗石藻和大洋球石藻(Gephyrocapsaoceanica)颗粒无机碳(PIC)与POC的生产速率增加[80].就大型海藻而言,褐藻羊栖菜(Sargassumfusiforme)的呼吸系数在酸化条件下升高,暗示酸化和升温可协同提高呼吸速率[81].对造礁珊瑚藻类的研究发现,酸化导致其钙化量下降,升温则可进一步降低其钙质量[82].此外,酸化与升温可协同提高固氮蓝藻的固氮作用[83].在德国基尔海湾的研究发现,升温可导致浮游植物群落结构的变化,增加浮游动物的生物量;而在原位水温条件下,浮游动物受酸化的负面影响,捕食率降低,导致浮游植物的生物量升高[84].总体而言,酸化和升温的复合效应主要体现在酸化会降低生物对温度变化的耐受能力.如鹿角珊瑚Acroporapulchra的钙化速率受到温度与酸化的双重调控[85](图1).木珊瑚科的Balanophylliaeuropaea可在pH低至7.3的环境中维持较高的钙化作用,而在温度同时上升的情况下其钙化速率迅速下降[86].Reynaud等[87]在25 ℃考察柱状珊瑚(Stylophorapistillata)对pCO2升高的响应时未发现钙化率有明显下降,而在28 ℃时发现其下降了37%.可见升温与酸化效应可因生物种群、物理化学环境等不同存在区域性的差异,这种现象及其机制需要进一步探讨.
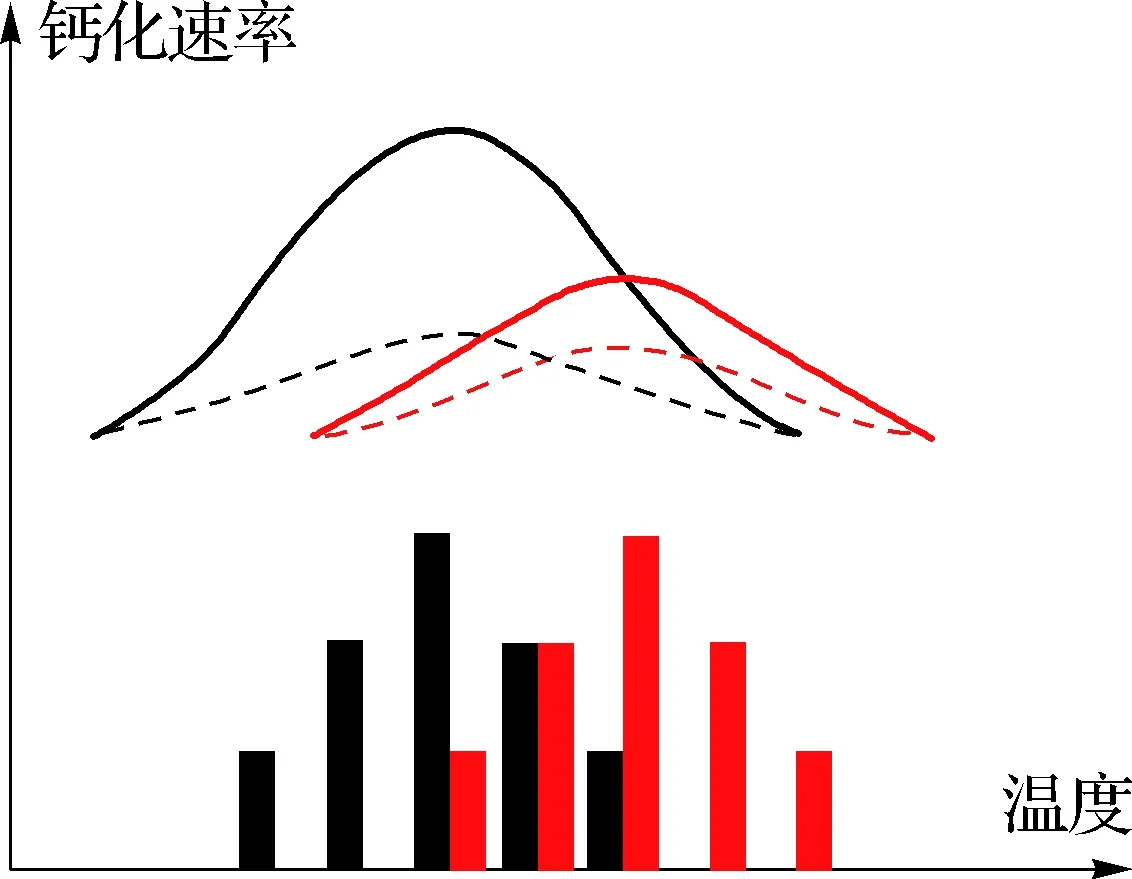
黑色代表南半球春季(2014年9—10月),红色代表南半球夏季(2015年1—2月);实线表示环境CO2浓度,虚线表示高CO2浓度/酸化状态(周洁根据文献[85]重建).
未来海洋对CO2的吸收取决于生物介导的碳汇与碳源过程,即依赖于生物的同化与异化作用.研究推测,海洋升温会影响海洋生物碳泵(MBP)和微型生物碳泵(MCP)及两者的相互作用[88-89].近期研究发现,酸化并没有影响浮游生物生态系统中DOC的组成[90],而是促进了POC的生产[91].有关酸化与升温是否会产生复合效应,进而影响DOC的组成和POC的生产,尚需在不同海域进行研究.海洋中的大部分DOC会通过细菌的裂解在短期内被转换为CO2,然而有部分DOC可抗细菌的裂解而长期(数百至数千年)存在,发挥着较稳定的碳汇作用[92].海洋酸化与升温对MBP和MCP的影响尚存在很大不确定性[8,88].因此,认识海洋生物的碳汇源过程以及同化与异化作用对酸化与升温的响应尤其重要.然而,迄今升温与酸化复合效应的研究结果多数是在单一条件或在实验室受控条件下获得,复合影响及其机制尚不清楚.
3 UV辐射对生物的影响及其与酸化的复合效应
阳光UV(280~400 nm)辐射对生物的影响可为正面、负面或正负相抵,表现出中性,这与辐射量、物种及其他环境状况有关.在亚热带地区,到达地面的UV-B(280~315 nm)辐射通常占阳光总能量的1%以下,UV-A(315~400 nm)与可见光(PAR,400~700 nm)分别占其7%~8%和40%~50%,红外辐射能量约占其50%;中午时段UV-B∶UV-A∶PAR约为0.5∶16∶100.UV-B受臭氧浓度变化的影响,而UV-A、PAR不受其影响;UV-B与PAR的比例与天顶角变化有关,早晚低,中午高,而UV-A与PAR的比例不受该影响,一天内持平.大气中的气溶胶及水中的有机物质均可消减这3种波段的阳光辐射.研究表明,平流层臭氧浓度每降低1%,到达地面的UV-B辐射量会提高2%[93].由于《蒙特利尔公约》的履行,臭氧破坏得到了遏制,平流层的臭氧在21世纪中期有望回到1980年以前的水平[94].然而其他因素的作用,如由全球气候变化引起的温度变化、痕量气体的存在与否[95]、大气环流模式的变化,都可能导致低纬地区的UV-B水平提高2%~3%[96].
在中国南海外海海域,PAR透射深度(真光层深度)超过80 m,UV-A和UV-B透射深度分别为50和38 m,可到达真光层深度的62%和47%.在汕头近岸海域,有些地方可见光透射深度仅为6~8 m;UV-A、UV-B透射深度分别为3.0~3.5 m和1.7~2.3 m,占真光层深度的50%和30%[97-98].在大洋海域,UV辐射可到达深度超过80 m[99].分布在上部混合层的浮游生物,通常均会暴露于阳光UV辐射下.然而无论是全球海洋通量联合研究(JGOFS)还是我国海洋调查规范,只要求在测定初级生产力等参数时采用透明容器,而普通玻璃或聚碳酸酯透明材料不透或仅透过少量UV-A辐射,因此迄今的多数调查研究忽略了UV辐射的效应.UV辐射对浮游植物固碳量的影响取决于水深和阳光辐射强度的高低,低或中水平的UV-A辐射可促进藻类固碳[97,100].UV辐射也是调控桡足类垂直分布的主要因子,并影响其水平分布[101].
UV辐射影响水域中的光化学与光生物学过程,其作用不容忽视[102].然而,室内实验或多数甲板培养实验忽视了阳光UV辐射的作用(非石英材质容器无法透过UV-B辐射),海洋酸化生理生态效应能否反映酸化的原位影响还有待于探讨[38].UV-A在低强度(阴天或较深层)时促进浮游植物的光合固碳,在高强度(晴天中午)时抑制其光合作用,而UV-B则始终导致损伤[97];UV辐射还可改变某些蓝藻的形态[103-104],损伤其DNA[104],并抑制钙化藻类的钙化作用[20,105].酸化与UV辐射叠加,进一步降低了钙化藻类的钙化作用[20,105-106].由于UV的透射深度可达80 m(南海外海水域可达50~60 m),PAR和UV的比例在不同深度明显不同,所以海洋酸化与阳光辐射对初级、次级生产过程的复合效应在不同深度会存在明显差异.
热带水域的浮游动物、亚热带水域的鱼类等均受到UV辐射的伤害,而其受影响程度与其他环境状态有关[102].在近岸海域,端足类通过摄食定生藻类获得UV屏障物质.尽管鱼类等游动性动物可以逃避UV辐射,然而其生殖细胞(卵、精子)及幼体仍受到UV辐射的影响.目前这方面的研究报道很少,有关酸化与UV辐射叠加影响的研究更少.
4 海洋低氧化对生物的影响及其与酸化的复合效应
海洋低氧化是指海水中溶解O2浓度(以O2分压(pO2)表示)下降的现象.该环境问题是由于升温引起的海水O2溶解度降低,上层海洋层化加重导致的表层向深层O2输送量减少,以及富营养化与生物耗氧量的增加等诸多环境变化叠加所致.无论是在大洋海域还是近海水域,pO2在过去50年均明显下降[107].
海洋中O2的消耗主要由呼吸作用与细菌对有机碳的降解所致.MBP将POC向深海输送的过程中消耗了O2,增加了CO2和营养盐.因此,海水pCO2的不断增加(海洋酸化)与微生物耗O2的叠加会在500~700 m深处形成生物死亡区[108](图2).过去50年间,在太平洋海域,缺氧(溶解O2质量浓度小于2 mg/L)深度从400 m减少到300 m,pO2明显下降[109],这与气候变化有密切关系[110].

黑色表示实际观测值,红色表示大气pCO2加倍情况下的估测值(根据文献[108]重建).
海洋生物与其他生物一样,代谢过程需要O2;当溶解O2低于一定浓度后,低氧胁迫会导致其死亡.不同生物的半致死溶解O2质量浓度不同,可相差几倍或十几倍,较典型的缺氧区溶解O2质量浓度在2 mg/L以下.通常缺氧现象与温度和pCO2有关(低氧区往往pCO2较高而pH较低),如温跃层下溶氧量少、pH低.近岸海域由于海洋低氧化与富营养化相互作用,缺氧区正以每年约5.5%的速率增加[111];且与海洋酸化叠加后导致酸化的速率比大洋海域快[9].另外,低氧化会促进反硝化作用,减少硝酸根离子的量,影响海洋的氮循环、初级生产力及MBP效率.然而海洋低氧化如何影响各种生物(尤其是光合生物)的代谢及关键生态过程,目前科学界认识甚微.
伴随着海洋酸化、升温等,海水pO2和pCO2的比值越来越小,且在深层海水中变化得更快[108];其次,物理混合过程引起深层海水向表层输送,也影响了真光层内pO2和pCO2的比值;再者,上升流区的物理与化学环境受大气pCO2升高及相关气候变化的影响也在不断发生变化,如在加州海岸上升流区,pO2和pCO2的比值不断下降,对当地的贝类养殖造成重大经济损失,浮游动物的现存量也在不断减少[112].显然,这些生态与经济效应,除了与pH变化有关外,还与海水pO2和pCO2的比值变化相关.
海洋低氧化与酸化均会影响POC与PIC的生产量,也会影响浮游动物及底栖生物的生理活性.理论上看,pO2降低或pCO2与pO2比值增大均有利于光合固碳酶的羧化作用,并下调该酶催化的氧化作用,因此,pCO2与pO2比值的变化会影响藻类的光合作用[113].低氧、酸化或pO2与pCO2比值的降低会对光合固碳、呼吸、光呼吸、生长及钙化作用产生复合影响.此外,浮游动物响应酸化胁迫,增加其呼吸作用的同时增加了其摄食率[25].因为海洋低氧化也会影响动物的呼吸作用,所以低氧与酸化必然产生复合效应,影响生物的呼吸作用及其能量供给平衡.
5 展 望
海洋酸化与全球变暖是由人类碳排放引起的,同时也是当今社会面临的两个重大环境问题,威胁海洋生态系统.为此,对其生态学效应的研究已经在全球广泛开展.酸化对POC生产的影响尚有争议,不同区域研究展现的生态效应不同.有报道酸化对异养细菌没有影响,也有报道其影响它们的代谢及基因表达;关于升温与酸化的复合效应,有报道叠加的,有报道没有复合效应的,也有报道有拮抗作用的.这些争议性较大的研究结果大都基于实验室受控条件下的实验,难以反映自然环境震荡下升温与酸化的影响,不能阐明多重环境变化的复合效应[3].
生态系统中生物生产与异化作用,受酸化与升温的复合效应,可能是叠加、增效或拮抗,与自养和异养生物代谢、群落结构及多重环境压力有关.东海航次观测与甲板实验显示,浮游植物释放的二甲基硫量与叶绿素浓度呈现正相关,其降解在UV-B辐射和低pH影响下加快[114].显然,海洋初级、次级生产过程、生物的异化作用及有机物的光降解等受多种环境因子的影响,如何在震荡或接近原位复杂环境条件下开展升温与酸化效应的研究,目前面临技术上的挑战.
海洋酸化中尺度生态系统实验类似于海洋中的围隔实验,可在原位环境震荡或变化条件下研究酸化的生态效应.这类中尺度水平的实验在德国、挪威、比利时、美国(借用德国的设施)、中国(厦门大学等)、秘鲁(借用德国的设施)、韩国、西班牙等国家均有开展.德国、挪威及比利时等国家的科学家使用27 t海水的中尺度实验设施,发现pCO2升高增加了浮游植物的固碳量,使其有机碳氮质量比增加了30%以上,降低了其饵料价值[115];另有研究使用50 t海水的中尺度实验设施,发现酸化没有影响浮游生物生态系统中的溶解无机碳组分[90].韩国学者使用2 t海水的中尺度实验设施,发现pCO2升高仅促进了中肋骨条藻(S.costatum)的生长,而对其他浮游植物类群影响不明显[116].我国科学家使用4 t海水的中尺度实验设施,发现pCO2升高可使浮游植物细胞内苯酚类毒性物质含量升高,且使捕食这些浮游植物的桡足类体内苯酚类含量也升高[40];此外,初级生产力与细菌生长效率也明显升高[117].然而,升温效应的中尺度实验因水量大、温控难度高,基本没有开展(有用电热棒加热的,但加热棒局部温度很高,不理想).总之,中尺度生态系统实验由于用水量大,升温与酸化控制技术难度大,运行成本高,至今在全球开展的次数有限,有待于在不同地区进一步开展.
在海洋酸化、升温、低氧化及UV辐射等多重环境胁迫下,生物的栖息地或水域正在退化或缩小.根据已有的科学认知可以建立如下科学假设,即栖息地或可栖息水域退化假说(图3):可垂直游动的生物为躲避较高水温或UV辐射向下移动,然而温跃层以下低氧和酸化的海水又会对其增添新的环境胁迫,其结果导致这类生物可栖息的水域缩小或栖息地退化.这可能是导致近年来典型渔场捕鱼量下降的主要原因.这一假说还需要在开展受控实验的同时结合原位调查数据进行验证.
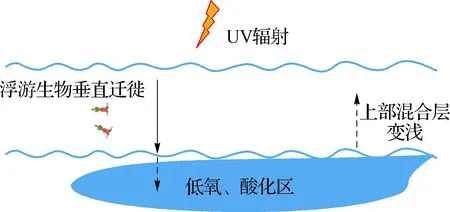
图3 栖息地退化假说示意图

