人工智能CT定量分析肺磨玻璃密度结节初探
孙炎冰 陶广昱 陈群慧 叶剑定 马骁杰 叶晓丹
肺磨玻璃密度结节(ground-glass opacity nodule,GGN)是指在CT肺窗影像上表现为云雾状密度增高结节灶,病灶内血管和支气管影仍清晰可辨;而在纵隔窗图像上不能显示或仅能显示病灶的实性成分[1]。随着高分辨率CT在临床的广泛应用,肺GGN的检出大大增加。肺GGN是一种非特异性的影像学表现,产生的病理基础多种多样,如炎症、出血、局灶性纤维化和肿瘤等。直径较小的病灶,形态学特征不甚明显,诊断和治疗方案的制定有一定难度。
本研究利用前沿的人工智能图像识别技术来分析处理肺部磨玻璃结节的超高分辨率CT图像。在以往传统的形态学表现和阅片者的主观经验对病灶进行分析的基础上,采用非传统的分析方法来研究CT定量参数和随访后的参数变化,通过与病理证实的恶性磨玻璃密度肺结节相对照,为随访稳定的肺结节临床处理方案提供定量依据。
方 法
1.患者资料
收集本院从2015年1月至2017年7月79名患者共91个接受手术或两次以上高分辨率CT随访的肺GGN患者的资料,经病理证实28个GGN为手术病理证实恶性,1例为穿刺证实恶性,62例为经定量参数测定判断为随访稳定。肺结节患者的纳入标准如下:①肺结节直径<20mm;②磨玻璃密度成分>50%。
2.CT扫描方法
取仰卧位,头先进,应用Philips Brilliance 64层螺旋CT、Philips iCT、联影16层螺旋CT进行扫描。范围从肺尖至肺底的全部区域,两侧包括胸壁、腋窝。扫描参数:120或140kVp,250~300mA,扫描时间5~7秒,SFOV360~400mm,重建层厚5mm,重建间隔5mm,滤过函数C,CFOV363mm,图像矩阵512×512,影像重组采用标准算法。所有患者均行平扫,无对比剂注射。用于人工智能计算机辅助测定的CT影像经0.625~1.25mm层厚、无间隔重建,肺窗(窗位-520HU,窗宽1450HU)识别病灶。
3.CT图像分析
将患者的DICOM影像导入计算机辅助定量参数测定系统,由单箱探测器(single shot multibox detector, SSD)物体检测模型将检测和识别两个阶段整合到一个端到端的网络上,对DICOM影像数据预处理、SSD模型训练和最终的结节测算。自动勾勒结节边缘后计算三维状态下结节长径、短径、最大截面积、体积以及CT值定量参数,包括最大CT值、最小CT值、平均CT值、CT值偏度、峰度、10%CT值百分位数、20% CT值百分位数、30% CT值百分位数、40% CT值百分位数、50% CT值百分位数、60%CT值百分位数、70%CT值百分位数、80%CT值百分位数及90%CT值百分位数。
4. 病理检查
手术标本经4%中性甲醛固定液固定24小时后,石蜡包埋,常规HE染色制片。肺腺癌按照2011年IASLC/ATS/ERS肺腺癌新分类标准将所有病灶分为:①浸润前病变:包括不典型腺瘤样增生(adenomatous atypical hyperplasia, AAH)和原位腺癌(adenocarcinoma in situ, AIS);②微浸润腺癌(minimal invasive adenocarcinoma, MIA):病变≤3 cm,肿瘤细胞完全沿肺泡壁生长且伴有浸润灶最大径≤0.5 cm的小腺癌;③浸润性腺癌(invasive adenocarcinoma, IA)。
5. 统计学方法
所有计量资料数据均以平均数±标准差表示。不同病理组别的CT参数指标的比较用方差分析方法检验差异的统计学意义。用受试者曲线(ROC)分析方法确立合理的CT参数阈值。P<0.05认为差异有统计学意义。所有统计学处理均由SPSS软件完成。
结 果
最终纳入本研究的79名患者中,男性患者29名,女性50名,年龄范围27~80岁,平均年龄(54.9±12.2)岁。其中,单发结节患者69名,两枚结节患者9名,4枚结节患者1名,肺结节共计91枚。结节根据2011年IASLC/ATS/ERS肺腺癌新分型标准,本组资料包括AAH病灶3枚,AIS病灶8枚,MIA病灶8枚,浸润性腺癌病灶10枚,包括贴壁为主型2枚,腺泡为主型4枚、乳头为主型4枚;随访稳定肺结节共计62枚,随访平均时间为18.1个月。表1总结了病例的临床特征。图1演示了病例定量参数获取途径。
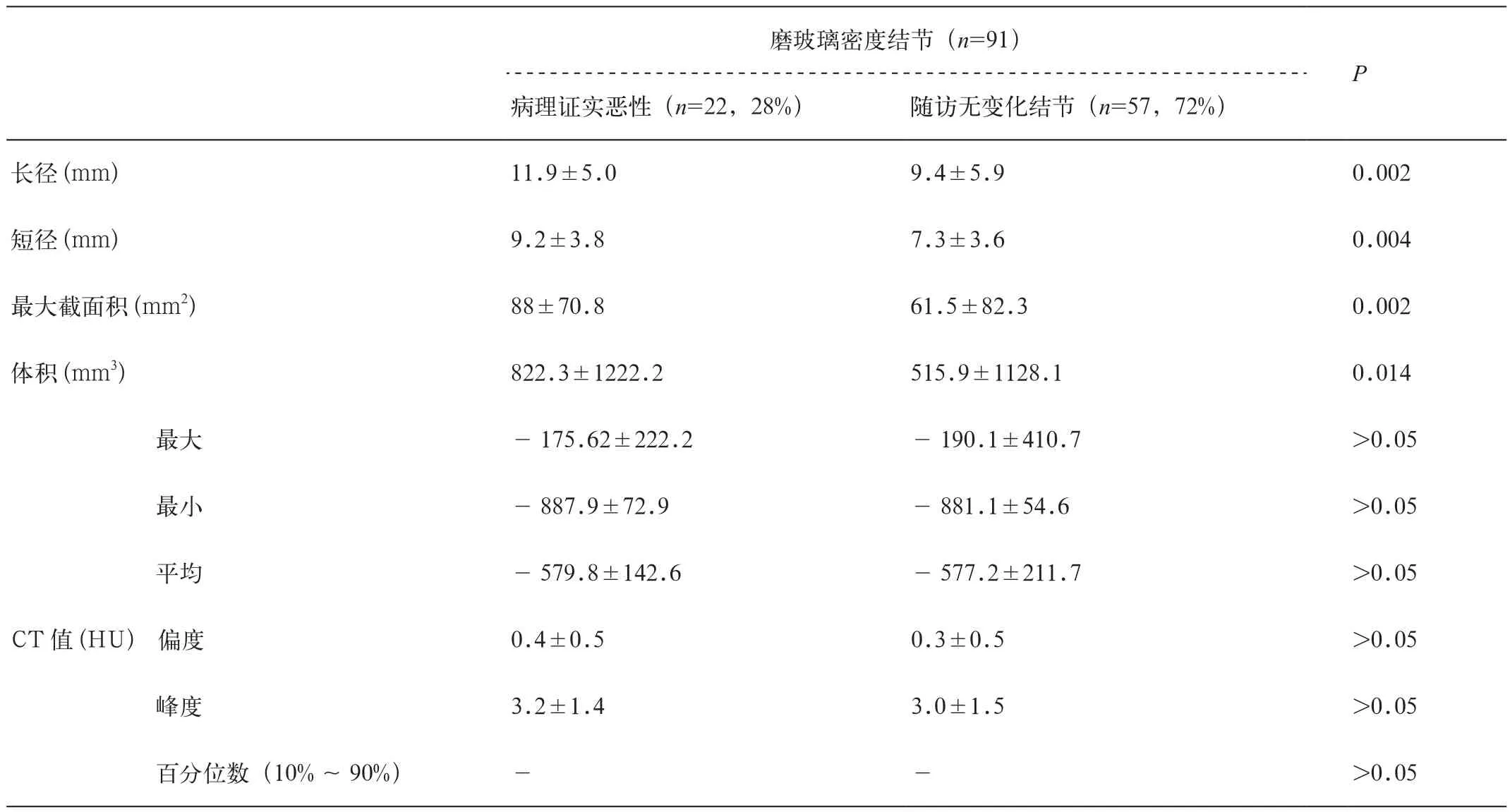
表2 磨玻璃密度结节定量参数特征

图1 计算机辅助定量参数测定系统分割、测算肺结节定量参数。
经过计算机人工智能定量分析,本组资料中两组数据的定量参数分别如下。
在病变灶大小方面,病理证实为的恶性病变的长径(11.9±5.0)mm、短径(9.2±3.8)mm、最大截面积(88±70.8)mm2、 体 积(822.3±1222.2)mm3均大于随访无变化结节:长径(9.4±5.9)mm、短径(7.3±3.6)mm、最大截面积(61.5±82.3)mm2、体积(515.9±1128.1)mm3。
在病变整体密度值定量分析中,病理证实为的恶性病变的CT值定量参数,与随访无变化结节的CT值定量参数比较无统计学差异(表2,图1)。
讨 论
虽然肺癌的5年生存率低于16%[2],但I期肺癌患者经胸腔镜手术(video assisted thoracic surgery, VATS)后的5年生存率可达97%[3]。所以肺癌的早期诊断,尤其是IA期肺癌准确的早期诊断,就显得至关重要。研究表明,磨玻璃结节(ground glass nodule, GGN)与早期肺癌的关系密切,其可为早期肺癌的一种表现形式。表现为磨玻璃密度的肺恶性肿瘤发生发展过程依次为不典型腺瘤样增生、原位腺癌、微浸润腺癌、浸润性腺癌[4]。不典型腺瘤样增生通常为直径较小的纯磨玻璃影。文献表明,磨玻璃密度肺癌从纯磨玻璃时期生长为浸润性腺癌可以长达10年以上的随访期[5]。
而较小的磨玻璃密度结节部分由于形态学特征不显著,在处理方案的制定和治疗时机的把握上仍然是目前临床亟待解决的问题。对磨玻璃密度结节做出正确处理,对于减轻患者和社会负担、改善患者预后都非常重要[6]。目前,已有一些关于磨玻璃密度结节的研究在形态学特征和密度分析方面的研究[7-8]。
现阶段,结节大小和生长速度仍然是国际指南中最常用的预测肿瘤性质并制定处理方案[9]。由于观察和测量大多选用传统的形态学征象判断、目测纯磨玻璃成分占比、轴位单层最大径、多层最大径取平均值等定性、半定量或定量方式,受到阅片医师临床经验和测量误差等主观因素影响,观察者之间差异较大,研究的可重复性不强。
本研究采用人工智能定量分析结节的方式,在薄层高分辨率影像上(矩阵1024×1024、标准算法重组),于三维状态下计算结节整体的尺寸和密度定量参数。对结节形态特征和组织空间分布的定量特征进行精准分析,可重复性强,一定程度上避免主观性大,可重复性差,阅片者间的差异大等欠缺。
本组结果中,尺寸信息,包括最长径、短径、最大截面积和体积的测量值在病理证实为恶性的磨玻璃密度结节和随访稳定的磨玻璃密度结节有显著差异,恶性病灶的长径、短径、最大截面积和体积均大于随访稳定组。本组恶性结节的平均长径和短径分别为(11.9±5.0)mm、短径(9.2±3.8)mm,与MacMahon等[1]、Detterbeck等[10]认为“直径大于10mm的磨玻璃密度结节半数为恶性”的研究结果相仿。
而在本组数据中,最大CT值、最小CT值、平均CT值、CT值偏度、CT值峰度、各百分位数值在两组中的差异无统计学意义。CT值参数在磨玻璃密度结节诊断中的价值,目前的研究结果不尽相同。在对磨玻璃密度影中实性成分直径与恶性病变侵袭性的相关性研究中,研究者发现,纵隔窗测得实性成分5mm可以作为鉴别微浸润腺癌和伏壁为主的浸润性腺癌的阈值。但是,有病理-影像对照研究发现这两者在磨玻璃成分上的差异不仅由于其浸润性不同,也受到肺泡腔塌陷等因素的影响。陈群慧等[11]和Zhang等[12]发现磨玻璃密度结节中实性成分和恶性程度呈正性相关。
随访稳定结节的平均随访时间为18.1个月,约合545天,绝大多数良性磨玻璃密度结节倍增时间>450天,绝大多数恶性磨玻璃密度结节的体积倍增时间<400天,随访稳定结节为良性病变的可能性较大。本组数据中,随访稳定的磨玻璃密度结节尺寸参数均小于恶性磨玻璃密度结节,长径、短径、最大截面积和体积分别为(9.4±5.9)mm、(7.3±3.6)mm、(61.5±82.3)mm2、(515.9±1128.1)mm3。虽然尺寸是区别良、恶性磨玻璃密度结节的重要特征,也是随访的主要依据[1],但是Wu等曾提出≤10mm的磨玻璃密度结节也可以是浸润性病变[13]。
本研究仍存在一些局限性。一方面,样本量较少,且受恶性病灶样本量的限制未进一步将病灶依据2011年IASLC/ATS/ERS肺腺癌新分型标准将浸润前病变(包括AAH、AIS)、MIA和IA分别分组,存在一定的偏倚;另一方面,病例分组是依据获得恶性病灶的病理标本和随访无明显增大分为两组,而在有限的随访时间内,可能存在部分恶性肺结节处于非活跃期,生长缓慢或静止导致随访无明显变化从而引起分组的偏差。有待进一步扩大样本量和完善随访资料进一步研究确定。
综上所述,CT定量参数评价病灶尺寸定量参数测定有助于恶性结节判断,从而为磨玻璃密度肺结节预测临床治疗时机提供依据。

