红枣多糖不同组分理化性质及抗氧化活性分析
陈胜发,顾国强
(1.杨凌职业技术学院,陕西 杨凌 712100; 2.山东步长神州制药有限公司,山东 菏泽 274039)
饲料是家畜生长发育的物质基础,饲料中各类养分常常会受到各种因素的影响会发生氧化现象,导致营养价值降低。家畜采食氧化的饲料后,会产生有毒有害物质,引起不良症状[1]。红枣为鼠李科枣属植物(ZizyphusjujubaMill.)的成熟果实,红枣中不仅含有极其丰富的营养物质,还具有多糖类、皂甙类、萜酸类、黄酮类、多酚类、腺苷类等多种功能性植化成分[2],其中多糖是红枣中重要的生物活性物质,具有抗肿瘤、降血脂、抗病毒、抗氧化、抗溃疡等作用[3],现已应用在家畜饲料配方中,防霉效果显著,表现出一定的可行性[4-5],目前红枣多糖的研究主要集中在提取工艺的优化及药理活性的研究上,红枣多糖的理化性质及其体外抗氧化活性研究较少[6-8]。本文以红枣为原料提取红枣多糖,测定各单糖组成和分子量大小,为进一步研究红枣多糖结构与抗氧化活性的关系提供理论依据,同时也为以红枣开发绿色安全的家畜饲料添加剂奠定基础。
1 材料与方法
1.1 仪器与试剂
紫外分光光度计:上海光谱仪器有限公司;2014C气相色谱仪(FID检测器):日本岛津公司;JD400-3型电子分析天平:沈阳龙腾电子有限公司。
红枣药材购于西安万寿路药材市场,甲醇(四川西陇化工有限公司);DPPH·、ABTS·+、单糖标准品;Sigma公司;硼氢化钠、正丙胺,阿拉丁试剂公司;DEAE Sepharose Fast Flow,GE公司。
1.2 红枣多糖(ZSP)提取
取去核红枣细粉,无水乙醇脱脂,取脱脂枣粉90 ℃水提,冷却浓缩离心,上清液加入4倍体积的95%乙醇 4 ℃过夜,4 000 r/min 离心 15 min 得沉淀,即为红枣多糖[9]。
1.3 红枣多糖的分离
称取一定量的红枣粗多糖(ZSP),溶于适量蒸馏水中,离心10 min,取上清液上样。经过DEAE-Sepharose Fast Flow柱子,依次用0、0.2、0.3 M的NaCl洗脱,得到3个红枣多糖组分:ZSP-1,ZSP-2,ZSP-3。
1.4 指标测定
1.4.1 糖含量测定 采用苯酚-硫酸法测定总糖含量[10]。
1.4.2 分子量测定 采用高效凝胶渗透色谱法(HPGPC)测定红枣多糖各组分平均分子量。样品处理:1 mg样品溶于1 mL流动相,离心(10 000 r/min 15 min),0.22 μm滤膜过滤后上样;色谱条件:色谱柱:TSKgel 5 000 PWXL 7.5 mm*30 cm 加保护柱(TSK gelguard column PWxL);液相:Waters 1 500 Series HPLC;检测器:折光示差检测器(waters 2414);柱温:30 ℃;流动相:0.2 mol/L NaCl(20 mmol/L pH6.0 磷酸盐缓冲液);进样量:10 μL;流速:0.5 mL/min[11]。
1.4.3 单糖组成的测定 采用气相色谱法测定红枣多糖各组分的单糖组成。称取10 mg的粗多糖,用三氟乙酸法进行水解、衍生、用二氯甲烷定容、过0.45 μm的滤膜,上机测定。气相色谱条件:升温条件为:180 ℃(2 min)-6 ℃/min,210 ℃(2 min)-0.3 ℃/min,215 ℃(20 min)-6 ℃/min,240 ℃(10 min),分析时间60 min,进样口温度250 ℃。色谱柱为DB-17柱,柱温180 ℃,FID温度250 ℃,进样量1.0 μL[12]。
1.4.4 DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除力测定 参照Dou et al.的方法,用甲醇配制DPPH自由基工作液。分别取1 mL不同浓度(0.5、1、1.5、2、2.5 mg/mL)的样品溶液,加入1 mL DPPH溶液,避光30 min,在517 nm处测定吸光度Ai,同时以2 mL甲醇作空白,1 mL DPPH与1 mL甲醇为对照测其吸光度为Aj,并以抗坏血酸作为阳性对照。根据以下公式求得DPPH清除率。
C=(1-Ai/Aj)×100%。式中:C为DPPH自由基清除率,Ai为试验组吸光度值,Aj为对照组吸光度值[13]。
1.4.5 ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)自由基清除力测定 参照李青等[14]的方法提前配置ABTS自由基储备液。ABTS自由基储备液用甲醇稀释成在734 nm波长下的吸光度为0.70±0.02。分别取不同浓度(0.5、1、1.5、2、2.5 mg/mL)样品溶液200 μL,加入ABTS稀释液3 mL,振荡后避光反应6 min,734 nm处测吸光度。空白组为甲醇,对照组为3 mL ABTS工作液与200 μL甲醇。按公式计算ABTS自由基清除率,并以抗坏血酸作为阳性对照。
C=(1-A1/A0)×100%
式中:C为ABTS自由基清除率;A1为试验组吸光度值;A0为对照组吸光度值。
1.4.6 抗还原力(FRAP)值测定 参考黄菲等人的方法配制FRAP试剂。取1 mL的样液与4.5 mL的TPTZ(2,4,6-三吡啶基三嗪)工作液混匀,避光处理30 min后,在593 nm测吸光度。以FeSO4·7H2O为标准品做标准曲线,样品的抗氧化能力以FeSO4·7H2O含量 (μmol /L ) 表示[15]。
1.5 数据分析
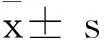
2 结果与分析
2.1 总糖含量
采用苯酚-硫酸法测定糖含量,得到标准曲线为Y=6.725X-0.0314(R2= 0.9991),红枣粗多糖(ZSP)中糖含量为37.29%,用DEAE层析柱从ZSP中分离出三个组分ZSP-1,ZSP-2,ZSP-3, 其糖含量分别为89.34%,64.26%,64.16%。
2.2 平均分子量的测定
本研究采用高效凝胶色谱法测定红枣多糖的分子量,以葡聚糖为标品,其标准曲线为:Log(Mw)=-0.3259x+10.94(R2=0.9938)。各组分分子量,分别为ZSP 7.69×105Da,ZSP-1 7.28×104Da,ZSP-2 1.29×105Da,ZSP-3 1.70×105Da;与Chang等[16]的研究红枣多糖分子量(40,570-129,520 Da)相符合。
2.3 单糖组成分析
由表1知,ZSP经气相色谱分析,结果表明ZSP多糖的单糖组成为半乳糖醛酸、阿拉伯糖、木糖、半乳糖、鼠李糖、甘露糖、葡萄糖,其相对摩尔比是5.40∶2.47∶2.27∶1.57∶1.46∶1.12∶1.00,木糖和半乳糖醛酸含量较高,是一类组成复杂、结构多样的杂多糖。
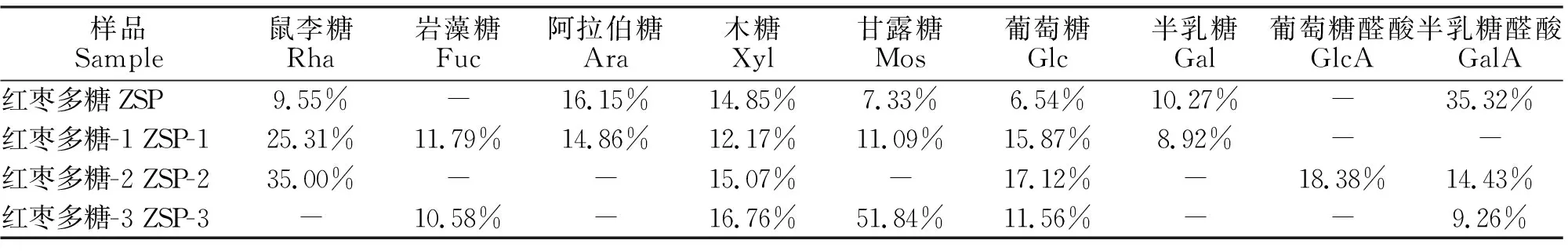
表1 红枣多糖的单糖组成Table 1 The monosaccharide composition of polysaccharides
ZSP-1是由鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖组成,不含糖醛酸,是中性杂多糖;酸性多糖ZSP-2的单糖组成是:鼠李糖、木糖、葡萄糖、葡萄糖醛酸、半乳糖醛酸,ZSP-2主要由鼠李糖组成,且含有大量糖醛酸,推测其是果胶多糖;ZSP-3的单糖组分为:岩藻糖、木糖、甘露糖、葡萄糖、半乳糖醛酸,其摩尔比为0.91∶1.45∶4.48∶1∶0.80。ZSP-3则主要由甘露糖组成,含有半乳糖醛酸,属于酸性多糖。
2.4 抗氧化活性分析
2.4.1 DPPH自由基清除作用 由表2知,ZSP-1,ZSP-2,ZSP-3都有一定的DPPH自由基清除能力,且彼此之间没有显著性差异,其DPPH自由基清除力均达到了30%以上,结果高于Zhang等[17]的研究,原因可能是热水浸提法较好的保持多糖的活性。红枣多糖各组分之间DPPH自由基清除率的顺序为:ZSP-1>ZSP-3>ZSP-2。
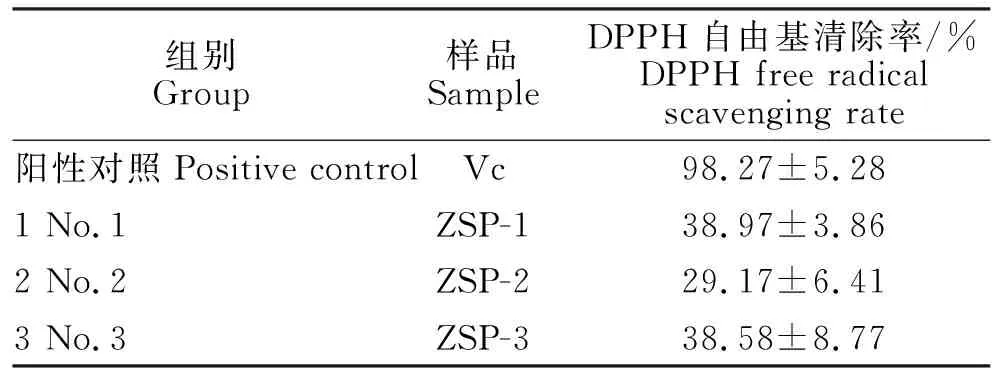
表2 ZSP-1、ZSP-2、ZSP-3对DPPH自由基清除作用Table 2 Scavenging effect of ZSP-1, ZSP-2 and ZSP-3 on DPPH free radicals
2.4.2 ABTS自由基清除作用 由表3知,ZSP-1与ZSP-2,ZSP-3的ABTS自由基清除率之间有显著性差异,ZSP-2和ZSP-3之间没有显著性差异,其中ZSP-1>ZSP-2>ZSP-3。红枣多糖各组分的ABTS自由基清除率都远远小于抗坏血酸。
2.4.3 FRAP值 由表4知,ZSP-1和ZSP-2的FRAP值没有显著性差异,分别是84.16 μM和80.38 μM,均小于ZSP-3的FRAP值99.97 μM,三个组分的FRAP值都远远小于抗坏血酸的值。
表4 ZSP-1、ZSP-2、ZSP-3的FRAP值Table 4 The FRAP value of ZSP-1, ZSP-2 and ZSP-3
3 讨 论
运用红枣天然提取物制作的红枣香味剂能在风味上满足动物对酸甜的喜好,红枣香味剂作为抗氧化剂还具有一定防霉效果[5]。目前关于多糖抗氧化活性影响的研究相对较多,其抗氧化机制不完全清晰,可以确定多糖的抗氧化性与多糖中的异头氢(anomerichydrogen)有关,异头氢能够与羟基自由基发生反应[18]。Yang等[19]发现,将多糖甲基化后,羟基数量的下降会导致多糖自由基清除率明显下降,这进一步证明了羟基是影响多糖自由基清除率的重要因素。
多糖的氧化作用的强弱与多糖分子量、单糖组成关系密切。Lin等[20]研究发现,凉粉草多糖是含有糖醛酸的杂多糖,分子量为1.45×106Da,主要由半乳糖和葡萄糖组成,对DPPH自由基清除率达到(55.59±0.69)%。Hu等[21]对藜麦多糖进行分离纯化得到一个多糖组分CQP,其分子量较低为8 852 Da,单糖组分主要为半乳糖醛酸和葡萄糖。体外抗氧化研究表明,CQP的DPPH自由基、ABTS自由基清除率的IC50值分别为1.859 mg/mL、1.108 mg/mL。本研究的红枣粗多糖ZSP的分子量较大为7.69×105Da,含有大量的半乳糖醛酸,羟基的数量较多,其DPPH自由基、ABTS自由基清除率的IC50值分别为3.73 mg/mL、6.16 mg/mL。
4 结 论
本研究表明,红枣多糖的含糖量为37.29%,分离得到ZSP-1、ZSP-2、ZSP-3三种组分,其分子量存在一定的差异性,其中:ZSP-1不含糖醛酸,是中性糖;ZSP-2和ZSP-3是酸性糖。ZSP的单糖组成为鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸,ZSP浓度与DPPH、ABTS自由基清除率成线性相关;ZSP-1、ZSP-2、ZSP-3均具有一定的抗氧化活性。

