水稻种子蜡质基因表达分析
, ,
(上海师范大学生命与环境科学学院植物种质资源开发中心, 上海 200234)
水稻胚乳主要贮藏物质是淀粉,约占90%。水稻胚乳中的淀粉分为直链淀粉和支链淀粉,其中直链淀粉含量高低是影响稻米食味品质的关键因素[1]。水稻米直链淀粉主要由编码“结合于淀粉粒上的淀粉合成酶”(granule-bound starch synthase,GBSS),即蜡质蛋白催化合成[2]。蜡质蛋白是由蜡质基因(Waxy,Wx)编码合成[3]。
Hirano等报道了开花4 d后的水稻种子蜡质基因mRNA的积累[4]。蜡质基因在开花4 d前种子中的表达情况目前还未见报道。
转基因技术中常需构建合适的启动子。启动子按其转录模式主要分为组成型启动子、组织或器官特异性启动子和诱导型启动子。利用诱导表达型启动子、组织或器官特异性启动子可对外源基因表达实行时间、空间上的调控,因此在转基因研究中具有经济、环保及生物安全等多方面的价值[5]。蜡质基因启动子即为一种器官特异性启动子,只在胚乳、胚囊与花粉中表达[6]。有研究发现,蜡质基因启动子引导GUS基因表达形成的蓝色化合物,在成熟种子中能够均匀分布在整个稻米的横切面[7]。但在水稻不同发育过程中的种子,蜡质基因表达的空间分布状况目前也未见报道。
为了对水稻蜡质基因的分子生物学能够有更全面的了解,本研究采用RT-PCR方法,分析了开花第2天至第5天种子中mRNA的积累;同时采用Waxy基因启动子与GUS报告基因构建成重组载体,利用根癌农杆菌介导法转化水稻,在纯合转基因水稻种子不同发育阶段进行GUS活性检测。开展本研究有助于人们更全面的了解水稻蜡质基因的表达特点。
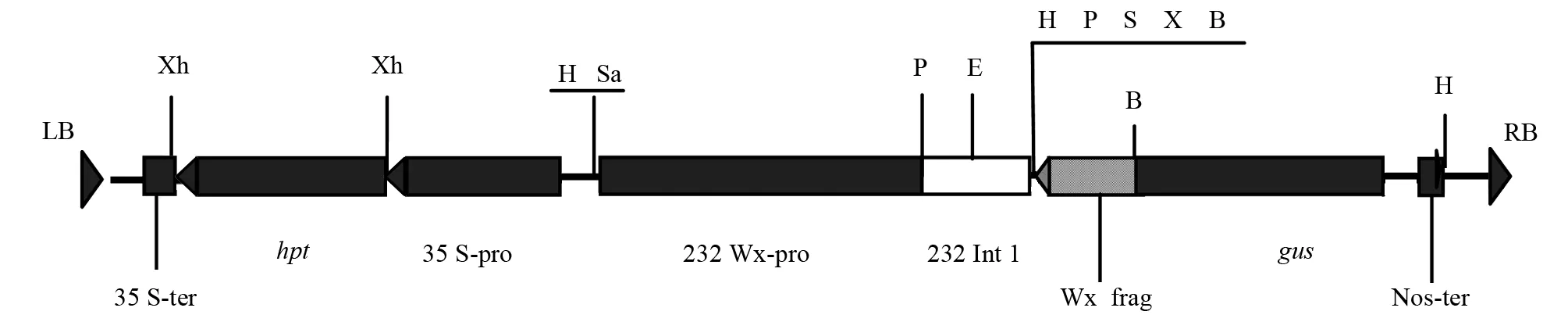
注:232 Wx-pro、232 Int.l为水稻232 蜡质基因启动子和第一内含子;Wx frag为水稻232 蜡质基因反义DNA片段(756 bp);LB、RB为T-DNA 的左右边界;Nos-ter为Nos基因终止子;35 S-pro、35 S-ter为CaMV 35 S基因启动子和终止子;hpt为潮霉素抗性基因;gus为-葡萄糖醛酸糖苷酶基因;Xh为XhoI;H-HindⅢ;Sa:SalⅠ;P为PstI;E为EcoRI;S为SalI;X为XbaI;B为BamHI。图1 双元载体p 13 W 4的T-DNA区结构
1 材料与方法
1.1 供试材料
质粒:在中国科学院上海植物生理生态研究所王宗阳研究员提供的p 13 W 4质粒[8]的T-DNA区段上,含有由蜡质基因启动子引导一段756 bp蜡质基因反义片段与gus基因构成的融合基因序列(图1)。
水稻材料:水稻粳稻品种“超2-10”。
1.2 p 1300-HWG载体构建、检测及转化
将p 13 W 4质粒进行BamHⅠ酶切,琼脂糖凝胶电泳检测回收大片段,用T4DNA连接酶使DNA环化,得到去除756 bp 蜡质基因反义DNA片段后的载体:p 1300-HWG。连接产物转化大肠杆菌菌株DH 5 α感受态细胞,37 ℃培养过夜,挑单克隆摇菌,提取质粒。通过PCR、酶切和测序等方法对p 1300-HWG载体进行鉴定。
设计PCR引物用于检测2个BamH Ⅰ位点之间756 bp反义蜡质基因片段是否被切掉。上游引物Z 21:5’-CTTCCACAGCAACAGCTAGAC-3’与p 13 W 4质粒蜡质基因启动子5’上游的一段DNA相同,下游引物W 4 P 2:5’-TAACATACGGCGTGACATCG-3’与p 13 W 4质粒gus基因的一段DNA互补。PCR反应程序:94 ℃预变性5 min,94 ℃变性50 s、56 ℃退火50 s、72 ℃延伸1 min,30 cycles,最后72 ℃延伸10 min。
制备根癌农杆菌感受态细胞并转化p 1300-HWG质粒,再进行PCR鉴定。PCR扩增方法同上。
1.3 根癌农杆菌介导培育转基因水稻及纯合植株的筛选
分别取“超2-10”水稻幼胚或成熟胚诱导的愈伤组织为遗传转化的外植体。根癌农杆菌介导水稻遗传转化中的培养基组成、愈伤组织诱导、转化操作、抗性筛选、植株再生和纯合植株筛选方法都参照李建粤等[9]的报道。
1.4 T0代转基因水稻植株PCR鉴定和Southern blot分析
采用CTAB法提取转基因水稻植株总DNA。同样采用Z 21和W 4 P 2上、下游引物对转基因水稻进行PCR检测。
设计能够与gus基因配对的上、下游引物。上游引物gus 1:5’-GGAATCCATCGCAGCGTAATG-3’;下游引物gus 2:5’-GCCGACAGCAGCAGTTTCATC-3’。以p 1300-HWG质粒为模板,扩增出564 bp条带,用于转基因水稻进行Southern blot杂交分析的探针。Southern blot检测具体操作步骤按照Amersham公司提供的ECL试剂盒说明书进行。
1.5 转基因水稻GUS检测
对纯合转基因水稻植株在开花10,15,20,25 d不同发育阶段和成熟种子进行GUS活性检测[10-11],观察gus基因表达部位的变化。
1.6 水稻种子半定量RT-PCR分析
选取开花第2、3、4、5天未成熟“超2-10”水稻幼嫩种子,去除颖壳,用TRIZOL Reagent抽提RNA,然后用甲醛变性电泳法检测RNA的质量。用RNase-free的DNaseⅠ(Fermentas MBI)处理总RNA中残留的基因组DNA后,使用生工生物工程公司的AMV First Strand cDNA Synthesis Kit反转录获得cDNA第一链。以cDNA为模板,actin基因为内参,Waxy基因为目标基因进行半定量PCR。Waxy基因扩增引物序列见表1。actin基因反应程序为:94 ℃预变性5 min,94 ℃变性1 min,56 ℃ 退火1 min,72 ℃延伸1 min, 30 cycles, 72 ℃ 延伸10 min;Waxy基因反应程序为:94 ℃预变性5 min,94 ℃ 变性1 min,57 ℃ 退火1 min,72 ℃ 延伸1 min,30 cycles,72 ℃ 延伸10 min;对Waxy基因PCR后的电泳条带进行亮度扫描。
表1 RT-PCR试验中所用引物

基因名称产物(bp)引物名称正向引物和反向引物actin797actin15' AACTGGGATGATATGGAGAA 3'actin25' CCTCCAATCCAGACACTGTA 3'Waxy999Waxy15' TGGTGATCTCTCCTCGGTAC 3'Waxy25' ACTTCTCCTCCATGCTCTTG 3'
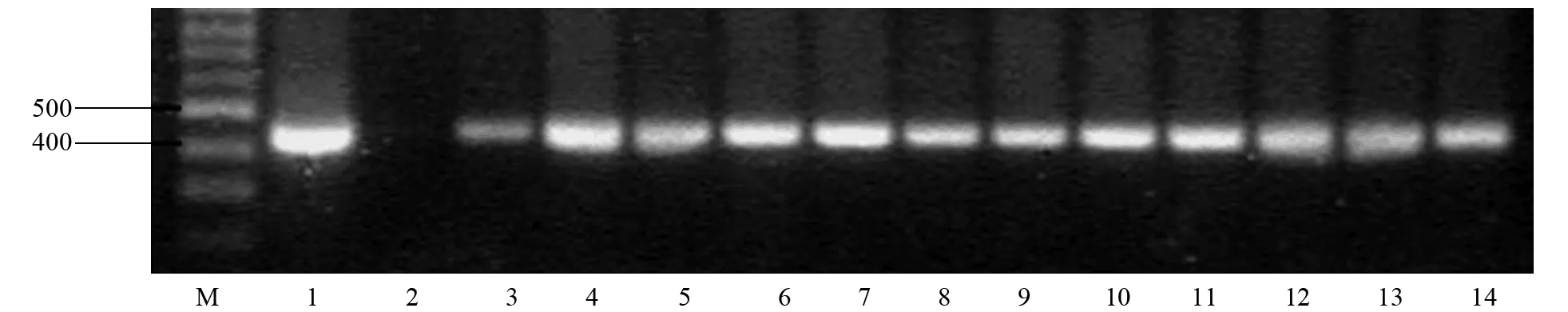
注:M为100 bp DNA Ladder;1为p 1300-HWG质粒阳性对照;2为非转基因对照水稻;3~14为T0转基因植株。图3 p 1300-HWG转基因T0代植株的鉴定
2 结果与分析
2.1 p 1300-HWG质粒载体鉴定
采用上、下游引物Z 21和W 4 P 2对p 13 W 4质粒进行PCR,预计扩增产物长度为1 170 bp。如果p 13 W 4质粒上的蜡质基因反义片段被切除后构建的p 1300-HWG载体,预计Z 21和W 4 P 2引物扩增后的产物长度为432 bp。对p 1300-HWG载体PCR产物进行电泳检测,条带长度为432 bp,与预期结果一致(图2)。再将p 1300-HWG质粒送上海基康生物公司测序分析,测序引物选用上游引物Z 21,测序结果显示p 1300-HWG质粒构建正确。
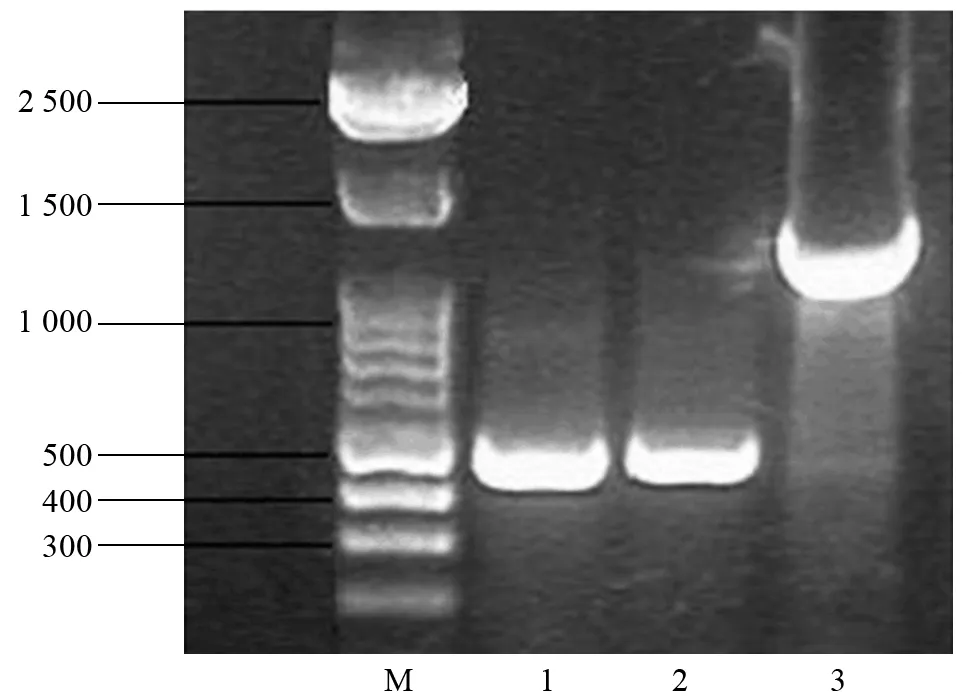
注:M为100 bp DNA ladder;1、2为p 1300-HWG质粒;3为p 13 W 4质粒。图2 p 1300-HWG质粒PCR鉴定
根癌农杆菌阳性转化子的PCR鉴定结果与大肠杆菌中的质粒鉴定结果相同,扩增产物同样是432 bp片段。
2.2 培育转基因水稻及PCR和Southern blot检测
利用根癌农杆菌介导转化水稻,共获得12棵转基因苗,移栽后全部存活。采用Z 21和W 4 P 2引物对12棵T0代转基因植株进行PCR检测,结果如图3所示。12棵植株均能扩增产生清晰的432 bp DNA条带,并且与阳性对照质粒p 1300-HWG扩增结果一致,非转基因阴性对照没有PCR扩增条带。由此初步证实,p 1300-HWG质粒的T-DNA区已整合到转基因植株中。
部分转基因植株的Southern blot结果见图4,其中B9为单拷贝,B8、B10为双拷贝,B11、B12为三拷贝。Southern blot检测结果表明,外源p 1300-HWG质粒的T-DNA区是以不同拷贝数整合到转基因植株的基因组中。
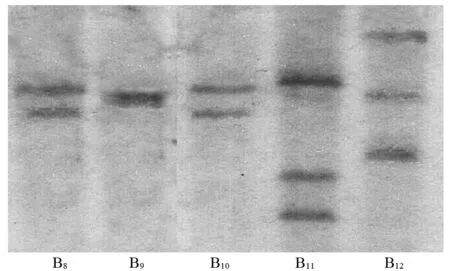
图4 部分T0代植株Southern blot检测
2.3 纯合转基因水稻不同发育种子GUS活性检测
取开花第10、15、20、25天和成熟阶段纯合的转基因植株种子,将稻米胚乳部位横切面进行GUS染色。结果发现,在开花第10天,GUS检测特有的蓝色化合物位于种子的边缘,但随着种子发育,GUS检测特有的蓝色化合物逐渐向稻米中心部位扩展(图5)。
2.4 水稻种子发育前期蜡质基因表达分析
取“超2-10”水稻开花第2、3、4、5天幼嫩种子提取RNA,mRNA反转录后,对内参基因actin的cDNA模板量进行调平检测。开花第2、3、4、5天幼嫩种子cDNA模板量分别为22,15,10,8μL时,可将内参基因actin调平达到较好的结果(图6 A)。
表2 蜡质基因半定量RT-PCR产物电泳图扫描结果
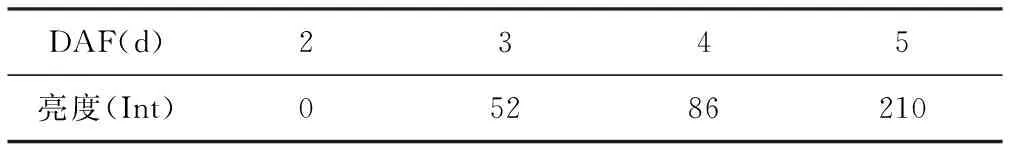
DAF(d)2345亮度(Int)05286210
按上述相同cDNA模板量对蜡质基因进行PCR检测,同样进行电泳检测(图6 B)。电泳条带扫描结果见表2。
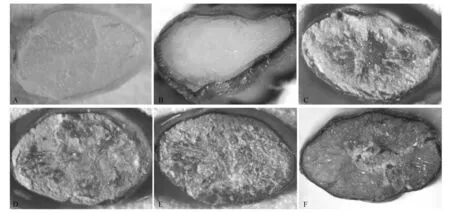
注:A为非转基因水稻成熟种子;B为转基因水稻开花10 d种子;C为转基因水稻开花15 d种子;D为转基因水稻开花20 d种子;E为转基因水稻开花25 d种子;F为转基因水稻成熟种子。非转基因水稻成熟种子胚乳颜色呈无色状态。开花10 d转基因水稻种子只在胚乳周边呈现蓝色。开花15 d转基因水稻种子胚乳周边显蓝色的范围明显比开花10 d的种子增多,并且在胚乳中心部分区域也有蓝色显示。转基因水稻开花20 d种子、25 d种子和成熟种子,胚乳周边和中心都已呈蓝色。图5 转基因水稻不同发育时期种子GUS检测
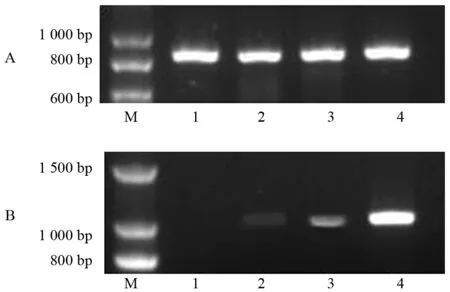
(上图:actin基因;下图:Waxy)注:M为100 bp DNA Ladder;1~4为开花第2、3、4、5天(DAF)幼嫩种子。图6 蜡质基因半定量RT-PCR检测
由不同发育阶段幼嫩种子蜡质基因cDNA电泳条带扫描结果数据显示,蜡质基因在开花第2天还没有表达。在开花第3天能够检测到蜡质基因已开始表达。开花第4天蜡质基因表达量比第3天有小幅增加,但在开花第5天,蜡质基因表达量出现了明显的增强,其表达强度为第4天的2.4倍。
3 讨 论
蜡质基因是影响水稻稻米食味品质最重要的功能基因。近十多年来,水稻蜡质基因研究一直受到科学界的重视。不论蜡质基因低表达还是高表达的稻米都具有应用价值。在20世纪90年代至21世纪初,较多科学家们利用蜡质基因的反义序列转化水稻,试图降低稻米直链淀粉含量,从而达到改良稻米食味品质的效果[8,12-13]。2016年Zhou等探究了可溶性淀粉合成酶基因(SSIIIa)和颗粒结合淀粉合成酶基因(Waxy)在水稻抗性淀粉合成中的作用,并揭示了SSIIIa与高度表达的Waxy组合能够形成高水平的抗性淀粉(RS)[14]。这将有助于培育对糖尿病人有益的高抗性淀粉含量的保健稻米。
Hirano和Sano从开花4 d至28 d选取了7个不同阶段(开花4,7,10,13,18,23,28 d)的水稻种子,分析了蜡质基因mRNA含量,发现从4 d至18 d,蜡质基因转录的mRNA含量逐渐增加,18 d达到最高,在23 d后基本消失[4]。本研究对开花第2天至第5天种子中蜡质基因mRNA表达分析的研究结果,使人们对蜡质基因在稻米中的表达时期有了更全面的了解。
作为报告基因,gus已被广泛应用于转基因植物的研究中。gus与其他广泛使用的报告基因如luc和gfp相比,其检测方法快速多样,并且对实验设备的要求也不高[15]。2007年巩艳青等将水稻胚特异性表达基因OsESG的1.1 kb启动子序列与gus报告基因构建融合表达载体,通过遗传转化分析表明,该序列可以启动gus基因特异性只在水稻胚中表达[16]。 2016年Lu等将水稻低植酸基因(OsLpa1)启动子与gus基因融合转化水稻,通过不同组织 GUS组织化学染色确定OsLpa1表达的组织特异性[17]。本研究采用Waxy基因启动子与gus报告基因构建成重组载体,并转化获得转基因水稻。通过对纯合转基因水稻种子不同发育阶段进行GUS活性检测来分析Waxy基因启动子的表达部位,该研究结果拓宽了人们对蜡质基因在稻米中表达部位的认识。
水稻除了是农作物分子生物学研究的模式植物外,水稻稻米还可被用作生物反应器。2007年Sardana等[18]在水稻胚乳中利用谷蛋白基因Gt1启动子成功表达了重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)。2009年Ning等[19]在水稻胚乳建立的rhGM-CSF的表达系统中,通过使用胚乳特异性强启动子和最优密码子显著提高了重组表达水平,产物可用于治疗白细胞减少症。2017年Ding等[20]用水稻胚乳作为生物反应器,进行了生产药物蛋白、疫苗、功能肽及非蛋白类生物活性物质的研究。水稻胚乳是生产重组蛋白的理想平台[7]。与其他表达系统相比,胚乳表达系统具有成本较低,易于控制生产规模,储存能力强,重组蛋白质储存安全性高,不含动物源性病原体的优点[20]。缺乏高效的胚乳特异表达启动子,会限制在谷物胚乳中驱动重组蛋白基因表达系统的利用[7]。因此,在胚乳中寻找高效特异表达启动子研究一直受到人们的重视。Qu et al.曾使用6种在水稻胚乳中特性表达的谷蛋白基因启动子引导gus基因在水稻种子中表达,在开花7,12 d和17 d分别进行了种子GUS活性检测,结果发现,4种谷蛋白基因启动子GluA-1、GluA-2、GluA-3、GluB-3引导的gus基因表达产物始终分布在种子胚乳的边缘,而且表达量都较低。GluB-5和GluC启动子引导的gus基因表达产物,随着种子的发育,也是逐渐由胚乳的边缘向中心扩展,而且使用GluC启动子GUS产物含量相对最高[7]。比较GUS检测显示的特异蓝色化合物分布,蜡质基因启动子的表现更类似于GluC启动子。在本研究及前人研究都发现,在成熟水稻种子中,蜡质基因启动子引导的gus基因能够在种子的整个胚乳中表达。由此认为,在今后利用水稻种子作为生物反应器生产药用蛋白或利用基因工程技术改良稻米胚乳特性时,蜡质基因启动子也可以被考虑作为候选的胚乳特性高效表达的启动子。

