兔自体BMSC移植修复前交叉韧带损伤效果及对血清u-PA、TGF-β、IL-1、IL-4水平的影响
史开宇,赵其纯
(1 安徽医科大学,合肥230032;2 安徽省立医院)
前交叉韧带损伤是临床较常见的运动损伤,但因疼痛不明显易导致误诊,使患者错过最佳的治疗时期而延误治疗[1]。前交叉韧带损伤因缺少血液供应,损伤后多不能自行愈合,可通过手术重建治疗。但是,术后愈合速度受多种因素的干扰,包括神经营养、重建肌腱的血液供应、炎性物质的产生等[2]。骨髓间充质干细胞(BMSC)是一种多功能干细胞,可以自我完成更新和分化。尿激酶型纤溶酶原激活物(u-PA)可水解纤维蛋白溶酶原,可促进基质降解和炎症反应;转化生长因子β(TGF-β)对细胞有丝分裂有重要作用,可加强损伤处愈合;白细胞介素1(IL-1)可增加代谢因子的表达,调节软骨细胞功能;IL-4加速B细胞分裂,增强免疫系统的功能,还可诱导未分化细胞向髓样细胞分化。因此,血清u-PA、TGF-β、IL-1、IL-4水平可以间接反映修复效果。2018年3~6月,我们建立了前交叉韧带损伤兔模型,观察自体BMSC移植修复前交叉韧带损伤的效果及对这些因子的影响。
1 材料与方法
1.1 主要材料 健康成年雄性新西兰大白兔60只(天津市百农实验动物繁育科技有限公司),兔龄为11~12个月,体质量3.2~3.8 kg。主要试剂、仪器:兔抗大鼠u-PA抗体(天根生化科技有限公司),小鼠抗大鼠TGF-β抗体(北京中杉金桥生物技术有限公司),大鼠抗小鼠IL-1、IL-4抗体(武汉博士德生物工程有限公司),ELISA试剂盒(上海国药集团化学试剂有限公司);WDW-100微机控制电子万能生物力学试验机(济南时代山峰仪器有限公司)。
1.2 实验方法
1.2.1 动物饲养与分组 动物饲养温度为22~25 ℃,室内湿度35%~40%;饲养室定时进行紫外线照射消毒,分笼饲养;统一喂食标准颗粒饲料,自由活动;逐个检查兔的四肢健康情况,确保膝关节无肿胀畸形,双膝关节抽屉试验、Lachman征阴性。将兔随机分为正常组、模型组和移植组各20只,另养2只兔备用以保证数据的完整性,所有操作符合动物伦理学标准。
1.2.2 前交叉韧带损伤模型制备 将模型组和移植组兔固定在动物固定架上,耳缘静脉注射3.3%的戊巴比妥钠进行全麻;右前肢关节处做脱毛处理,肌内注射青霉素预防感染。用手术刀在右前肢的膝关节髌旁内侧做纵切口,切断前交叉韧带,暴露股骨和胫骨附着点。分离趾长伸肌腱并切断远端,完整保留股骨端附着处,用4-0 Ethibond 缝合线缝合断端。测量并记录肌腱直径,使用与之匹配的钻通过前交叉韧带在股骨和胫骨的附着点,建立股骨和胫骨隧道。在兔胫骨嵴上钻孔,使膝关节屈曲30°,拉入趾长伸肌腱,在胫骨桥上打结固定。术后无动物死亡,1只感染,备用补充保证样本量。
1.2.3 兔自体移植用BMSC的获取与制备 参考孙经淞等[3]的培养方法,并作适当修改。在无菌条件下,抽取移植组兔骨髓5 mL,以1 500 r/min离心5 min,将分离的细胞接种于盛有低糖DMEM培养液的50 mL培养瓶(细胞密度5×105/cm2)中,置于37 ℃、5% CO2培养箱中培养。当细胞铺满瓶底90%时,加入0.25%胰蛋白酶。将3 mL DMEN液注入生物蛋白胶,充分溶解后密封在EP管中,每支EP管装有液体200 μL,-50 ℃冰箱保存。把2 mL纤维蛋白、0.5 mL凝血酶和2 mL细胞悬液混合成有固体强度的生物蛋白胶,再加入适量DMEM液,继续放置在培养箱中观察。
1.2.4 细胞移植 模型成功建立后,收集第3代BMSC约1×107,以1 500 r/min离心10 min;弃上清液,取底部的细胞团,与200 μL的纤维蛋白原混合均匀;用两支2.5 mL的空针分别抽取细胞悬液和催化剂,同连接器相连,将细胞注入移植组的胫骨和股骨隧道内。以同样方法在模型组胫骨和股骨隧道内注入生物蛋白胶,正常组不做任何处理。治疗期间,各组动物均自由饮食。
1.2.5 血清u-PA、TGF-β、IL-1、IL-4检测 术后第2、4、6、8周清晨抽取空腹后肢胫部皮下静脉血5 mL,迅速转移至生化管内,以2 500 r/min离心15 min。移取上清液,-50 ℃冰箱保存待检。采用SABC法检测u-PA,ELISA法检测TGF-β、IL-1、IL-4,严格按说明书操作。
1.2.6 前交叉韧带力学测定 术后各时点采血后每组分别处死5只,留取右前肢的膝关节;用生理盐水纱布包裹立即送生物力学实验室,用WDW-100微机控制电子万能生物力学试验机测试。固定好待测部位后,以5 mm/min的速度进行最大载荷拉伸试验,记录前交叉韧带完全断裂时的加载负荷。
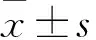
2 结果
2.1 各组术后不同时点血清u-PA、TGF-β、IL-1、IL-4水平比较 术后2、4、6、8周时,移植组和模型组血清u-PA、TGF-β、IL-1、IL-4水平逐渐降低,并向正常组水平趋近;术后同一时点血清u-PA、TGF-β、IL-1、IL-4比较,模型组>移植组>正常组(P均<0.05)。见表1。

表1 各组术后不同时点血清u-PA、TGF-β、IL-1、IL-4水平比较
注:与同时点正常组比较,aP<0.05;与同时点模型组比较,bP<0.05。
2.2 各组术后不同时点前交叉韧带再次断裂所需拉力比较 术后2、4、6、8周,移植组和模型组前交叉韧带再次断裂所需拉力均逐渐增大,并向正常组水平趋近;术后同一时点前交叉韧带再次断裂所需拉力比较,模型组<移植组<正常组(P均<0.05)。见表2。
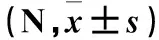
表2 各组术后不同时点前交叉韧带再次断裂所需拉力比较
注:与同时点正常组比较,aP<0.05;与同时点模型组比较,bP<0.05。
3 讨论
随着社会的不断发展,发生交通事故和参加体育锻炼的人数增加,韧带损伤发生率也逐年增加,且大多数为膝部韧带损伤[4]。其中,90%的膝部韧带损伤发生在前交叉韧带和内侧副韧带,前交叉韧带是最易受伤的韧带,占膝关节韧带损伤的一半以上。前交叉韧带损伤后不能自愈,需通过手术才能恢复其功能[5]。MSC是胚胎发育过程中在多种成体间叶组织(如骨髓基质、胎盘、脐带血等)中留存下来的未分化的原始多能细胞,具有长期自我更新和发生多向分化的潜能[6]。自体BMSC移植是自身抽取留存于骨髓中的MSC,经培养、纯化后再次注入患者体内,是一种用于治疗免疫性疾病的前沿疗法[7,8]。
纤维蛋白组织的形成属于一种病理现象,在血液凝结、血栓形成、炎症反应和组织修复中起重要作用。在皮肤和骨组织的修复中均能观察到纤维蛋白组织的形成,其形成和降解之间存在着一种动态平衡,纤维蛋白溶酶对纤维蛋白的降解起到一定调控作用[9]。u-PA对纤维蛋白溶酶原有水解作用,促进其转化成纤维蛋白溶酶,还参与炎症反应和基质的降解过程[10]。本研究显示,移植组血清u-PA低于同时点模型组,且逐渐接近正常组水平。这提示自体BMSC移植可促进大白兔损伤处的恢复,使损伤处的微环境逐渐恢复平稳状态,u-PA的表达也逐渐向正常水平趋近。TGF-β是由两条蛋白质链组成的二聚体,两个亚单位的结构相似,由二硫键连接[11]。TGF-β可诱导细胞发生有丝分裂,调节组织液的产生,维持机体内环境稳定,加速细胞分化以及成熟,促进肌腱、骨创伤处的愈合[12,13]。本研究显示,移植组血清TGF-β低于同时点模型组,且逐渐接近正常组水平。这可能是损伤处内环境逐渐恢复正常,肌腱和软骨逐渐恢复正常,对TGF-β的调节需求减弱,TGF-β逐渐降低。
IL-1主要来自单核巨噬细胞,也可以来自软骨细胞、滑膜细胞等。其本质是一种多肽,有激素样作用。IL-1可以调节软骨细胞的功能,诱导基质金属蛋白酶的产生,增加代谢因子的表达,促进软骨基质降解,致使软骨退化[14]。本研究显示,移植组注入BMSC和生物蛋白胶的混合物后,其血液中单核巨噬细胞、软骨细胞、滑膜细胞对IL-1的表达水平逐渐趋于正常,损伤处的软骨基质降解减少,损伤处在不断恢复。IL-4来源于T淋巴细胞,可促进B淋巴细胞的有丝分裂,并增强B细胞提呈抗原能力,增加免疫系统对小量抗原的免疫应答反应[15]。IL-4还可以与粒细胞巨噬细胞集落刺激因子发生协同作用,促进骨髓造血前体细胞有丝分裂,对髓样细胞定向分化有诱导作用。本研究结果显示,移植组注入BMSC和生物蛋白胶的混合物后,损伤处细胞表达活动逐渐趋于正常,T淋巴细胞对其表达逐渐减少,损伤处在不断恢复。
治疗后定期测量前交叉韧带损伤处再次断裂所需拉力,可以代表损伤处的恢复情况。本研究结果显示,术后同一时点前交叉韧带再次断裂所需拉力比较移植组大于模型组。这提示自体BMSC移植后损伤处细胞分裂增殖速度增加,腱骨界面胶原纤维数量增加,肌腱强度逐渐增强。因此,兔自体BMSC移植可有效修复前交叉韧带损伤,并可有效降低兔血清u-PA、TGF-β、IL-1、IL-4水平,对前交叉韧带损伤的手术恢复有重要参考价值。

