丹参酮IIA对新生大鼠缺氧缺血性脑损伤时低氧诱导因子1α基因表达的影响
陈晨,王利玲
浙江中医药大学附属第一医院儿科,浙江 杭州 310000
新生儿缺氧缺血性脑损伤(Hypoxia ischemic brain damage,HIBD)是导致新生儿死亡及小儿致残的主要疾病之一。现代医学对HIBD的治疗无特效治疗方案,多采用亚低温[1]及对症支持治疗。目前已有研究表明丹参酮IIA(Tanshinone IIA,TSA)对改善HIBD有显著疗效[2],而细胞缺氧时,低氧诱导因子-1α(Hypoxia-Inducible Factor-1α,HIF-1α)基因的表达会增加,对恢复细胞内环境稳态起着重要的作用。本文将通过研究验证新生大鼠HIBD时,TSA在改善脑代谢作用上与HIF-1α基因表达存在的相关性。
1 材料与方法
1.1 实验动物 实验所用新生大鼠为亲代大鼠交配生产所得的7日龄健康SD大鼠(亲代SD大鼠购于上海西普尔-必凯实验动物有限公司),共60只,体质量为(14±2)g,雌雄不限,动物合格证号:SYXK(浙)2008-0015。饲养于浙江中医药大学实验动物中心清洁级玻璃舱内,饲养温度18~22℃,湿度为45%~65%。
1.2 实验药物 丹参酮IIA磺酸钠(商品名:诺新康),购自上海第一生化药业有限公司,批号为120116,规格为2mL/10mg。
1.3 主要试剂 RT-PCR主要试剂:总RNA提取试剂(D9108B)、定量反转录试剂盒(DRR 037A)、荧光定量PCR试剂盒(DRR 420A)均由杭州皓丰生物技术有限公司生产;HIF-1α及甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)上下游引物由TAKARA公司设计、合成及生产。免疫组化主要试剂:SD大鼠HIF-1α抗体由浙江俊豪生物有限公司生产;兔二抗试剂由浙江俊豪生物有限公司生产。
1.4 动物分组及模型制备 按照随机数字表法将60只SD大鼠随机分5组:假手术组、模型组、低剂量治疗组、中剂量治疗组、高剂量治疗组,每组各12只。围产期HIBD大鼠模型制备依据Rice JE等[3]的方法造模。先经腹腔注射10%水合氯醛麻醉(3 mL/kg);用灭菌丝线结扎左颈总动脉,复位皮下组织,缝合切口;术后送回母鼠身边休息2 h。其中假手术组麻醉后游离左颈总动脉而不结扎,复位皮下组织,缝合切口。治疗组造模后,以丹参酮IIA磺酸钠腹腔注射。
1.5 给药方法 假手术组、模型组分别予3.2 mL/100 g 5%葡萄糖(TSA注射液溶剂)腹腔注射;高、中、低剂量治疗组TSA给药剂量依次为3.2 mL/100 g(160 mg/kg)、1.6 mL/100 g(80 mg/kg)、0.8 mL/100 g(40 mg/kg),另外分别予 0 mL/100 g、1.6 mL/100 g及2.4 mL/100 g 5%葡萄糖平衡液体总量。术后休息3 h后开始注射,早晚各1次,连续3天。
1.6 各组大鼠行为观察 观察各组大鼠造模前后及治疗后神经系统(烦躁、嗜睡或精神抑制)、呼吸系统(呼吸快慢)、运动系统(刻板运动,不自主颤动,抽搐等)的行为改变。
1.7 各组大鼠各指标检测方法 取出各组大鼠左侧脑组织,分2份,1份放入冻存管内,置于液氮冷藏,移至-80℃冰箱内备用;另1份置于10%福尔马林溶液内,室温固定24 h。用荧光定量PCR方法检测各组HIF-1α的表达,采用HE染色方法观察脑组织病理变化,HIF-1α原位免疫组织化学标记染色,显微镜下进行阳性表达对比。
1.8 统计学方法 应用SPSS19.0软件进行统计分析,所得到的计量资料以(±s)来表示。若各组间方差齐,则采用单因素方差分析,两两比较用Tukey HSD检验;若各组间方差不齐,则采用非参数检验Tamhane's T2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠行为学指标观察结果 假手术组术后无明显行为改变。模型组及治疗组在造模后7~18 min,表现出躁动不安、呼吸深快、肢体颤抖等;造模后19~60 min,表现出对刺激反应减弱、呼吸浅快、四肢活动减少、肌张力下降等;造模后1~3天,上述行为改变开始逐渐恢复。腹腔注射后观察3天,治疗组比模型组的行为表现恢复快,且TSA剂量越高,恢复越好。
2.2 各组大鼠脑组织HE染色结果比较 见图1。假手术组大鼠海马区及皮层神经细胞胞核大,胞浆少,无水肿,细胞排列有序,细胞间隙紧密,未见细胞缺失;模型组则神经细胞出现水肿,呈气球样变,胞核固缩,呈圆形,部分细胞核碎裂、溶解、消失,细胞碎片较多,并伴有炎症细胞浸润,细胞排列紊乱,细胞间隙明显增大,缺失明显,失去正常组织结构。与模型组比较,低剂量治疗组神经细胞肿胀稍减轻,细胞变形不明显,部分细胞核碎裂、溶解、消失,细胞碎片散在分布于细胞间质,有胶质细胞浸润,细胞排列紊乱,稍规则,细胞间隙增大,正常组织结构被破坏;中剂量治疗组神经细胞水肿减轻,核小而圆,胞浆大而空,部分细胞呈多边形,细胞死亡数目较少,部分核溶解、消失,细胞间隙的细胞碎片较少,细胞排列紊乱,较规则,细胞间隙大,可见细胞缺失;高剂量治疗组神经细胞水肿以轻度为主,细胞气球样变不明显,细胞排列明显较规则,间隙轻度增大,细胞缺失不明显。
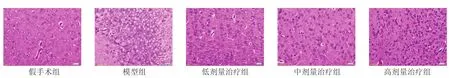
图1 各组大鼠脑组织HE染色结果比较 (×200)
2.3 各组大鼠脑组织HIF-1α表达结果比较 见图2。假手术组大鼠脑组织中HIF-1α仅少量表达,偶可见棕黄色HIF-1α阳性细胞。与假手术组比较,模型组大鼠脑组织中HIF-1α阳性细胞明显减少,散在分布于视野中。与模型组比较,低剂量治疗组大鼠脑组织中HIF-1α阳性细胞较密集,分布较均匀;与低剂量组比较,中剂量治疗组大鼠脑组织中HIF-1α阳性细胞分布更密集,更均匀;高剂量治疗组HIF-1α表达明显增多,HIF-1α阳性细胞大量密集均匀分布于脑组织中,海马、皮质均可见阳性细胞。
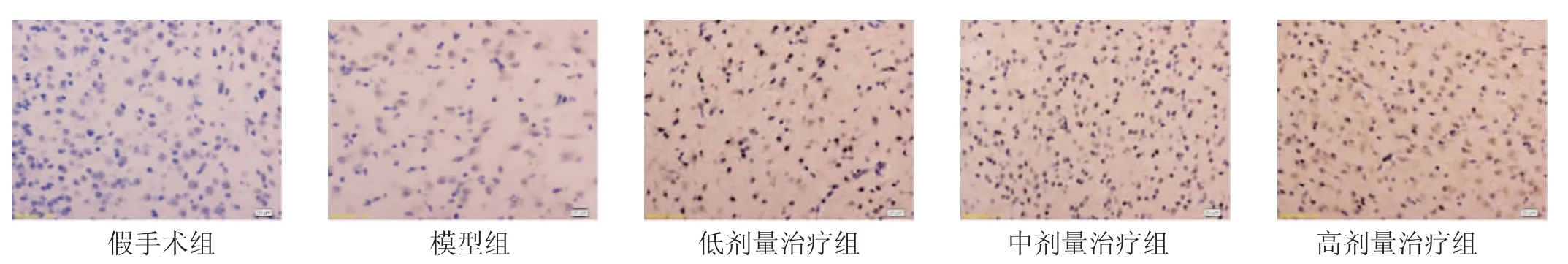
图2 各组大鼠脑组织HIF-1α表达结果比较 (×200)
2.4 各组大鼠脑组织HIF-1α基因表达结果比较 见表1。假手术组HIF-1α基因仅少数表达,与假手术组比较,模型组表达明显增加(P<0.05);与模型组比较,低、中、高剂量治疗组基因表达增加,且呈一定的剂量依赖性(P<0.05)。
表1 各组大鼠脑组织HIF-1α基因相对表达结果比较(±s)

表1 各组大鼠脑组织HIF-1α基因相对表达结果比较(±s)
与假手术组比较,①P<0.05;与模型组比较,②P<0.05;与低剂量组比较,③P<0.05;与中剂量组比较,④P<0.05
组 别假手术组模型组低剂量治疗组中剂量治疗组高剂量治疗组n 1 2 1 2 1 2 1 2 1 2 H I F-1 α基因相对表达量(R Q值)0.1 2 1±0.0 4 0 0.7 0 0±0.2 2 5①1.0 0 6±0.1 3 7②④1.3 7 8±0.2 3 5②③1.6 8 0±0.1 6 3②③④
3 讨论
HIBD的发病与多种因素有关,妊娠和分娩都可以导致该病的发生[4]。从缺氧缺血开始到脑细胞损伤经历了2个阶段[5],第一个阶段为代偿阶段,此时并不发生脑细胞的损伤,而是通过增加糖酵解、增加血红蛋白含量和减少细胞氧消耗等途径来增加脑细胞对氧的利用能力,增强脑细胞对缺氧的耐受能力。第二阶段为损伤阶段,如果缺氧缺血持续存在,则会超过脑细胞的代偿范围,而发生缺氧缺血性损伤。缺氧缺血主要对脑细胞的线粒体、膜结构和溶酶体造成损伤,具体机制与氧自由基的大量产生、钙盐的沉积、细胞膜2侧离子浓度的紊乱和磷脂酶的活化有关。通过以上机制,线粒体的功能受到影响、膜结构被破坏、通透性改变、溶酶体内的蛋白水解酶外溢,造成细胞的损伤,甚至死亡。因此,若能阻断以上途径,便可减少脑细胞损伤的发生,增强细胞对缺氧的耐受性。
HIBD在中医儿科学无相应的病名,根据症状表现不同,可以归入呕吐、惊风等范畴,可参考中风对其进行辨证。中医辨证上总属为本虚标实,急性期以血瘀为主,气虚为次,缓解期以本虚气虚为主,血瘀为其次。而在治疗上,多采用具有活血化瘀、调经通络等功效的药物,使用最多的药物之一是丹参。《神农本草经》中记载:“丹参,味苦微寒无毒,主治心腹邪气,肠鸣幽幽如走水,寒热积聚,破癥除瘕,止烦满,益气”,由此可见,中药丹参具有活血调经,祛瘀止痛,凉血消痈,清心除烦及安神的功效。药学研究表明丹参中最主要的脂溶性成分是TSA,含量约为0.1%~0.9%[6],随着对丹参及其有效成分的深入研究,国内外学者发现中药丹参在治疗神经系统疾病中发挥着越来越大的作用,而TSA作为丹参中重要的脂溶成分,也发挥了重要的作用。研究表明,TSA可抑制钙转运和减少细胞内游离钙离子的浓度[7],可抑制人脑微血管内皮细胞的丝裂原活化蛋白激酶活化,保护丙酮醛诱导的细胞损伤[8],还能减少血小板的聚集,阻断再灌注过程中微血栓的形成,改善血液供应,防止继发性再灌注损伤的发生[9]。
低氧诱导因子-1(Hypoxia-Inducible Factor-1,HIF-1)是一种随着细胞内氧浓度变化而调控相关基因表达的核转录因子,为真核生物转录因子螺旋环螺旋-PAS蛋白家族成员,由2个亚基组成,α亚基和β亚基,α亚基为主要的活性单位,氧对HIF-1的活性调节主要通过该亚基完成。HIF-1是低氧耐受时相关基因表达的调节中心,在恢复细胞内环境稳定方面起到主要作用。正常情况下各组织HIF-1α表达很少,而低氧可以增加其稳定性和活性,其表达呈时序性和低氧浓度依赖性[10~12]。
本研究以新生大鼠为模型,通过研究TSA干预HIBD,发现TSA能显著改善脑细胞水肿、变性,减少细胞核碎裂,减少组织细胞缺失,减少炎症细胞浸润,明显改善组织细胞的缺氧缺血性病变,并且其改善效果与TSA的剂量呈正相关。关于TSA与脑细胞中HIF-1表达量的关系目前研究较少,笔者通过实验证实TSA能通过上调HIF-1α基因的表达、促进下游基因表达来改善HIBD,发挥对新生大鼠脑组织损伤保护的作用,证实了TSA治疗HIBD的分子机制,为临床上TSA防治HIBD提供了有力的理论依据。

