血清中CEA、NSE与CYFRA21-1联合检测在诊断肺癌中的临床意义及预后评估价值
黄倩 ,丁显平
1.四川大学生命科学学院,四川成都 610044;2.成都市第七人民医院检验科,四川成都 640041
肺癌作为一种高发病、高致死恶性肿瘤,早期诊断对临床治疗、预后评估具有重要意义[1],既往有大量研究认为肿瘤标志物可用于早期诊断、疗效监测及预后评估[2-3],近年随着肿瘤分子生物学理论的成熟,越来越多的肿瘤标志物被用于肺癌早期诊断[4]。CEA、CYFRA21-1、NSE均为恶性肿瘤常用肿瘤标志物,但有关三者联合诊断的临床研究较少,该次研究选取2010年10月—2012年10月该院收治的肺癌、良性肿瘤、健康患者各30例为研究对象,对单一、联合诊断方法进行对照,为肺癌早期诊断及预后评估提供指导,现报道如下。
1 资料与方法
1.1 一般资料
选取该院肺癌、良性肿瘤、健康患者各30例为研究对象,肺癌组纳入标准:病理组织学检查确诊为肺癌;体温正常;血常规检测无异常;无严重肝肾功能障碍;未合并肺部良性疾病;无其他感染性疾病;无其他部位恶性肿瘤。其中男16例,女14例,年龄29~84岁,平均(61.36±5.94)岁,其中鳞癌 7 例,腺癌 6 例,小细胞癌9例,未分类癌8例;TNM分期Ⅰ期12例,Ⅱ期8例,Ⅲ期10例。良性患者纳入标准:无肺炎、支气管扩张、肺结核等其他呼吸系统疾病;未合并其他恶性肿瘤或肝、肾等严重内科疾病,其中男18例,女12例,年龄 30~81 岁,平均(62.44±6.34)岁。正常组男 16名,女 14 名,年龄 32~81 岁,平均(60.94±7.44)岁。 3组年龄、性别等基线资料比较差异无统计学意义(P>0.05),具有可比性,且所选病例均通过伦理委员会的批准,患者及家属均知情同意。
1.2 检测方法
检测仪器为罗氏MODULAR E170电化学发光免疫分析仪,试剂盒购自上海鼓臣生物公司。CEA、NSE与CYFRA21-1采取电化学发光免疫法测定,根据试剂说明书严格操作,取术前1个月清晨空腹静脉血3 mL,常规离心,分离血清并保存。CEA>4.7 ng/mL,NSE>16.3 ng/mL,CYFRA21-1>3.3 ng/mL。
1.3 敏感性、特异性计算
敏感性=真阳性例数/(真阳性例数+假阴性例数),特异性=真阴性例数/(真阴性例数+假阳性例数),3项检测中有任何一项阳性则视为联合检测阳性。
1.4 统计方法
2 结果
2.1 肺癌与正常者血清CEA、NSE与CYFRA21-1比较
肺癌组CEA、NSE、CYFRA21-1表达显著高于良性、正常组(P<0.05),良性组与正常组组间比较差异无统计学意义(P>0.05)。见表 1。肺癌组 CEA、NSE 及CYFRA21-1阳性患者分别15例、22例、17例,CEA诊断肺癌灵敏度50.00%(15/30)、特异性81.67%(49/60);NSE 诊断灵敏度 73.33%(22/30),特异性 66.67%(40/60);CYFRA21-1 灵敏度 56.67%(17/30),特异性71.67%(43/60); 联合诊断灵敏度 93.33%(28/30),特异性 50.00%(30/60)。
表1 肺癌与正常者血清CEA、NSE与CYFRA21-1比较[(±s),ng/mL]
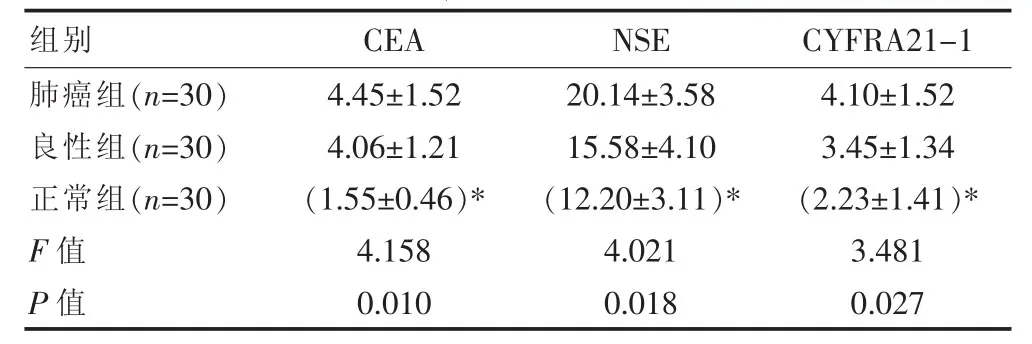
表1 肺癌与正常者血清CEA、NSE与CYFRA21-1比较[(±s),ng/mL]
注:与肺癌组比较,*P<0.017。
组别 C E A N S E C Y F R A 2 1-1肺癌组(n=3 0)良性组(n=3 0)正常组(n=3 0)F值P值4.4 5±1.5 2 4.0 6±1.2 1(1.5 5±0.4 6)*4.1 5 8 0.0 1 0 2 0.1 4±3.5 8 1 5.5 8±4.1 0(1 2.2 0±3.1 1)*4.0 2 1 0.0 1 8 4.1 0±1.5 2 3.4 5±1.3 4(2.2 3±1.4 1)*3.4 8 1 0.0 2 7
2.2 不同预后肺癌患者血清CEA、NSE与CYFRA21-1比较
存活及死亡患者CEA、NSE与CYFRA21-1水平比较差异有统计学意义(P<0.05)。见表2。存活患者中CEA阳性10例,NSE阳性10例,CYFRA21-1阳性8例,联合诊断阳性14例。死亡患者CEA阳性5例,NSE阳性12例,CYFRA21-1阳性9例,联合诊断阳性14例。
表2 不同预后肺癌患者血清CEA、NSE与CYFRA21-1比较[(±s),ng/mL]
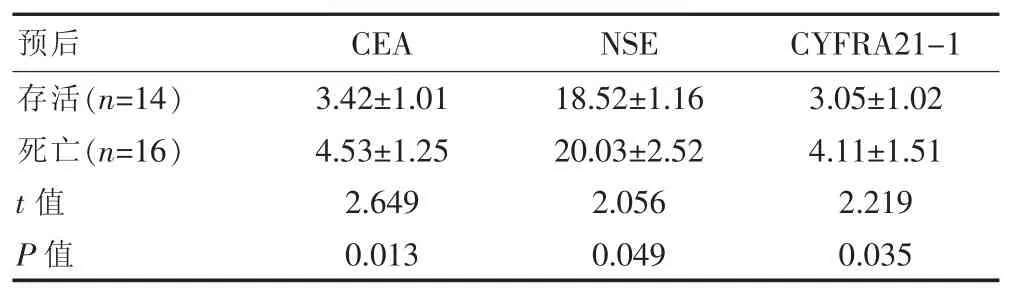
表2 不同预后肺癌患者血清CEA、NSE与CYFRA21-1比较[(±s),ng/mL]
预后 C E A N S E C Y F R A 2 1-1存活(n=1 4)死亡(n=1 6)t值 P值3.4 2±1.0 1 4.5 3±1.2 5 2.6 4 9 0.0 1 3 1 8.5 2±1.1 6 2 0.0 3±2.5 2 2.0 5 6 0.0 4 9 3.0 5±1.0 2 4.1 1±1.5 1 2.2 1 9 0.0 3 5
3 讨论
肺癌发生机制与吸烟、空气污染、营养失衡等众多因素相关[5],此病具有明显的异质性,目前临床诊断方式主要包括痰细胞学、血清学或影像学检测,本文三者单一及联合应用的效果进行分析,旨在为肺癌早期诊断提供依据。
CEA为最早发现的肿瘤标志物,最早在结肠癌、胎儿肠组织内发现,外周血内含量较低,后被作为结肠癌首选标志物用于临床;NSE即磷酸烯醇化酶,属酸性蛋白酶,仅在神经元、神经内分泌细胞中表达,因此在检测神经系统受损中具有重要价值;CYFRA21-1是具有40 KDa的酸性糖蛋白,属于上皮细胞骨架的一部分,由人类KPT19基因编码,主要维持上皮细胞完整性,参与细胞粘附、生长、浸润等过程,血液中CYFRA21-1主要源于上皮肿瘤细胞分解,分解后溶于血清内,既往研究显示CYFRA21-1是较敏感的肿瘤标准物,尤其对于鳞癌具有较高的诊断价值[6]。
该次研究显示联合诊断灵敏度达93.33%,这与王文涛等[7]学者在相关研究中得出联合检测的灵敏度可达96.12%,与该文的研究结果相近,提示三项指标联合检测可充分利用各指标在不同类型癌症中的检测优势。有研究[8]认为人体内有循环抗动物蛋白抗体,可能影响肿瘤标志物检测结果,容易发生假阳性、假阴性,如人体处于感染状态时,炎性物质可能释放具有抗原性的活性物质,此类物质与肿瘤标志物结合导致假阳性结果,另非肿瘤患者体内分泌的肿瘤相关抗原释放到血液循环中,如伴有肝损伤则可能导致抗原代谢受阻,最终导致假阳性,另有研究认为术后肿瘤标志物对预后的评估价值更高,对此仍需后期深入研究。
综上所述,联合诊断CEA、CYFRA21-1、NSE可提高肺癌诊断准确性,对肺癌不同病理类型、分期有一定鉴别价值,并对预后有一定预测作用,临床价值较高。

