CCL18介导肿瘤微环境趋化因子网络导致卵巢癌不良预后的研究
汤钰琪 于红静 石丽君 邹玉鹏 冯雁 王琪
血清CC趋化因子配体18(CC-chemokine ligand 18,CCL18)是属于CC趋化因子家族的小细胞因子,主要由固有免疫系统产生,可影响机体适应性免疫。本课题组前期研究发现由CCL18和CXC趋化因子1(CXC chemokine ligand 1,CXCL1)联合建立的卵巢癌诊断模型的灵敏度和特异度均超过90%,明显优于CA125检测,对筛查早期卵巢恶性肿瘤或监测病程具有潜在的临床价值[1]。后续的体内实验证实,卵巢上皮癌细胞株(SKOV3)转染 CCL18后可促进肿瘤细胞在活体内外转移和侵袭,但对细胞增殖能力影响不大[2]。
既往研究发现上皮来源的肿瘤细胞具有表达特定趋化因子受体功能[3]。肿瘤细胞及肿瘤相关间质细胞可通过自分泌或旁分泌方式分泌多种趋化因子及受体,不同增殖、转移潜能的肿瘤细胞可表达不同的趋化因子及受体谱[4]。肿瘤微环境中的趋化因子及受体网络系统在卵巢癌细胞存活、转移中有重要作用,因此我们推测CCL18可能通过调控不同的趋化因子及受体网络,激活相关下游信号通路,从而参与卵巢癌的生长与转移,影响患者预后。本研究拟分析CCL18过表达卵巢上皮癌细胞SKOV3中其他趋化因子及受体的网络互作,探讨CCL18对卵巢癌微环境及预后的影响。
1 材料与方法
1.1 主要设备和试剂
实时荧光定量PCR购自美国ABI公司,Bio-plex 200仪器购自美国Bio-Rad公司,胎牛血清购自美国Hyclone公司,DMEM高糖购自美国GIBCO公司,TRIzol购自美国Invitrogen公司,SupermoⅢM-MLV Reverse Transcriptase逆转录酶RNA购自北京百泰克生物技术有限公司,CCL18单克隆抗体购自美国Santa Cruz公司,微球包被试剂盒购自美国Bio-Rad公司。
1.2 细胞培养
卵巢上皮癌细胞(SKOV3)、空载对照细胞(SKOV3-GFP)、稳定过表达CCL18卵巢上皮癌细胞(SKOV3-GFP-CCL18)均为本课题组前期建立[5]。细胞在含有10%胎牛血清的DMEM高糖培养基中培养,置于37℃、5%CO2潮湿培养箱中维持。
1.3 裸鼠皮下移植瘤模型建立
本实验所用裸鼠为SPF级BALB/c雌性裸鼠,体重18~22 g,由广西医科大学实验动物中心提供。用0.25%胰蛋白酶消化SKOV3-GFP-CCL18细胞、SKOV3-GFP细胞和SKOV3细胞,计数1×107个细胞,用培养液调整体积至200 μL。2 mL注射器于裸鼠腹股沟淋巴结区皮下注射。30 d后待肿瘤长至1 cm左右,采用脊髓离断法拉颈处死裸鼠,无菌操作台下分离剥取肿瘤组织,PBS冲洗,无菌纱布吸干液体,液氮浸泡,-80℃冰箱保存。
1.4 总RNA提取
按美国Invitrogen公司TRIzol操作说明提取组织总RNA,紫外分光光度仪检测RNA OD值,若A260/A280在1.8~2.0,0.1%变性琼脂糖凝胶电泳可见清晰的18S、28S两条带,则说明所提取的总RNA质量较高。
1.5 实时荧光定量PCR(qRT-PCR)检测
采用SupermoⅢ M-MLVReverseTranscriptase逆转录酶RNA生成cDNA。各样本cDNA参照TaKaRa公司SYGR Mix说明书设定PCR体系,采用两步法进行PCR反应。PCR反应条件:94℃5 min;94℃30 s,56℃ 30 s,72℃ 30 s重复30个循环;72℃ 10 min。每个样本设3个重复。趋化因子的引物序列如表1所示,GAPDH为内参对照。相对表达量采用2-ΔΔCt计算。
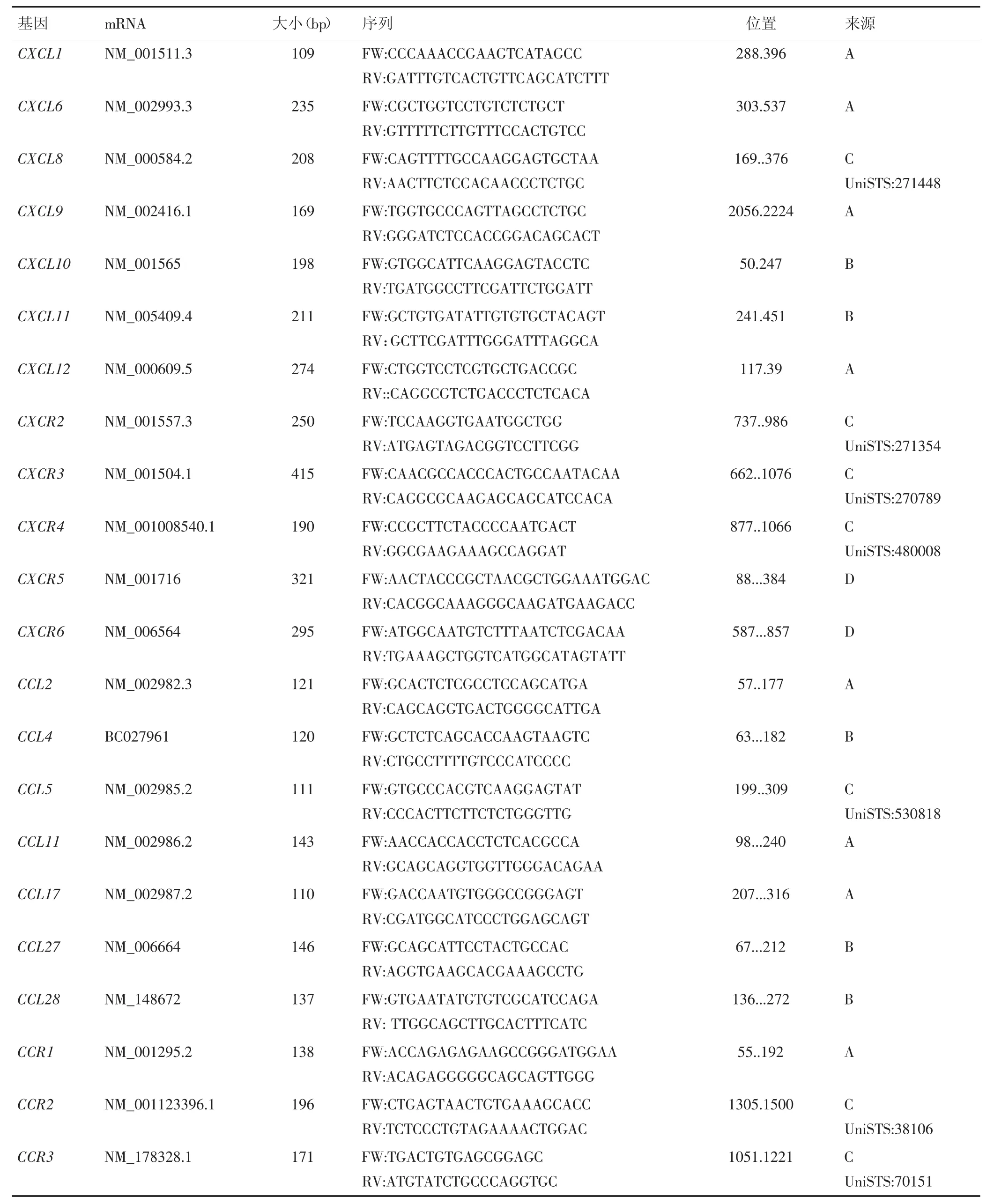
表1 qRT-PCR检测的趋化因子引物序列
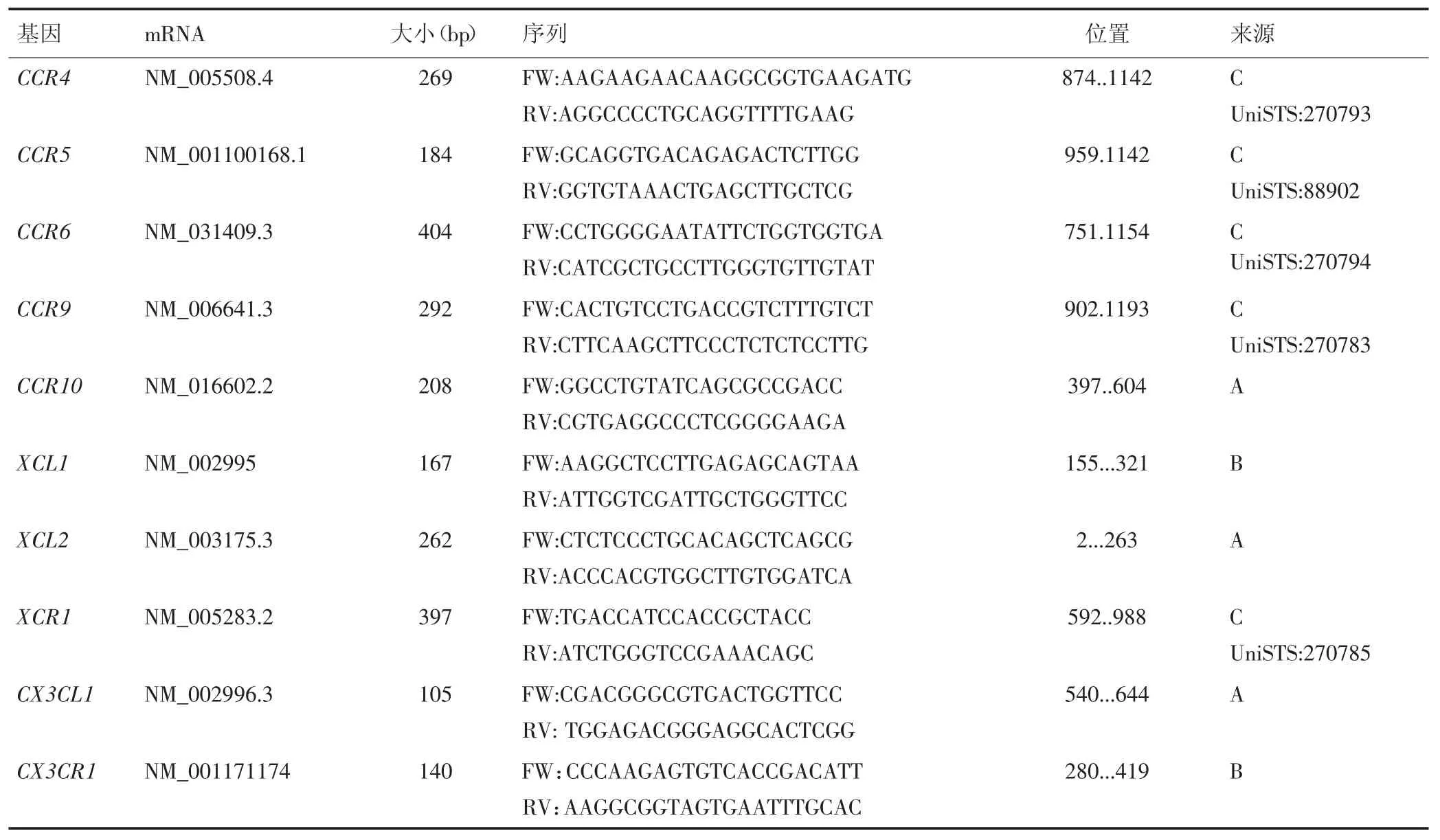
(续表)
1.6 流式荧光微球法检测血清样本CCL18的含量
收集2012年2月至2018年1月于广西医科大学附属肿瘤医院住院并经术后病理确诊的320例卵巢癌和150例盆腔良性肿块患者的血清样本,同时收集2008年于本院进行体检且体检报告正常的100名正常女性的血清样本。根据微球包被试剂盒的操作手册,用CCL18单克隆抗体包被微球,采用Bio-plex 200仪器进行液态悬浮芯片技术检测[6]。
1.7 多中心分析CCL18与卵巢癌预后的关系
通过网站http://kmplot.com分析来自基因表达谱(Gene Expression Omnibus,GEO) 及癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库中卵巢癌患者的表达谱芯片数据,选取经铂类药物治疗及临床分期(依据2012年FIGO分期)为Ⅱ期、Ⅲ期、Ⅳ 期的卵巢癌患者,分析CCL18表达对患者5年无疾病进展生存期(PFS)及10年总生存期(OS)的影响,绘制生存曲线图。
1.8 统计学分析
采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示。3组血清CCL18含量比较采用单因素方差分析,若整体差异有统计学意义,进一步的多重比较采用Bonferroni检验;生存率采用Kaplan-Meier法计算,组间比较行Log-rank检验。采用Cox回归分析CCL18表达水平与PFS和OS的关系,并计算风险比(HR)及其相对应的95%可信区间(CI)。趋化因子相对表达量数据用R语言pheatmap包进行标准化处理后绘制热图。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 流式荧光微球法检测样本血清中CCL18的表达
卵巢癌患者血清中CCL18的表达量为(238.04±93.59)ng/mL,盆腔良性肿块患者血清中CCL18的表达量为(94.36±59.17)ng/mL,正常对照女性血清中CCL18的表达量为(31.68±26.10)ng/mL。卵巢癌和盆腔良性包块患者血清中CCL18的含量显著高于正常对照女性(P<0.001),而盆腔良性肿块患者血清中CCL18的含量低于卵巢癌患者(P<0.001)。见图1。

图1 各组血清中CCL18的含量
2.2 CCL18基因表达水平与卵巢癌患者预后的关系
GEO和TCGA分析结果显示,CCL18高表达患者中位PFS低于低表达者(15.0个月vs 18.2个月),差异有统计学意义(HR=1.25,95%CI:1.08~1.44,P=0.003),见图2A;CCL18高表达患者中位OS低于低表达组(44.5个月vs 45.0个月),但差异无统计学意义(HR=0.92,95%CI:0.79~1.07,P=0.29),见图 2B。
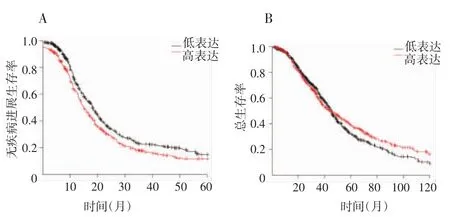
图2 CCL18表达与卵巢癌患者PFS及OS的关系
2.3 CCL18调控的差异表达趋化因子及受体
qRT-PCR检测结果显示,SKOV3-GFP-CCL18组与SKOV3-GFP组、SKOV3组比较,共有23个趋化因子及受体表达异常(P<0.05),其中表达上调20个,包括 CXC 家族 6个(CXCL2、CXCL4、CXCL7、CXCR1、CXCR3、CXCR4),CC 家 族 11 个(CCL2、CCL8、CCL11、CCL13、CCL17、CCL19、CCL24、CCL27、CCR2、CCR3、CCR4),XC 家族 3 个(XCR1、XCL1、XCL2);表达下调20个,包括CXC家族11个(CXCL1、CXCL6、CXCL8、CXCL9、CXCL11、CXCL12、CXCL13、CXCL14、CXCL16、CXCR2、CXC R7),CC 家 族 9 个(CCL5、CCL7、CCL20、CCL23、CCL28、CCR1、CCR5、CCR7、CCR10),见图 3。
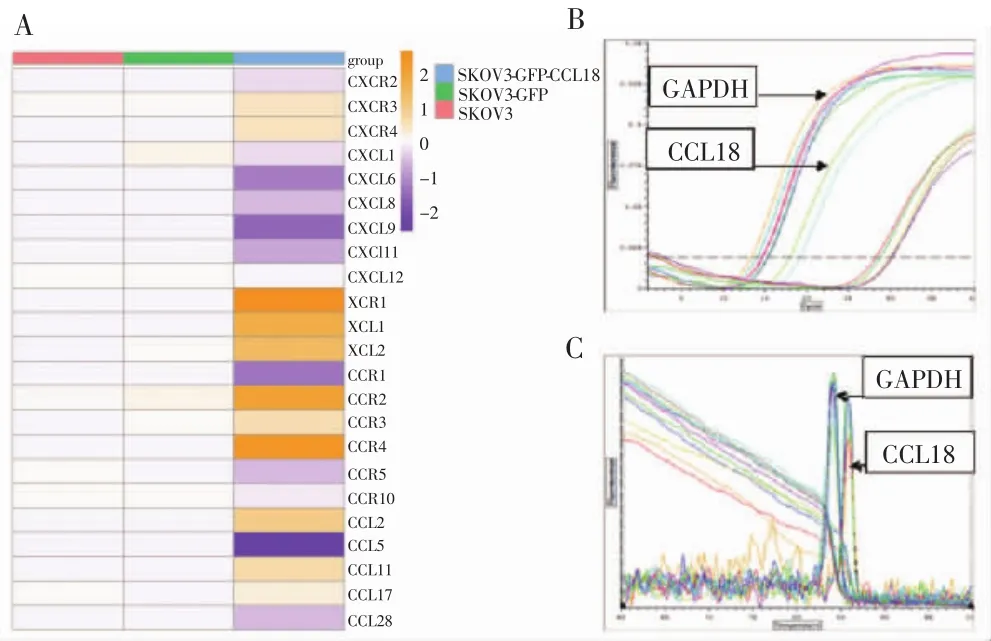
图3 qRT-PCR检测祼鼠移植瘤中趋化因子及受体的表达
2.4 CCL18调控的趋化因子及受体网络分析
将CCL18调控的趋化因子及受体绘制成网络图,可见CCL18主要激活了XCL1-XCR1、XCL2-XCR1、CCL2-CCR2、CCL11-CCR3、CCL17-CCR4、CXCL9-CXCR3、CXCL11-CXCR3、CXCL12-CXCR4趋化因子-受体轴表达,且抑制了CXCL1-CXCR2、CXCL6-CXCR2、CXCL8-CXCR2、CCL5-CCR1、CCL5-CCR5、CCL27-CCR10、CCL28-CCR10趋化因子-受体轴表达,见图4。
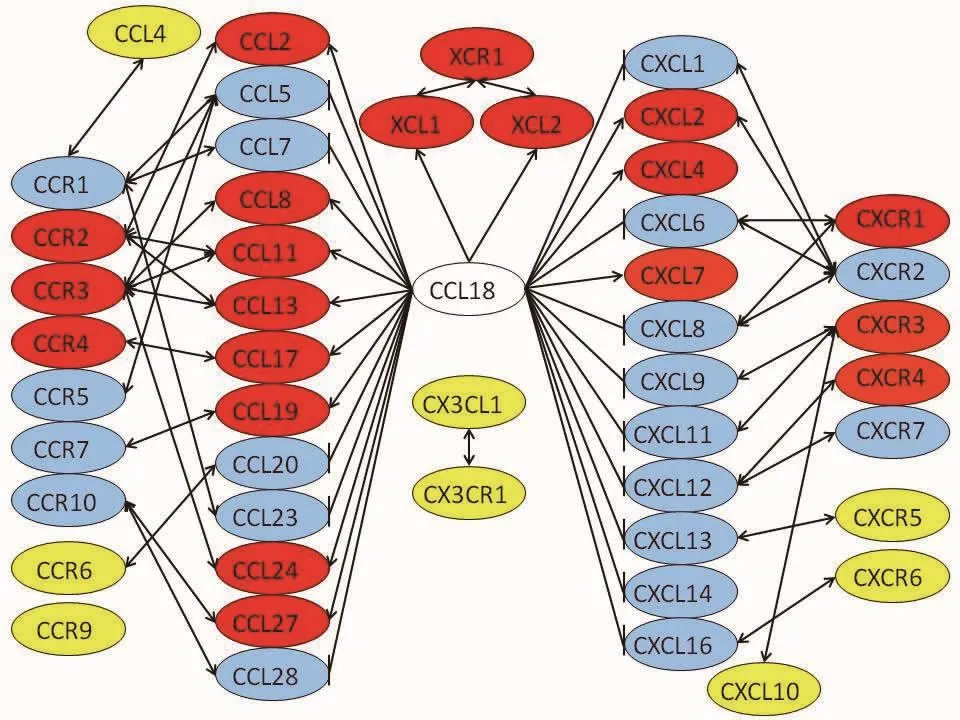
图4 CCL18调控卵巢癌趋化因子的网络示意图
3 讨论
CCL18为本课题组前期筛选的卵巢癌早期血清标志物之一,与CXCL1联合检测可用于卵巢癌早期诊断[1]。与非卵巢癌患者相比,卵巢癌患者血清中CCL18的表达水平显著升高[7],在肿瘤组织中也可检测到CCL18高表达,且其表达量与肿瘤细胞浸润转移相关[5]。前期的细胞功能实验表明,CCL18过表达可促进卵巢癌细胞转移,但细胞的增殖能力与亲本细胞差异不明显[2]。本研究血清CCL18含量的检测结果与之一致,多中心分析CCL18表达量与卵巢癌患者的预后也进一步证实了以上观点。CXCR2是趋化因子 CXCL1、CXCL2、CXCL6 和 CXCL8(IL-8)的受体。癌症干细胞(cancer stem cell,CSC)具有自我更新和分化的特性,可启动和维持癌症生长和进展。siRNA干扰CXCR2表达可以抑制人多能干细胞(human pluripotent stem cells,hPSCs)形成[8],而 CXCR2 被激活可导致乳腺癌CSC自我更新增加[9]。CXCR2也在急性髓性白血病和骨髓增生异常综合征的干细胞群中高表达,且在肿瘤进展中起关键作用[10],CXCL8-CXCR2轴被认为是癌症的重要治疗靶点之一[11]。本研究结果显示CXCL1、CXCL6、CXCL8及其相应受体CXCR2表达下调,认为CCL18抑制肿瘤细胞增殖可能与其影响CXCR2促进肿瘤干细胞生长相关。研究显示,CXCR3过表达与结肠癌、卵巢癌和肝癌等多种肿瘤侵袭转移有关[12-14]。乳腺癌组织中CXCR3表达水平明显高于癌旁组织,且与淋巴结累及数目、肿瘤大小和pTNM分期均呈显著正相关,提示CXCR3是参与乳腺癌转移的重要分子[15]。本研究亦检测到CXCR3表达上调,认为CCL18可能促使CXCR3通路而促使卵巢癌淋巴结转移,可见趋化因子调控网络错综复杂。
CXCL12[基质细胞衍生因子-1(SDF-1)]主要结合CXCR4,趋化因子受体CXCR4属于G蛋白偶联型受体家族,能有效促进乳腺癌细胞迁移、侵袭和转移[16]。CXCR4可在转移的多个关键步骤中促进肿瘤转移,本研究发现过表达CCL18后,CXCL12表达明显受抑制,但CXCR4表达显著升高,推测可能是CXCL12下调后的代偿性升高,也可能是未知的交叉激活机制起作用,有关方面需进一步研究。
研究发现XC趋化因子家族XCL1、XCL2及其相应受体XCR1表达明显上调。XCR1是C族趋化因子受体的唯一成员,在卵巢癌转移中起重要作用。Muralidhar等[17]研究发现XCR1在正常卵巢组织中不表达,而在原发性和转移性人上皮卵巢癌中高表达,XCL1和XCL2可分别结合并激活XCR1,导致表达XCR1的卵巢癌细胞增殖和迁移增加。该研究还发现卵巢癌细胞自身可表达XCL1,卵巢癌患者腹水中亦可检测到XCL2,提示XCL/XCR1驱动的细胞增殖和迁移可能促进盆、腹腔转移,此外给予异位移植的小鼠模型腹腔注射卵巢癌细胞,可观察到卵巢癌向腹膜壁和膈肌的转移能力与卵巢癌细胞表达XCR1高度相关。另一项研究发现,过表达XCR1的人乳腺癌细胞系MDA-MB-231不仅体外生长受到抑制,体内肿瘤发生能力也减弱[18]。本研究发现在CCL18高表达的情况下,XCL1、XCL2、XCR1表达量明显上调,提示CCL18可能通过XCL1、XCL2、XCR1调节细胞增殖和转移信号通路。
CCL2-CCR2趋化因子-受体轴对肿瘤细胞成功转移尤为重要。肿瘤微环境中的癌细胞和间质细胞都能产生CCL2,通过癌细胞表面的CCR2对其产生直接影响,包括在原发部位诱导其增殖、刺激肿瘤细胞向周围基质浸润等。随着肿瘤细胞侵入循环系统,CCL2又可以募集宿主骨髓细胞来加速这一过程[19],因此认为CCL18还能通过CCL2-CCR2趋化因子-受体轴调节恶性肿瘤转移。
趋化因子受体CCR3及其配体CCL11通过自分泌调节的方式参与肿瘤的发展过程。体内实验证实,CCL11可促进EL-4和Ki-JK细胞生长[20],即CCL18过表达启动了细胞表面的CCL11/CCR3信号通路,通过促进ERK1/2磷酸化以及诱导抗凋亡蛋白表达,延长肿瘤细胞的生存周期。趋化因子受体CCR4在肿瘤细胞亲表皮性和淋巴结肿大中发挥重要作用[21]。本研究中亦见CCL17/CCR4高表达,提示CCL18可能启动了与淋巴结转移、表皮浸润相关的通路。CCL5对T细胞、嗜酸性粒细胞和嗜碱性粒细胞具有趋化性,且能将白细胞募集到炎症部位。CCL5还可诱导某些天然杀伤(NK)细胞增殖和活化,形成CC-趋化因子激活的杀伤细胞。而NK细胞通过CCL5和XCL1,将树突状细胞募集到肿瘤微环境中,促进肿瘤的免疫调控,且与患者预后相关[22]。有研究报道CCR5+树突状细胞通过CCL5募集到肿瘤微环境中并引发持续的内源性抗肿瘤反应[17]。本研究发现CCL18过表达可降低CCL5-CCR5趋化因子-受体轴表达,认为CCL18可能抑制CCR5轴的抗肿瘤免疫,从而促进肿瘤转移。CCR10是趋化因子配体CCL28的特异性受体,与皮肤过敏和炎症性疾病有关,CCR10是皮肤免疫稳态的关键调节因子[23]。本研究发现CCL28-CCR10趋化因子-受体轴表达明显下调,说明CCL18过表达可能通过抑制CCL28-CCR10轴打破免疫平衡状态。
综上所述,CCL18可能调控 XCL1-XCR1、XCL2-XCR1、CCL2-CCR2、CCL11-CCR3、CCL17-CCR4的相互作用而促进肿瘤转移,下调CCL5-CCR5、CCL27-CCR10和CCL28-CCR10表达可能使体内抗肿瘤免疫受到抑制,致使肿瘤细胞发生免疫逃逸,造成卵巢癌患者不良预后,但CCL18调控的趋化因子网络功能较复杂,有关方面仍需进一步探索。

