环状RNA的特征及其在畜禽中的研究进展
徐海冬 冷奇颖 PATRICIA Adu-Asiamah 王章 李婷 张丽
(广东海洋大学农学院,湛江 524088)
环 状 RNA(circular RNA,circRNA) 是 一 类新发现的内源性非编码RNA(non-coding RNA,ncRNA)。与传统的线性RNA(linear RNA)相比,circRNA不存在5'和3'端,为共价键连接在的环状闭锁结构,对RNA外切酶(RNase R)具有抗性,表达稳定,不易降解。近几年研究发现circRNA与人类疾病发生关联紧密,成为RNA领域研究的新热点。早期研究认为circRNA是标准RNA剪接的副产物,但随着研究发现,circRNA在真核生物中普遍存在,认为可能具有一定的生物学功能。circRNA来自RNA前体(pre-RNA)的反式剪接,即下游外显子同上游外显子反向结合形成地环形结构。不同序列来源的circRNA可发挥不同的生物学功能。有报导发现circRNA可吸附miRNA发挥miRNA海绵(miRNA sponges)作用,也有报导发现RNA环化与mRNA形成可竞争剪接因子,以此调控目的基因的表达。但是,circRNA的主要作用还未清晰。本文总结了circRNA的发现历程、特征及分类、环化生成及调控机制、主要功能及在畜禽中的研究进展,并对其在畜禽中的研究进展进行了展望,以期为进一步研究circRNA提供一定的理论依据和技术指导。
1 circRNA的发现历程
circRNA是一类新发现具有环形结构的内源性RNA分子,广泛存在于真核生物体内[1]。如表1,circRNA的发现历程有3个阶段:(1)circRNA真实存在性;(2)真核生物中circRNA的普遍性;(3)某个circRNA的功能性研究。

表1 circRNA发现历程简况表
1976年,Sanger和 Kolakofsky[2-3]在植物类病毒和副流感病毒颗粒中首次发现了circRNA。1979年,Capel等[14]在动物细胞和真菌酵母中发现circRNA,之后也在其他真核细胞中发现了circRNA,如在小 鼠SRY[14],大鼠细胞色素P4502C24[5]、人的P4502C18中[6]等。但由于circRNA结构的特殊性及当时有限的研究手段,认为circRNA异常拼接产物。近年来高通量测序技术和生物信息学分析技术迅速发展为circRNA的研究提供了契机。2012年,Danan等[7]在古细菌发现circRNA的普遍存在性,并认为其可能具有生物学功能。Salzman等[8]通过RNA-Seq方法在人体中首次鉴定出约80个circRNA,至此circRNA的研究才正式进入人们的视野。
Jeck等[9]在人类的成纤维细胞中检测出超过25 000个circRNA,Memczak等[15]利用高通量测序结合人类白细胞数据库鉴定出1 950种人类circRNAs,1 903种小鼠circRNAs和724种线虫circRNAs,其中人和小鼠中共有81种circRNAs高度保守。随着大量研究表明,circRNA广泛存在真核生物等高等动物体内,并且在基因表达和机体生长发育中发挥重要作用。例如,circFUT10可抑制牛成肌细胞增殖,促进分化[11];circEIF3J和circPAIP2能促进母基因的线性转录本的表达[12,16];circZNF609具有编码起始密码子和终止密码子的开放阅读框[17];circCDR1as和circSry可与AGO蛋白形成沉默复合体抑制翻译起始[10,18]。目前circRNA被认为是一类新的功能大分子,参与基因表达调控,丰富了真核生物转录调控的多样性和复杂性[9,18]。circRNA的发现为研究细胞发育和基因转录调控的分子机制掀开新的一页,对生命活动的探索具有重要意义。
2 circRNA的特征及分类
2.1 circRNA的特点
目前发现,circRNA广泛存在于不同生物体内的各种类型的细胞和组织中。与线性RNA相比,circRNA是没有游离的5'帽子和3'Poly(A)尾巴的闭合环状结构。由于其闭锁的环状结构,circRNA对RNA外切酶RNaseR不敏感[19],比线性RNA更稳定,不易被降解,大多数circRNA的半衰期超过48 h,而线性 RNA 的平均半衰期只有约 10 h[9,20],这可能是circRNA可以抵抗分支酶和核酸外切酶RNase R的降解。但大部分circRNA在血清外泌体中并不稳定,半衰期小于15 s[21],且容易受其他RNA的干扰。癌细胞和癌组织中circRNA较线性转录本低[22],可能是线性转录本在细胞中易达到合成与降解的平衡,而circRNA更加稳定,在正常增殖的细胞中不断被“积累”,在癌细胞无限增殖过程中被“稀释”。circRNA的长度波动较大,但在大多数真核生物中circRNA具有高度的序列保守性[18,23]。全基因组分析发现来源编码区外显子的circRNA具有高度的序列保守性,但是基因间和内含子来源的circRNA保守性相对较低[18]。
利用一种新的检测工具CIRI explorer2发现了同一基因中一些不保守的外显子只在circRNA中出现,而不存在于线性RNA中。这种只出现在circRNA中的外显子,是因为多个转录本在形成成熟线性RNA时,由于线性RNA的不稳定性而被降解掉,还是因为在形成circRNA时由选择性剪接而特意产生,到目前为止还不清楚。
研究报道发现circRNA在各种生物中表达丰富,其表达水平多数高于母基因的线性转录本[9,15]。而且circRNA表达常具有一定的组织、时序和疾病特异性[15,18]。已知大多数的 circRNA 属于非编码 RNA(non-coding RNA,ncRNA), 但 是 少 数circRNA含有内部核糖体进入序列(Internal ribosome entry site,IRES)可能具有编码能力[24-25]。
2.2 circRNA的分类
circRNA来源于母基因的外显子、内含子、非编码区、反义链转录本或基因间区。根据circRNA序列来源可以分为4大类(表2)[16]:第一类是全部来源外显子的circRNA(Exonic circular RNA,EciRNA);第二类是全部来源于内含子的circRNA(Intronic circular RNA,ciRNA)第三类是来源于外显子和内含子的circRNA(Exon-intron circular RNA,EIciRNA);第四类包括来源于反义链转录本的反义circRNA(Antisense circular RNA)、来源于基因间序列或其他未注释基因组序列的circRNA(Intergenic circular RNA)。绝大多数circRNA属于EciRNA,其序列来源于外显子特别是编码区序列。

表2 circRNA 的分类[12,16]
4大类circRNA除了序列来源不同外,还具有以下区别:(1)EciRNA和EIciRNA整个分子均是由3'-5'磷酸二酯键组成,但是ciRNA接合位点(junction)处由 2'-5'磷酸二酯键连接[26];(2)EciRNA侧翼内含子的长度通常大于内含子的平均长度,并通常含有反向重复序列[9,27];(3)ciRNA通常包含靠近5'剪接位点的7 nt GU富集碱基序列和靠近分支位点(Branchpoint,BP)的11 nt C富集碱基序列[28];(4)EciRNA主要存在于细胞质中[8,23],而 EIciRNA 和 ciRNA 主要存在于细胞核中[26,29];(5)EciRNA 的序列保守性高于 ciRNA 和基因间circRNA的序列保守性[16]。
3 circRNA的生成和调控机制
真核生物RNA是遗传信息从DNA到蛋白质传递的中间媒介,遗传信息在RNA水平上有着广泛且复杂的调控方式,基因在转录后的pre-RNA要经过复杂的加工才能形成成熟的RNA。单个基因位点可以通过经典可变反向剪接(Alternative backsplicing junctions)及经典可变剪接(Alternative splice junctions)产生多种类型的circRNA[30],因此不同来源的circRNA的生成机制也不同。
3.1 EciRNA的生成机制
EciRNA是初级转录产物经过特殊的反向剪接反应(Back-splicing)形成的,是下游外显子序列5'剪接位点(5' splice site,5'SS)与上游外显子3'剪接位点(3'splice site,3'SS)反向连接生成了circRNA(图1)。目前有两种模型解释了EciRNA反向剪接形成机制:(1)依赖于剪接体的套索驱动环化模型(外显子跳跃)(Lariat-driven circularization)(图 1-B);(2)内含子配对驱动环化模型(Intron-pairing-driven circularization)(图 1-C)。
套索驱动环化是由pre-mRNA在剪接过程中部分RNA发生折叠,拉近了非相邻外显子距离,发生外显子跳跃(Exon skipping)的经典剪接(图1-B)。被跳过外显子的上游剪接受体(Splice acceptor,SA)和下游剪接供体(Splice donor,SD)共价结合形成包含外显子的套索前体(Exon-containing lariat precursor),该前体通过内部剪接去除内含子,形成EciRNA[31]。某些个circRNA中存在线性mRNA缺失的外显子,保护了这些外显子不被降解掉,这说明外显子跳跃是形成circRNA的合理机制[8-9]。许多EciRNA侧翼连接点有规范的剪接信号[9-10],经典的剪接位点决定了外显子环化效率[32],抑制经典剪接体会导致circRNA水平降低[32],这些都表明经典的剪接体机制是circRNA生成所必需的。酵母中大多数的circRNA都是由外显子套索前体产生[33]。
内含子驱动环化是位于侧翼内含子区域反向互补序列(Flanking intronic regions reverse complementary sequences,RCSs)(如Alu原件等)(图1-C)互补配对,这会诱导下游外显子序列的5'SS反向接近上游外显子3’SS,有效地促进了反向剪接的发生[9],随后剪接体切除剩余内含子形成环形RNA分子[34]。当内含子没有被完全剪切掉,保留在新生成环状外显子之间,就会形成EIciRNA类型的分子。
“套索驱动”和“内含子配对驱动”的主要区别是先发生经典剪接还是反向剪接[35]。“套索驱动”是先发生经典剪接,产生一个线性RNA和一个包含外显子的内含子套索,随后内含子套索通过反向剪接生成circRNA[36]。“内含子配对驱动”是先发生反向剪接,并直接生成circRNA[9]。哺乳动物中大多数EciRNA是由内含子配对驱动生成的,而低级的真核生物中的EciRNA则是大多由套索驱动生成[33]。
3.2 EciRNA环化调控机制
有研究发现外显子环化与线性剪接竞争剪接因子,进而与线性RNA存在竞争关系,circRNA的环化效率也受到剪接因子的调节[16],如一些顺式元件(cis-acting splicing regulatory elements)和反式原件(trans-acting splicing elements)(图 1)[16]。
研究发现单个外显子的circRNA(single exon circular RNA)长度通常大于多个外显子的circRNA(Multiple exon circular RNA)的平均长度[8]。Eci-RNA侧翼内含子含有倒置重复序列(如Alu等)(图1-C)[16],并且通常含有多个重复序列[8]。这些序列存在竞争性配对,调节环化效率并造成可变环化,致使同一个母基因可以形成由不同外显子和内含子组成的多样型circRNA[27-28]。有研究发现只有30-40 nt短侧翼反向重复序列就足以促进环化[8],但这种侧翼区反向互补重复序列不一定有效诱导外显子环化,大多数的circRNA由短散在核重复序列(Short interspersed nuclear elements,SINEs)驱动形成,这说明内含子配对的稳定性是circRNA生成的必要条件[37]。
RNA结合蛋白(RNA-binding proteins,RBPs)可以通过与内含子中一些短的顺式元件结合发挥作用(图1-D),促使下游外显子序列的5'SS反向接近上游外显子的3'SS,形成有利于反向剪接的结构,促进外显子环化[16]。在人和果蝇体内发现剪接因子盲肌蛋白(Muscleblind,MBL/MBNL1)可以结合到来源于第二外显子circMbl的pre-RNA内含子的MBL结合位点,使两个内含子靠近,从而促进circMbl生成[38]。震动蛋白(Quaking,QKI)能特异识别NA-CUAAY核心(core)及UAAY半位点(half-site)[39],牵拉结合点相互缩小空间距离,在人类上皮细胞-间质细胞转化(Epithelial-mesenchymal transition,EMT)的过程中诱导 EciRNA 生成[16]。脂肪瘤融合蛋白(Fused in sarcoma/Translocated in liposarcoma,FUS/TLS)可结合到内含子侧翼区,调控circRNA的形成[40]。有报道称提高RNA聚合酶II转录延伸率(RNA-Pol II transcription elongation rate)可以增加初始circRNA的表达水平[41]。
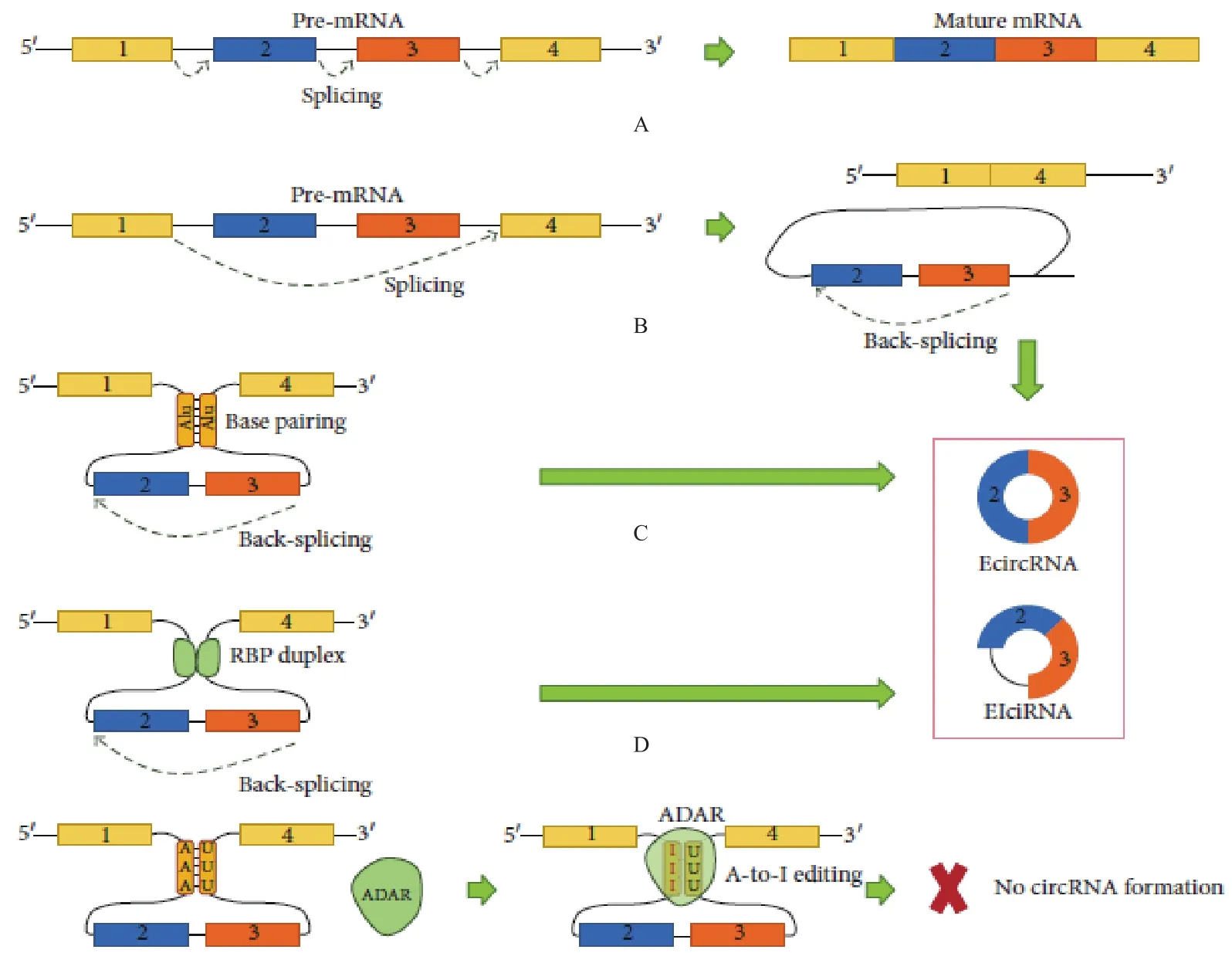
图1 circRNA的生成示意图[16]
有报道发现RNA编辑酶腺苷脱氢酶(Adenosine deaminase,ADAR)可以结合RNA双链,通过将腺苷酸转变成肌苷酸(A变成I)(图1-E)。环化外显子侧翼区重复序列的双链产生U:I错配,使RNA双链结合能力减弱[34]。ADAR高表达会损伤mRNA前体环状配对序列,减少circRNA的生成[16]。在人和线虫中发现,ADAR的缺失造成circRNA的表达水平异常上升[34]。
EciRNA的生成是多个顺反调控原件共同调节的结果。例如,Laccase基因的环化受到内含子重复序列和RNA结合蛋白的调控[42],ADAR也会减弱RNA的内含子配对,控制circRNA的生成。
3.3 ciRNA的生成机制
ciRNA是由含有特殊序列内含子在剪接过程中逃避脱支酶(Debranching enzyme,DBE)消化形成的circRNA[12]。这类内含子在3'SS端的分支位点(BP)附近含有11 nt C富集序列,在5'SS附近含有7 nt GU富集序列(图2),这些序列形成的特殊结构会阻止脱支酶与之结合[16,28]。
剪接过程中两个原件结合先形成包含外显子和内含子的套锁中间体(Lariat),再在脱支酶和核酸酶作用下形成ciRNA。其过程包括两次转酯反应(图2):首先分支位点(Branchpoint,BP)的2'-OH攻击外显子5'SS,形成内含子套索结构,而后5'外显子的3'-OH攻击下游外显子3'SS,释放线性内含子并将外显子顺序连接,最后线性内含子释放3'尾巴后形成2'-5'连接的内含子来源的circRNA。正常内含子套索则是在脱支酶作用下被解开,再被核酸外切酶消化,而含有11 nt C和7 nt GU特殊序列的内含子套索会限制脱支酶与之结合,残余的部分线性RNA序列会被核酸外切酶降解[12]。不同于EciRNA,ciRNA对RNA脱支酶不敏感,并含有2'-5'接合点(Junction)[26]。ciRNA和 EIciRNA 主要存在于细胞核中调控基因表达[16]。
也有研究发现前体tRNA能剪切成环形成tricRNA(tRNA intronic circRNA)[43],tRNA 剪接内切酶复合体通过识别前体tRNA内特殊的膨胀-螺旋-膨胀(BHB)的结构序列,切除反密码子环中的内含子[38],此部分内含子两端相连接形成tricRNAs[44]。有研究报道,在白血病患者中的PML/RARα基因上发现,了2个因染色体异位融合的 circRNA(fusion circRNA,f-circRNA)[45]。因此,circRNA的生源机制有待进一步探索明确。
4 circRNA的功能
circRNA广泛存在于各个物种中,大多数真核生物的circRNA具有序列保守性,表达呈现一定的组织特异性和发育阶段性,这表明circRNA是一种功能分子。有报道发现circRNA具有调控基因转录、调控蛋白质翻译、吸附miRNA等功能,也有报道发现一些circRNA具有编码多肽的能力(图3)。
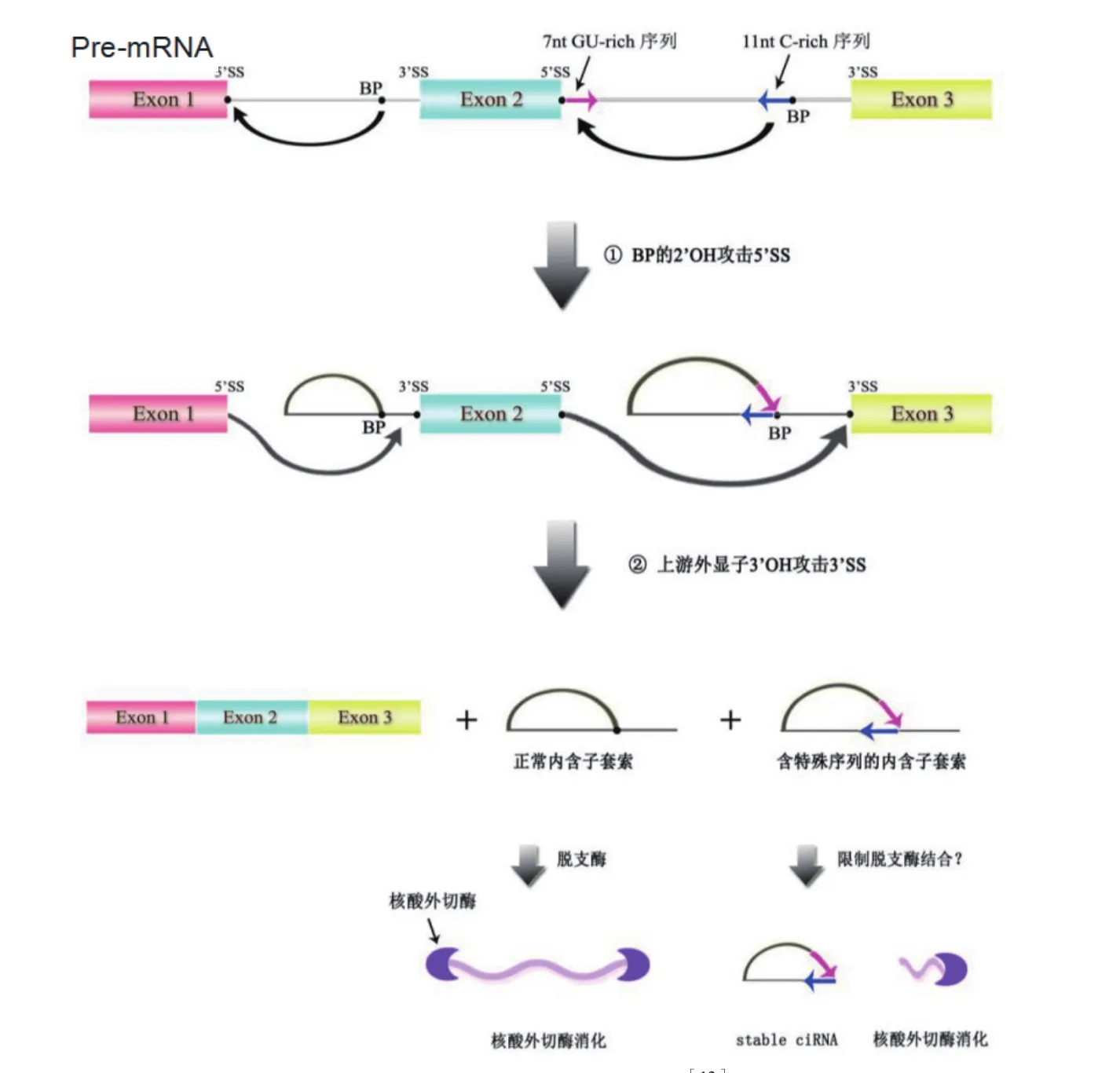
图2 ciRNA的生成机制[12]
4.1 circRNA可调控基因转录
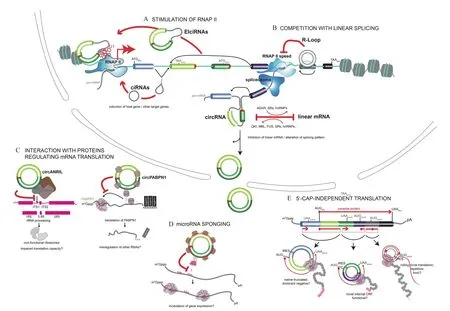
图3 circRNA功能示意图[46]
CircRNA可与转录因子结合调控基因转录(图3-B)。EciRNA可以与细胞内某些蛋白质分子特异性结合,作为脚手架(Scaffold)与RNA或DNA结合,为RBP、RNA、DNA之间互作提供平台。这些转录因子包括 RNA 聚合酶 II、Quaking(QKI)[16]、EIF4A3[47]和 MBL[38]等。例如,circMbl上含有MBL 结合位点[32],而 MBL 会促进circMbl和MblmRNA的生成。因此circMbl作为自我调节分子会减少circMbl和MblmRNA的合成[48],提高果蝇和人细胞内线性剪接水平,会使circRNA的生成量明显减少[49-50]。细胞核中位于转录位点附近的内含子锚蛋白重复结构域52(ci-ankyrin repeat domain 52,ci-ankrd 52)和内含子沉默信息调节因子7(Silent information regulator 7,ci-sirt 7)[26], 可 联 合 RNA聚合酶II复合体,顺式调节母基因的线性转录本表达。circEIF3J和circPAIP2会与U1小核核糖核蛋白(U1 small nuclear ribonucleoprotein,U1 snRNP)相互作用于基因转录起始位点上游300 bp处,顺式方式调控母基因线性转录本的转录[12,16]。circRNA还可以通过与线性转录本竞争剪接的方式调控母基因的表达。线性剪接与反向剪接的竞争决定了circRNA和母基因线性转录本的表达水平。来源于小鼠甲酸精基因(Formin,Fmn)的circFmn包含了转录起始位点,遗留了一个非编码的线性转录物,因此circFmn可作为mRNA陷阱(mRNA trap)隔离转录起始位点,降低Fmn蛋白的表达水平[51]。
4.2 circRNA与蛋白质相互作用
也有报导circRNA与RBP结合能发挥生物学功能(图3-D)。circCDR1as和circSry可与miRNA的效应因子AGO相结合,形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC)[10,18],占据了mRNA的翻译起始位点,抑制翻译起始。CircANRIL可与pre-rRNA竞争性结合PES1蛋白,抑制核酸外切酶对结合PES1蛋白后的pre-rRNAs加工过程[52],表明circANRIL影响核糖体成熟,阻碍蛋白质翻译,进而导致细胞凋亡。circFOXO3与细胞周期依赖性激酶2(Cyclin-dependent kinase 2,CD-K2)、P21形 成circFOXO3-CDK2-P21三 元 复合物抑制细胞周期[53]。CDK2与细胞周期蛋白E(Cyclin E)结合形成cyclin E-CDK2复合物,促进细胞G1期向S期过度;CDK2也可与细胞周期蛋白A(Cyclin A)结合形成cyclin A-CDK2复合物,促使细胞完成S期。P21结合CDK2可抑制CDK2与cyclin A、cyclin E的结合,circFOXO3-CDK2-P21三元复合物增强了P21对CDK2的抑制作用,避免了cyclin E-CDK2复合物的形成,阻断细胞从G1期进入S期,同时也避免了cyclin A-CDK2复合物的形成,使细胞停滞在S期或发生凋亡。circFOXO3在细胞质中还可以与抗衰老相关蛋白分化抑制因子1(Inhibitor of differentiation-1,ID1)、E2F1 转录因子(E2F transcription factor 1,E2F1)以及抗应激黏着斑激酶(Facal adhesion-associated protein kinase,FAK)、HIF1α结合,阻碍这些蛋白进入细胞核或线粒体,从而促进心肌细胞衰老[54]。
4.3 circRNA作为miRNA海绵
MicroRNA(miRNA) 是 一 种 大 约 22 nt的ncRNA分子,通过与目的基因mRNA的3’UTR结合降低目的基因的表达水平。circRNA含有大量的miRNA应答原件(miRNA response elements,MREs),可吸附miRNA(图3-A),发挥miRNA海绵功能,降低miRNA对其靶基因的抑制作用。由此可见circRNA可作为竞争性内源RNA(Competing endogenous,ceRNA)在转录后水平调控靶基因的表达[16]。例如,来源于小脑退行性相关蛋白1反义转录本(Cerebellar degeneration-related 1 antisense transcript,CDR1as)的circRNA 具有 70个 miR-7结合位点,可调控胰岛素受体底物1(Insulin receptor substrate-1,IRS-1)等多个靶基因的表达[18]。有研究表明miR-671与CDR1as结合后会使得CDR1as裂解,并可释放与之结合的miR-7[55]。阿格蛋白(Argonature,AGO)可与CDR1as结合,使CDR1as免于降解及结合miR-7。circHIPK3可结合miR-124-3p和miR-338-3p调控β细胞Slc2a2、Akt1、Mtpn等关键基因表达[56]。来源于Y染色体性别决定基因(Sex-determining region Y,SRY)的circSry具有16个miR-138结合位点,可吸附miR-138调节肿瘤的侵袭、发展和转移[55,57]。circFUT10可以结合 miR-133a进而抑制牛成肌细胞增值、促进分化[11];circMTO1可以吸附miR-9抑制人肝癌细胞增值性和侵染性[58];circZFR可吸附miR-130a和miR-107抑制人胃癌细胞增殖和促进凋亡[59];circRBFOX2s可吸附miR-206促进鸡成肌细胞增殖[60-61]。对比lncRNA等线性miRNA海绵分子,circRNA不易被RNA外切酶降解,具有较高的稳定性和时效性[16,58]。一些研究表明哺乳动物中的circRNA很少包含大于10个以上的miRNA结合位点,这可能与circRNA本身的稳定性有关[36]
4.4 circRNA可翻译功能蛋白质
有些circRNA含有可编码多肽。目前报道的circRNA翻译机制有两种:(1)依赖内部核糖体嵌入位点(Internal ribosomal entry site,IRES)(图3-C);(2)依赖 N6-甲基腺苷(N6-methyladenosine,m6A)甲基化修饰。人circSHPRH可利用重叠密码子翻译功能蛋白质抑制胶质瘤生成[13]。丁型肝炎病毒(Hepatitis D virus,HDV)核心的负链circRNA可编码122个氨基酸的HDV抗原(Hepatitis D virus antigen,HDAg)[62]。 人circ-FBXW7也 含 有 IRES,可编码21 kD的蛋白质,抑制U251和U373癌细胞的增殖[63]。部分circRNA虽无IRES,仍能结合核糖体启动翻译。如在人和小鼠的成肌细胞中发现具有开放阅读框(Open reading frame,ORF)[17]的circZNF609可翻译蛋白质。Pamudurti等[64]在果蝇大脑组织中通过核糖体印迹鉴定出circMBL的终止密码子处有核糖体结合,并通过蛋白质谱分析得到了circRNA翻译的蛋白质。研究发现m6A甲基化修饰会促进circRNA的翻译[17],皆因此类circRNA起始密码子上含有RRACH(R=G或A;H=A、C或U),该序列中的A碱基可被甲基化酶复合体METTL3/14甲基化,促使YTHDF3可之结合,并招募eIF4G2和其他翻译起始因子,启动circRNA的翻译[17]。此cricRNA没有终止密码子,若翻译起始,circRNA的环状结构可使核糖体通过类似滚环扩增(Rolling circle ampli fi cation,RCA)的机制参与多肽延长。
4.5 circRNA参与细胞通讯和信号转导
也有报道circRNA可调控细胞通讯和信号转导。血清等外泌体的circRNA与胞质中存在显著差异,表明circRNA进入外泌体是一个选择性过程,可能作为细胞间物质传递、信息交流的途径[29]。分泌小泡(含外泌体)中circRNA比线性RNA比例较高[65],表明分泌小泡是细胞选择性释放和清除内源性circRNA的一种机制。CircRNA也可调节mRNA的稳定性,例如mcircRasGEF1B可调控脂多糖(LPS)诱导的细胞间黏附因子(ICAM-1)mRNA的稳定性,敲低mcircRasGEF1B会影响LPS诱导的ICAM-1的表达[66]。
综上所述,circRNA是一类新发现的分子,具有不同的分子特点和形成机制,关于其功能研究还有待深入。circRNA在物种中具有较高的序列保守性,具有调控机体生长发育和新陈代谢的功能,在遗传品种改良和品系选育的工作中,有望作为分子育种的新靶点。
5 circRNA在畜禽中的研究进展
畜禽的经济性状与疾病防控是动物科学关注的重点。近年来,circRNA在该领域的研究也是如火如荼,为挖掘农业动物重要经济性状遗传机制和调控网络提供了新思路。
5.1 circRNA在家畜中的研究进展
家畜繁殖机能、生长发育、肌肉发育、脂肪沉积、产毛(绒)量、产奶量和疾病发生等是畜牧业关注的重要经济性状。研究发现,circRNA参与家畜大脑、卵巢、肌肉、脂肪、心脏、肝脏和乳腺等性状的发育和疾病发生过程。
在肌肉和脂肪发育方面,Liang等[67]从贵州小型猪脂肪、心肌等9种不同组织及3个发育阶段的骨骼肌中鉴定出了5 934个circRNA,绘制了猪circRNA的时空表达谱,确定了149个与肌肉生长发育、肌肉收缩、染色质修饰、阳离子平衡、ATP水解耦合的阳离子转运、细胞紧密连接及钙离子信号通路有关的circRNA。并构建了首个小型猪的circRNA数据库。Chen等[68]采集180 d和8年雅南母猪的心肌和背最长肌,通过RNA-seq发现了心肌样本中26个mRNA、4个lncRNA、22个miRNA和26个circRNA差异表达;骨骼肌样本中81个 mRNA、5个 lncRNA、79个 miRNA和 62个circRNA差异表达,由此可见心肌和骨骼肌的衰老过程中存在差异。在肌肉老化过程中,Chen等[68]还评估了多重共调控关系,构建了circRNA-miRNA-mRNA共表达网络,为研究肌肉老化的分子机制提供了良好的基础。Sun等[69]研究蓝塘猪和长白猪肌肉组织中差异表达的编码基因、lncRNA、circRNA及miRNA,结果在蓝塘猪中发现有1 401个circRNA高表达,2 959个circRNA低表达,其中有236个是与肌肉发育相关的,并发现有40个circRNA参与miRNA介导的ceRNA调控网络。
Li等[70]利用RNA-Seq方法研究胚胎期和成年期哈萨克羊背最长肌组织中的circRNA,共鉴定出6 113个circRNA,功能分析发现circRNA的母基因主要富集在肌肉生长和发育相关的信号通路,oar_circ_0000385、oar_circ_0000582和 oar_circ_0001099具有肌肉发育相关miRNA的多重保守位点。Wei等[71]分析胚胎期和成年期秦川牛的背最长肌中差异表达的circRNA,共鉴定出12 981个circRNA,其中有624个在成年牛中高表达,204个低表达。典型的是circLMO7,过表达circLMO7会吸附miR-378a-3p抑制成肌细胞分化,使得细胞周期中S期细胞数量增加,G0/G1期细胞数量减少,促进细胞增殖,抑制细胞凋亡。同课题组Li等[11]发现circFUT10可以结合miR-133a促进成肌细胞分化,使得细胞周期中G0/G1期细胞数量增加,S期细胞数量减少,抑制细胞增值,促进细胞凋亡。Li等[72]发现circFGFR4可以吸附miR-107,促进Wnt3a基因表达,进而促进成肌细胞分化诱导细胞凋亡,对细胞增殖没有显著影响。
在大脑和生殖系统研究方面,VenØ等[73]对猪胚胎发育期大脑组织测序共发现4 634个circRNA具有时间表达差异,皮质部circRNA的表达丰度最高,这表明circRNA对于猪胚胎期脑部发育具有重要调控作用。Li等[74]利用RNA-seq研究产前、产后哈萨克羊脑垂体中差异表达的circRNA发现,大量的circRNA参与垂体激素分泌及相关通路,oar_circ_0000059具有58个与垂体相关的miRNA结合位点,并且40个circRNA包含至少1个IREs和ORF,这表明circRNA广泛参与垂体的发育和分泌功能。Tao等[75]通过麻城黑山羊和波尔山羊排卵前后卵泡组织RNA-seq分析,共检测出1 395个circRNA,其中有37个差异表达。GO和KEGG分析发现大量circRNA参与卵巢类固醇生成和P53信号通路。其中chi_circ_0008219可与3个卵泡相关的miRNA相结合,表明circRNA对母羊卵巢卵泡有潜在影响。
在泌乳性能研究方面,Zhang等[76]研究产后90 d和250 d荷斯坦奶牛乳腺组织中差异表达的circRNA,共鉴定出6 621个circRNA,其中有2 231个共表达。功能富集分析发现来源于4个酪蛋白 编 码 基 因(CSN1S1、CSN1S2、CSN2和CSN3)的circRNA在90 d奶牛乳腺组织中高表达,这些circRNA也具有miR-2284的结合位点,而miR-2284可与CSN1S1和CSN2的mRNA结合,由此猜测这些circRNA可能参与酪蛋白的表达调控。Zhu等[77]对分娩后1、7和21 d大鼠的乳腺组织高通量测序,发现并鉴定了来源于Tc2n基因Exon10和Exon11的circRNA(cTc2n)。定量检测发现cTc2n在乳腺中高表达。cTc2n在这三个时间点的表达变化呈现先显著下降、后轻微上升的趋势,而Tc2nmRNA呈现相反的趋势。生信分析发现cTc2n不存在miRNA结合位点,而Exon10和Exon11编码Tc2n蛋白的保守区域,推测cTc2n可抑制Tc2nmRNA的产生。
在动物疾病发生研究方面,小鼠作为畜牧学科研究的模式动物,在家畜研究中应用广泛,尤其是在疾病研究方面。Pei等[78]通过将小鼠暴露在氡辐射的条件中,通过对肺组织RNA-aeq发现107个circRNA上调,83个circRNA下调,其中30个高表达的circRNA具有多个miRNA结合位点,表明circRNA可能参与氡诱发的肺损伤的病理变化。Huang等[79]对水迷宫测试后的5月龄、10月龄SAMP8鼠和SAMR1鼠的海马体RNA-seq,发现mmu_circRNA_017963与自噬体组合、胞外分泌、细胞凋亡、RNA剪接、突触囊泡循环等多个过程,表明circRNA参与阿兹海默症的发生。Errichelli等[40]通过体外培养老鼠和人的胚胎干细胞,改变RNA结合蛋白FUS的表达水平,检测circRNA的变化,发现FUS可结合到侧翼内含子区,调节circRNA的形成。关于人肿瘤研究中,活体实验常在小鼠皮下异体移植人癌变的肿瘤,再通过注射过表达载体或干扰片段来改变特定circRNA的表达,研究发现circRPKCI[80]、circ-Amotl1[81]、circCDYL[82]、circHIPK3[83-84]、hsa_circ_0007385[85]、hsa_circ_00126-73[86]、circCCDC66[87]和 circRNA_100782 等 circRNA 分子可促进肿瘤生长,circ-FBXW7[63]、circ-ITCH[88]、circC3P1[89]、circFoxo3[90]和cirZKSCAN1[91]等circRNA分子可抑制肿瘤生成。
5.2 circRNA在家禽中的研究进展
在家禽的研究中,circRNA在生长发育、肌肉发育、产蛋量和疾病防治中的作用是人们主要关注的内容。
Ouyang等[60-61]采 集 11胚 龄(E11)、16胚龄(E16)、1日龄(P1)杏花鸡母鸡的腿肌,通过RNA-seq共鉴定出13 377个circRNA,其中有1 470个差异表达,有946个circRNA具有一个或多个miRNA结合位点,共涉及150个已知miRNA分子。进一步分析发现鸡circRBFOX2.2-3和circRBFOX2.2-4可吸附miR-206,促进鸡成肌细胞增殖,抑制成肌细胞分化,鸡circSVIL.6-14可结合miR-203,促进成肌细胞增殖和分化[12,92]。利用iTRAQ技术鉴定出差异表达蛋白,并与circRNA的数据联合分析,结果在E11 和 P1比较组发现23个差异蛋白基因具有差异表达的circRNA。包括肌肉收缩通路相关的基因DMD、TNNT3、TNN、TPM1、TPM2和TPM3,其中DMD和TNN基因含有多个差异的circRNA[60]。由此可见,在鸡胚胎期肌肉发育过程中,circRNA通过吸附miRNA或参与调控蛋白表达等方式调控肌肉发育。
此外,Zhang等[93]用鸡禽白血病 J(ALV-J)亚型侵染ALV抗性和ALV敏感性鸡,20周后采集肝脏组织。RNA-seq鉴定出1 800多个circRNA,其中有32个circRNA差异表达。且发现在ALV抗性组中的12个circRNA存在多个miRNA分子结合位点,基因功能富集分析发现主要集中于免疫通路。这表明circRNA可能参与ALV-J引起的免疫过程。
6 展望
目前对于circRNA的研究仍处于起步阶段,有大量技术问题需要突破。随着高通量测序和生物信息学的快速发展,将会有越来越多的circRNA被发现,其功能研究会越来越深入。circBase[94]、Circ2Traits[95]、CircNet[96]等数据库中收录了近 10万circRNA测序结果,并能预测circRNA-miRNA-mRNA相互作用。circRNA过表达载体和干扰手段不断趋于成熟,使人工调控细胞内circRNA的表达成为可能,利于进一步探索circRNA的功能[18,97]。CircRNA与疾病发生密切相关,可作为癌症等疾病监测的新型靶标分子[58]。在畜禽研究方面,主要集中在生长发育、肌肉发育等经济性状相关的circRNA的研究。对于circRNA的功能注释仅限于circRNA的来源编码基因或可能的miRNA结合位点进行预测分析,因此需进一步探索circRNA作用网络,研究circRNA在基因表达调控的作用,加深畜禽的经济性状相关circRNA的筛选与鉴定,更好的为畜禽分子育种提供理论依据和技术指导。

