胰岛α细胞功能与2型糖尿病肾脏病变相关性研究
严玲玲 ,苏建彬 ,王雪琴
1.江苏省南通市如东县人民医院内分泌科(如东226400),2.江苏省南通市第一人民医院内分泌科(南通226001 )
主题词 糖尿病, 2型 糖尿病肾病/病理生理学 胰岛素分泌细胞 胰高血糖素/诊断 肾小球滤过率 白蛋白尿
根据国际糖尿病联盟(International Diabetes Federation ,IDF)2015版的数据显示,全球糖尿病(DM)患者已高达4.15亿,其中2型糖尿病占90%以上[1]。糖尿病肾脏疾病(Diabetic kidney disease,DKD)是糖尿病常见的慢性并发症,是终末期肾脏病的重要病因[2]。2型糖尿病并发肾病的患病率约为34.5%[3]。而终末期肾脏病治疗费用高,严重影响了广大患者的生存质量,增加了家庭及社会的经济负担。因而安全有效的降血糖的同时改善肾功能、延缓糖尿病肾病的进程,对于糖尿病肾病患者的预后具有重要的意义。鉴于胰岛α细胞可能在糖尿病肾脏病变的发生与发展中有着重要的作用,故本研究观察2型糖尿病肾脏病患者胰岛α细胞功能的变化,探讨胰岛α细胞功能与eGFR及UACR的相关性。
对象与方法
1 研究对象 选取2015年8月至2018年3月期间在南通市第一人民医院内分泌科住院的2型糖尿病患者2173例。入组标准:①符合世界卫生组织(WHO)1999年诊断标准[4]的2型糖尿病患者;②平均年龄20~80岁;③确保患者完全知情并自愿参与。排除标准:①1型糖尿病、继发性糖尿病、及其他类型的糖尿病;②糖尿病酮症酸中毒、高血糖高渗状态;③孕妇及哺乳期妇女;④有胃肠手术史或严重胃肠疾病;⑤原发性肝脏、肾脏疾病、心脏病、急慢性胰腺炎病;⑥恶性肿瘤;⑦影响糖代谢的疾病如甲亢、库欣综合征等;⑧血糖控制不佳而使用了Glp-1受体激动剂和DPP4抑制剂者。
2 研究方法 收集患者的相关临床资料,包括年龄、性别、血压、糖尿病病程、糖尿病治疗方案、体重指数(BMI)、血脂谱、糖化血红蛋白(HbA1C)、尿素氮(BUN)、血肌酐(Scr)、血尿酸(UA)、尿白蛋白和尿肌酐等。参照2006年我国预估肾小球滤过率协作组制定的适用于中国人的改良MDRD公式计算患者的肾小球滤过率(eGFR),同时计算患者尿白蛋白/肌酐比值(UACR),以UACR≥30mg/g定义为白蛋白尿。所有患者进行口服糖耐量试验,检测0 min、30 min、60 min、120 min和180 min血糖、胰岛素和胰高血糖素水平,并以血糖曲线下面积(AUCglu),胰岛素曲线下面积(AUCins),胰高血糖素曲线下面积(AUCgla)分别来评估总体血糖、胰岛素和胰高血糖素水平。
血糖曲线下面积计算:AUCglu=15×空腹值+30×(30min值+180min值)+45×60min值+60×120min值
胰岛素曲线下面积计算:AUCins=15×空腹值+30×(30min值+180min值)+45×60min值+60×120min值
胰高血糖素曲线下面积计算:AUCgla=15×空腹值+30×(30min值+180min值)+45×60min值+60×120min值
eGFR(ml/min/1.73m2)改良MDRD公式:男性:eGFR=175×血清肌酐(Scr)-1.234×年龄-0.179 女性:eGFR=[175×血清肌酐(Scr)-1.234×年龄-0.179]×0.79
3 统计学方法 用SPSS 19.0软件进行分析。表中的正态分布值为平均值±标准差,非正态分布值为中位数(25%和75%),分类变量为频率(百分比)。连续变量和分类变量的值分别采用方差分析和卡方检验。应用线性回归分析AUCgla与eGFR的相关性,应用logistic回归分析四组白蛋白尿的发生风险,P<0.05为差异有统计学意义。
结 果
1 根据AUCgla四分位水平分组(Q1、Q2、Q3和Q4组),eGFR从Q1、Q2、Q3至Q4组呈下降趋势(P<0.05),而UACR和白蛋白尿发生率从Q1、Q2、Q3至Q4组呈升高趋势(P<0.05),见表1。
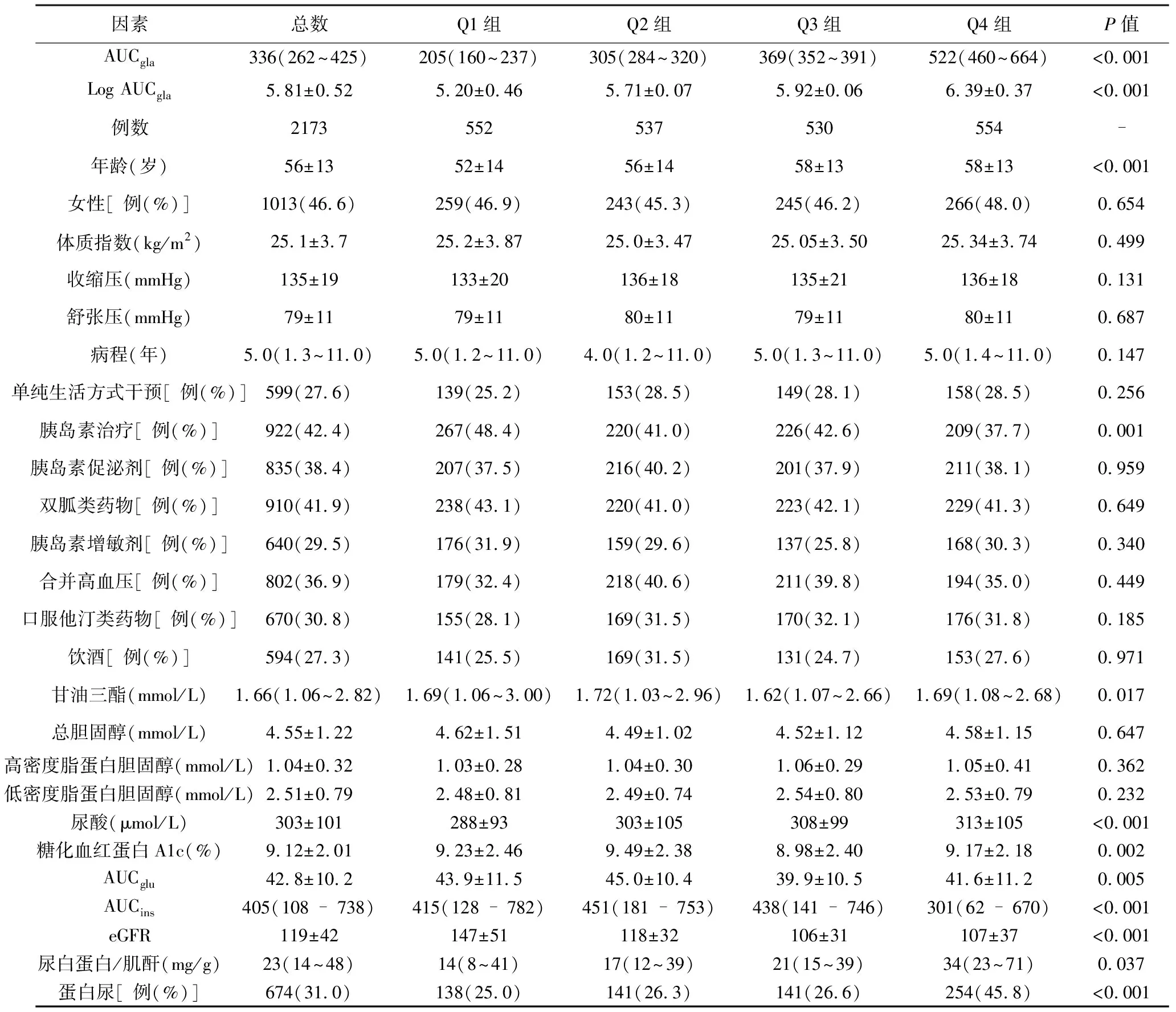
表1 四组患者临床特征比较
2 线性相关分析提示eGFR与AUCgla呈明显负相关(r=-0.367,P<0.05,图1)。
3 进一步使用多元线性逐步回归分析校正临床其他危险因素,AUCgla是eGFR的危险因素(β= -0.143,t= -7.465,P=0.000校正partial R2=5.28%),见表2。
4 白蛋白尿发生率在Q1、Q2、Q3至Q4组分别为25.0%,26.3%,26.6%和45.8%,以Q1为对照,Q4组白蛋白尿发生风险(OR)为2.54(95%CI 1.97~3.28),进一步使用logistic回归分析校正临床其他危险因素,Q4组白蛋白尿发生风险OR为2.34(1.74~3.15),见表3。
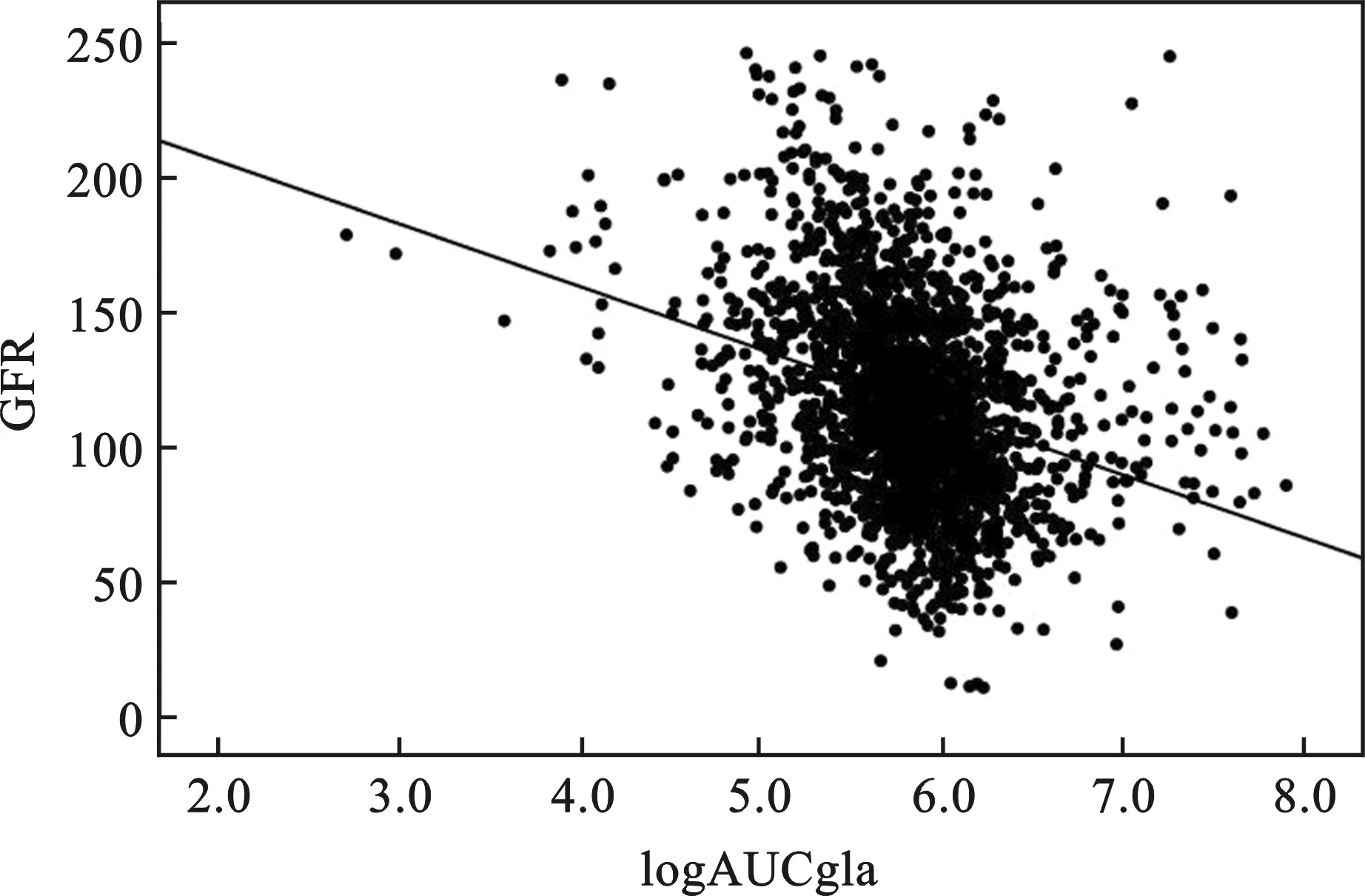
图1 eGFR与AUCgla线性相关(r=-0.367)
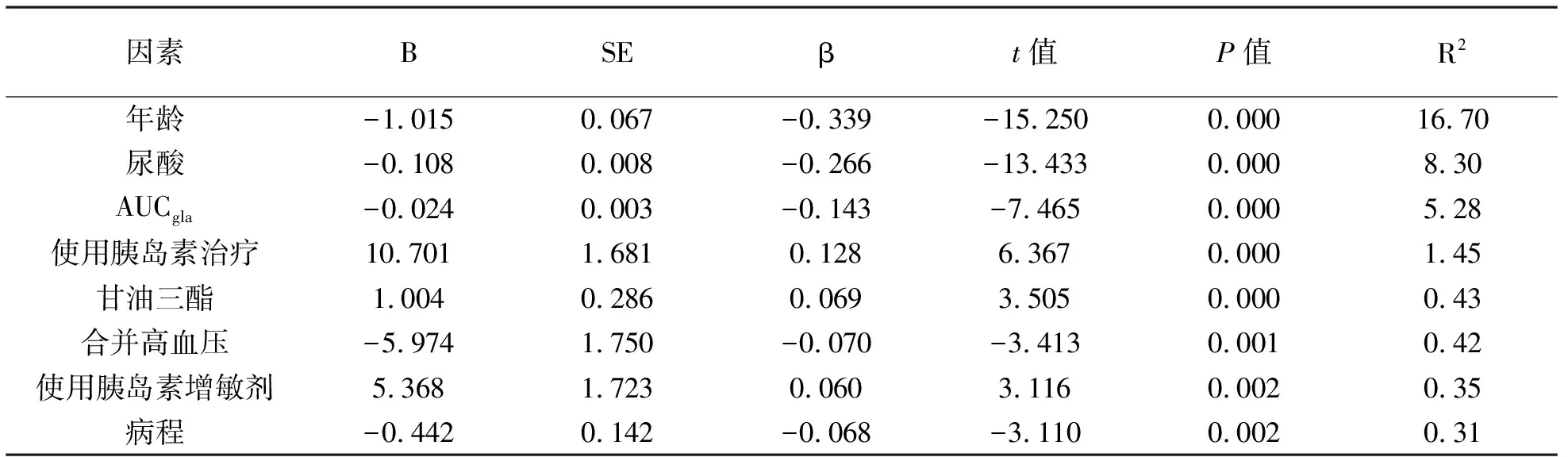
因素BSEβt值P值R2年龄-1.015 0.067 -0.339 -15.250 0.00016.70尿酸-0.108 0.008 -0.266 -13.433 0.0008.30AUCgla-0.024 0.003 -0.143 -7.465 0.0005.28使用胰岛素治疗10.701 1.681 0.128 6.367 0.0001.45甘油三酯1.004 0.286 0.069 3.505 0.0000.43合并高血压-5.974 1.750 -0.070 -3.413 0.0010.42使用胰岛素增敏剂5.368 1.723 0.060 3.116 0.0020.35病程-0.442 0.142 -0.068 -3.110 0.0020.31

表3 Logistic回归分析四组白蛋白尿的发生风险(95%CI)
模型1:未校正任何因素;模型2:校正了年龄、性别、病程、BMI、收缩压、舒张压、饮酒、口服他汀类药物、高血压、糖化血红蛋白A1c、尿酸、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、AUC血糖,AUC胰岛素、糖尿病治疗包括生活方式干预、药物治疗(胰岛素、胰岛素增敏剂、二甲双胍、胰岛素促泌剂)
讨 论
糖尿病是一种严重危害人类健康的慢性代谢性疾病,随着社会的发展,生活水平的提高,糖尿病的发生率也逐渐提高,其中有大约20%~40%的患者最终进展为糖尿病肾病[5]。
正常人胰岛α细胞约占胰岛细胞的20 %左右,位于胰岛的外周, 主要功能是分泌胰高血糖素,当人体血糖下降时,胰岛α细胞分泌活跃,胰高血糖素的水平升高,促进肝糖原分解及糖异生,增加肝糖输出,与胰岛素相互拮抗,从而升高机体的血糖水平。胰高血糖素是一种由29个氨基酸组成的直链多肽类激素,其与胰岛素同是决定血糖浓度的重要因素[6]。正常人GLA在餐后30分钟稍稍有所升高,而后各时间点便逐渐下降,180分钟稍低于空腹水平[7]。研究显示,正常人群空腹GLA水平同糖尿病患者差异无统计学意义,在糖负荷后正常人群GLA水平显著低于糖尿病患者,差异有统计学意义[8]。
在本文统计结果中发现,随着GLA水平的升高,AUCgla曲线下面积增多,eGFR水平是逐渐下降的,UACR及白蛋白尿的发生是逐渐升高的。也就是说在肾功能逐渐衰退的过程中,胰高血糖素的水平是逐渐升高的。在我们的临床工作中,肾功能异常包括了肾小球的高滤过状态及肾小球的滤过率进行性下降的状态,常以eGFR的数值来直观的反映患者的肾功能状态。在既往的研究中显示随着 eGFR水平的下降,GLA水平变化曲线呈J字形,肾小球高滤过组、肾功能下降组的GLA水平均高于肾功能正常组。肾小球高滤过组、肾功能下降组的AUCgla均高于肾功能正常组,这与本文的观察结果是一致的。原因分析如下:当患者的肾小球处于高滤过状态时,使得胰岛素的清除增加,体内胰岛素水平下降对胰高血糖素的抑制作用便减弱,故肾小球高滤过状态下患者的GLA水平,AUCgla高于肾功能正常的患者。对于肾小球滤过率下降的患者:①GLA在人体内的清除速度较快,半衰期大约是5min,通过肝脏可以清除约20%,通过肾脏清除大约占30%[9]。当eGFR下降后肾脏对GLA清除能力下降,患者GLA水平、AUCgla便明显升高。②胰岛素对GLA抑制作用的减弱,也是造成GLA升高的原因之一。可能的机制:随着eGFR的下降,胰岛素抵抗逐渐加重,胰岛素敏感性下降[10]。已经有研究表明,可能在糖耐量异常时,胰岛素敏感性下降就已经参与了肾功能不全的发展[11]。研究发现,在2型糖尿病的前期,空腹血糖能大致维持正常的人群中,高胰岛素血症与高胰高血糖素血症并存,胰岛素并不能有效抑制胰高血糖素分泌[12],并且当糖尿病患者进食后,胰高血糖素水平没有降低,反而有所升高。这些临床观察结果暗示了α细胞有导致胰岛素抵抗存在的可能性[13],这也导致了GLA不能被胰岛素所抑制。当患者肾功能不全状态时其全身实处于高凝状态的,微循环条件较差,β细胞位于胰岛中央,而其他胰腺内分泌细胞位于胰岛外周,当胰岛微循环出现障碍时,胰岛β细胞分泌功能受损较严重,而对位于胰腺周边的α细胞影响不大。一方面胰高血糖素分泌无明显受限,另一方面胰岛素分泌减少,共同造成了胰高血糖素水平明显升高,这就导致调节GLA水平的血糖值进一步升高,在肾功能受损的状态下,血糖对GLA的遏制作用逐渐减小,不仅造成了血糖的进一步升高,而且促进了糖尿病肾脏病的进展。
DKD是一个逐渐发展的过程,临床早期主要是肾小球高滤过状态和尿白蛋白排泄率增加,病理改变表现为肾小球基底膜增厚、肾小球肥大、系膜基质增多,以及细胞外基质蛋白增多等,随着DKD的进展,尿蛋白排泄进一步增多,损伤肾小球数量增多,与本文中所观察到的随着AUCgla曲线下面积的增多,血糖逐渐升高,尿白蛋白/肌酐(UACR)、白蛋白尿发生率呈升高趋势是一致的。目前,虽然关于DKD的发病机制尚未明确,但以高血糖介导的代谢失常和血流动力学途径被普遍接受,高血糖通过非酶途径产生的晚期ACE的积聚、蛋白激酶C激活、多元醇通路和氧化应激的加速、血管活性物质及细胞因子的激活、激肽释放酶-激肽系统作用等因素引起的组织损伤,各因素间相互作用、相互影响,参与DKD发生发展[14]。
本文中将总体的eGFR计算结果与年龄、尿酸、AUC胰高血糖素、使用胰岛素治疗、甘油三酯、合并高血压、使用胰岛素增敏剂治疗这些进行因素进行线性回归分析,各项指标均与eGFR具有相关性(P<0.05)。可决系数依次下降,分别为16.7、8.3、5.28、1.45、0.43、0.42、0.35、0.31。定义UACR≥30mg/g为白蛋白尿的话,以Q1组为参照,在未校正因素的情况下结果显示Q4组的白蛋白尿发生风险较Q1组增加了2.54倍。在校正了年龄、性别、病程、BMI、收缩压、舒张压、饮酒、口服他汀类药物、高血压、糖化血红蛋白A1c、尿酸、甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、AUC血糖,AUC胰岛素、糖尿病治疗包括生活方式干预、药物治疗(胰岛素、胰岛素增敏剂、二甲双胍、胰岛素促泌剂)后,结果显示Q4组的白蛋白尿发生风险较Q1组增加了2.34倍。
在本研究中发现,GLA水平的升高与eGFR水平的变化以及UACR均具有相关性,它们可能在DKD的发生、发展过程中产生相关影响。本研究后续将对研究对象进行随访,观察AUCgla水平的升高与eGFR水平的下降及白蛋白尿发生是否存在因果关系。

