化学氧化剂对水华蓝藻的控制研究
陈 超,范 帆,史小丽,阳 振,陈开宁,黎云祥
化学氧化剂对水华蓝藻的控制研究
陈 超1,2,3,范 帆1,3,史小丽1*,阳 振1,陈开宁1,黎云祥2
(1.中国科学院南京地理与湖泊研究所,湖泊与环境国家重点实验室,江苏 南京 210008;2.西华师范大学环境科学与工程学院,四川 南充 637009;3.中国科学院大学,北京 100049)
对比了过氧化氢(H2O2)、高铁酸钾(K2FeO4)和过碳酸钠(Na2CO4)3种氧化剂对自然水体中群体蓝藻生长和光合活性的影响.结果发现,3种氧化剂对蓝藻均有快速的抑制效应,且随着氧化剂浓度的增加抑制效果增强.相同氧化剂浓度下,H2O2对水华蓝藻的去除能力强于K2FeO4和Na2CO4,对蓝藻光合系统II的最大光量子产量(F/F)和有效光量子产量(F’/F’)的抑制效果也更显著.H2O2对不同浓度水华蓝藻的控制实验结果表明,初始藻细胞浓度对H2O2控藻效果影响较大,细胞密度越大,H2O2降解率增加,抑藻效果急剧下降.当初始藻密度为10μg/L和100μg/L,5mg/L H2O2的48h降解率分别为64.9 %和97.5 %,对藻细胞F/F的抑制率分别为10%和1%.因此,实施H2O2控制蓝藻水华的措施应该尽量在蓝藻水华形成早期,即藻密度较低的时候使用.
蓝藻水华;氧化剂;过氧化氢;光合活性
水体富营养化是目前我国湖泊、水库及河流面临的主要环境问题之一.蓝藻水华常伴随水体富营养化发生,对水生态环境带来了严重的负面影响,并阻碍了社会经济的发展[1],2007年太湖蓝藻水华甚至导致了“无锡饮用水危机事件”[2].削减水体营养盐是治理蓝藻水华的重要手段,但营养盐的内循环使其难以达到预期目标,蓝藻水华依然肆虐[3-5].在局部敏感水域,需要采取应急措施对蓝藻水华进行有效控制.添加杀藻剂直接去除水中的蓝藻细胞以防止形成水华,是常见的一种控藻方式[6].
化学氧化剂过氧化氢(H2O2)、高铁酸盐(K2FeO4)以及过碳酸钠(Na2CO4)能高效去除水中的蓝藻,并且不会引入或产生有毒有害物质,被认为是环境友好型控藻剂,具有一定的应用前景[7-11].但是,浮游藻类的种类、形态及初始密度直接影响氧化剂的控藻效果.H2O2抑制蓝藻生长的最低有效浓度仅为抑制真核藻类生长的十分之一,且群体蓝藻对氧化剂的抵抗能力强于单细胞蓝藻[12-13];随着初始藻细胞浓度的增加,氧化剂灭活藻细胞的能力显著下降[14-15].这可能是不同控藻研究中最低有效氧化剂浓度存在差异的主要原因.在蓝藻密度较低的复苏阶段,仅需10mg/L H2O2能去除水柱中53.2 %的藻细胞,远低于高藻密度下所需的最低氧化剂浓度60mg/L[16-18].
自然水体中,蓝藻水华的发展是一个藻密度和生物量逐渐增加的渐进过程,整个过程可以用模型预测[19].目前已有研究指出在水华形成前施用控藻剂在有效除藻的同时,降低了实施成本[18].但蓝藻密度对H2O2控藻效果的影响,还缺乏相应的研究.明确不同藻密度背景下,H2O2抑制以微囊藻为主的群体蓝藻生长的最低有效浓度,对于选择合适的控藻时机具有重要的意义.本研究首先对比了H2O2、K2FeO4及Na2CO43种氧化剂对自然水体中以微囊藻为主的蓝藻群体的去除效果,筛选出相对高效的控藻剂,然后探索藻密度对H2O2降解率及控藻效果的影响,以期为优化H2O2控藻方案提供理论依据.
1 材料与方法
1.1 实验材料
过氧化氢(30%)、过碳酸钠、二甲基亚砜(DMSO)、对硝基苯硼酸、碳酸、碳酸氢钠均为分析纯,购置于国药集团化学试剂有限公司.高铁酸钾(纯度大于95%)为暗紫色光泽粉末,购置于湖北银河化工有限公司.
群体蓝藻用25#浮游生物网采集于2016年7月太湖梅梁湾湾口处,避光置于聚乙烯材料开口瓶中并原位采集湖水,于24h内带回实验室.经显微镜镜检后,微囊藻为群体蓝藻的主要优势种属.
1.2 实验方法
1.2.1 H2O2、K2FeO4和Na2CO4抑藻效果比较,将群体蓝藻按照25μg/L初始叶绿素浓度添加至500mL锥形瓶,培养于光照培养箱.培养液为:GF/C (Whatman)滤膜过滤后的湖水;培养条件为:光强20μmol photons/(m2×s),温度25℃,光暗比12h:12h.分别添加0, 5, 20, 50mg/L H2O2, K2FeO4, Na2CO4至锥形瓶中,每个氧化剂浓度设置3个平行,于添加氧化剂后12, 24, 48, 72h取样测定水中叶绿素浓度和蓝藻光合活性,每个取样时间独立取3份样品进行分析,为避免取样体积和取样效应影响,取样时先加入固定浓度的抗坏血酸或硫代硫酸钠终止氧化反应[20].
1.2.2 蓝藻密度对H2O2控藻效果影响,将群体蓝藻按照10, 20, 50, 100μg/L初始叶绿素浓度添加至500mL锥形瓶中,分别添加0, 5, 20, 50mg/L H2O2至锥形瓶中,每个浓度设置3个平行,于2, 8, 24, 48, 72h取样分析水中叶绿素浓度和蓝藻光合活性.培养条件与取样方式同实验1.2.1.
1.3 分析方法
1.3.1 样品分析,叶绿素(Chlorophyll, Chl-):过滤20mL水样(Whatman,GF/C),滤膜用90%的丙酮溶液磨成匀浆,转入10mL离心管中于4℃黑暗条件下静置8~10h,混匀后离心10min,收集上清液,用荧光分光光度计(RF-5301PC, Sahimadzu Corporation, Japan)进行测定.
光合活性:取5mL水样于离心管中,经15min暗适应后用Phyto-PAM(Walz, Germany)测定.首先打开测量光,仪器检测到最小荧光0,随后打开饱和脉冲,得到最大荧光F,(F-0)即为可变荧光F,F与F的比值(F/F)即为光系统PS II的最大光量子产量,该值反映了浮游植物的潜在最大光合效率;水样不经过暗适应,用Phyto-PAM测定其最小荧光0’和最大荧光F’,求得浮游植物实际光量子产量F’/F’[21].
H2O2浓度的测定:用DMSO将对硝基苯硼酸配置成100mM的母液,用碳酸/碳酸氢钠缓冲液(pH=9, 150mM)将母液稀释成2mM的使用液待用,避光保存.将H2O2标准溶液设置为0, 0.4, 2, 4, 10, 20mg/L的浓度梯度,分别加入使用液反应20min,在紫外分光光度计406nm处比色,获得标准曲线.取2mL样品过滤至已含有等体积的使用液的比色管中,反应20min,按照上述条件比色,根据标准曲线求得样品中H2O2的浓度[15,22].
1.3.2 数据分析,所有数据经Excel 2007处理后,用Origin 8.5进行作图,利用SPSS 20进行组间差异分析(ANOVA),<0.05表示显著性差异.H2O2降解率按照以下公式计算:
降解率(%)=(1-N/0)×100
式中:N和0分别表示时刻和0时刻H2O2的浓度.
2 结果
2.1 氧化剂控藻效果比较
2.1.1 水柱中叶绿素浓度 低浓度(5mg/L)氧化剂对群体蓝藻叶绿素的去除率并不高,甚至观察到K2FeO4处理组叶绿素浓度在24~72h内高于对照组的现象,这可能是因为K2FeO4在低pH条件下会快速分解,实际作用浓度远低于5mg/L,而群体蓝藻胞外有机物具有清除氧化剂的作用,保护藻细胞不受伤害.当氧化剂浓度大于20mg/L时,水柱中叶绿素浓度随着与氧化剂接触时间的增加而明显下降,且H2O2对水柱中蓝藻的控制效果优于K2FeO4和Na2CO4.但是,值得注意的是,20mg/L和50mg/L H2O2对叶绿素的去除率相近,数值范围分别为32.5%~ 84.5%和33.9%~81.9%(图1).

图1 不同浓度氧化剂对水柱中Chl-a的影响
2.1.2 蓝藻的最大光量子产量(F/F)和实际光量子产量(F’/F’) 对照水柱中群体蓝藻的F/F和F’/F’值在实验过程中呈逐渐增加的趋势,而氧化剂的添加抑制了蓝藻的光合活性,甚至在50mg/L H2O2处理组观察到F/F和F’/F’值趋于0的现象,且在72h内无恢复趋势.但是,K2FeO4和Na2CO4仅暂时的抑制了蓝藻的光合活性,其F/F和F’/F’的值在24~72h内呈现逐渐恢复的趋势(图2).
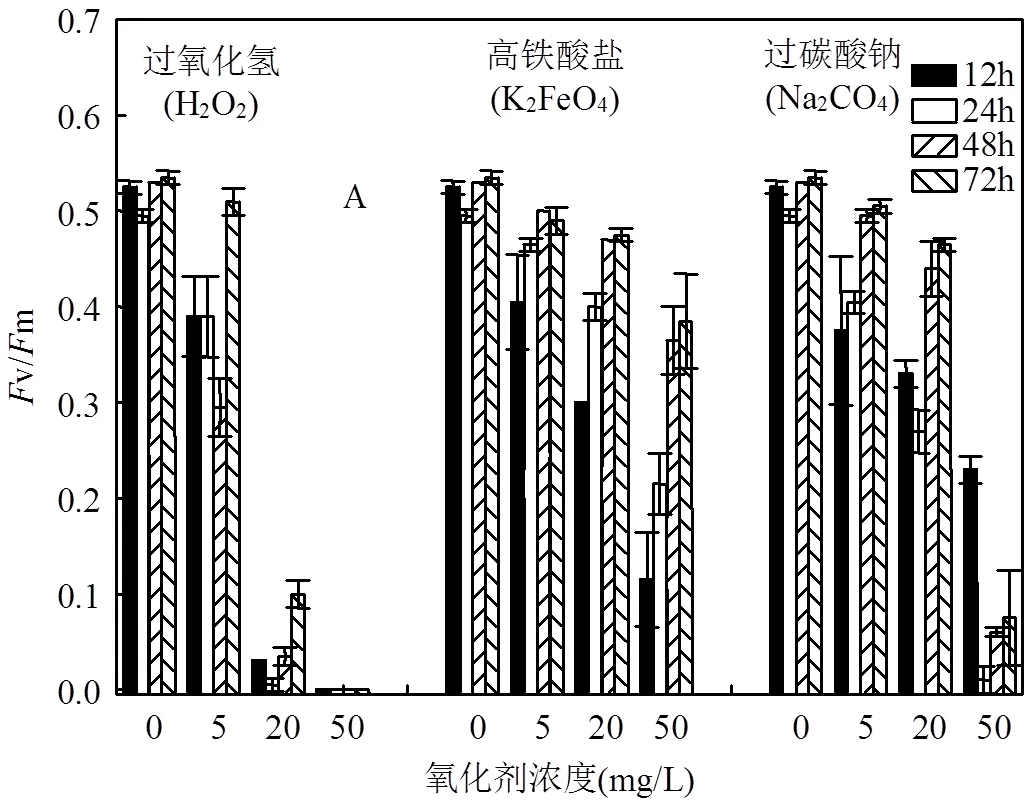
2.2 蓝藻密度对过H2O2控藻效果的影响
2.2.1 初始藻细胞密度对H2O2除藻效果及抑制蓝藻光合活性能力的影响 随着蓝藻密度的增加,H2O2对水柱中群体蓝藻的去除效果逐渐减弱.当蓝藻密度小于20μg/L时,5mg/L H2O2能有效去除水柱中叶绿素浓度,48h时的最大去除率为64.8 %,而当蓝藻密度大于50μg/L,则需H2O2浓度达到20mg/L以上时才能有效降低水柱中叶绿素浓度(图3A).
对照组水柱中群体蓝藻的光合活性在培养时间内呈逐渐增加的趋势,而H2O2的添加抑制了蓝藻的光合活性.但是,这种抑制能力随着蓝藻密度的增加而逐渐降低.如5mg/L H2O2对初始蓝藻密度为10μg/L和100μg/L处理组的最大光量子产量的48h抑制率分别为10%和1%(图3B).


2.2.2 20mg/L H2O2对不同藻细胞密度叶绿素及光合活性的影响,随着与H2O2接触时间的增加,初始蓝藻密度为10~50μg/L处理组水柱中叶绿素浓度逐渐下降,至72h时达到最低值;而当蓝藻密度达到100μg/L,20mg/L H2O2在前24h能够显著去除水柱中的叶绿素,24~72h内则无明显变化(图4A).
值得注意的是,蓝藻密度对H2O2控藻的时效性存在一定的影响,随着培养时间的增加,20mg/L H2O2处理组水柱中蓝藻的F/F值呈现逐渐恢复的趋势,且初始蓝藻密度越高,该趋势越明显(图4B).
2.2.3 H2O2的降解 随着蓝藻密度的增大,H2O2的降解率逐渐增加.5mg/L H2O2在蓝藻密度为10μg/L和100μg/L处理组水柱中的48h降解率分别为64.9%和97.5%(图5A).值得注意的是,值得注意的是,20mg/L H2O2在48h后基本能够完全降解,所有处理组中均未检测出其浓度(图5B).

3 讨论
3.1 氧化剂控藻效果对比
叶绿素是水体浮游植物的主要光合色素,常见的有叶绿素、和.叶绿素存在于所有的浮游植物中,是估算浮游植物生物量的重要指标[23-24].本文也以叶绿素的浓度来代表水柱中蓝藻的生物量.添加5~50mg/L氧化剂72h后,水柱中叶绿素的浓度均显著低于对照组(<0.05),而12h相同氧化剂不同浓度处理组水柱中叶绿素的浓度却并未表现出明显的差异性(>0.05),说明H2O2、K2FeO4以及Na2CO4对水柱中的群体蓝藻均有一定的去除能力,且去除效果与接触时间相关.一些研究也发现氧化剂对叶绿素的去除效果随着培养时间的延长而逐渐增加[25-26].
对比相同浓度的不同氧化剂对水柱中蓝藻的去除效果发现,20mg/L H2O2处理72h后,水柱中叶绿素的浓度显著低于相同条件下K2FeO4和Na2CO4处理组(<0.05),说明3种氧化剂中H2O2对群体蓝藻的去除效果最好.这可能是由于不同氧化剂对蓝藻作用机理存在差异而导致.H2O2在水环境中能够产生具有强氧化性的羟基自由基(·OH),几乎能够氧化所有有机物质,与蓝藻细胞接触后会损害细胞内脂质大分子、蛋白分子以及使蓝藻特征色素藻蓝素脱落[15,27],抑制蓝藻的生长和活性.此外,H2O2分子具有极强的膜穿透性,能够快速渗入藻细胞内,抑制光合作用相关基因的转录表达和光合作用过程中电子的传递[28-29],使细胞内活性氧自由基(ROS)积累,超过细胞抗氧化系统的解毒能力,导致蓝藻死亡.这也可能是20~50mg/L H2O2处理组群体蓝藻F/F和F’/F’显著低于(<0.05)其余2种氧化剂的原因之一(图2).
K2FeO4主要是通过改变蓝藻细胞的表面结构,使藻细胞表面鞘套卷绕或裂开,导致细胞内物质外流和蓝藻死亡[8];氧化性的铁盐被还原后会形成氢氧化铁胶体,可以吸附在藻细胞的表面,增加其沉淀性,进而使蓝藻细胞迁移至水底[30].此外,群体蓝藻胞外多糖对氧化剂存在清除作用,消耗水中的氧化剂,有效缓解细胞氧化压力,保护其不受伤害[13];而高铁酸盐水溶液稳定性较差、会快速分解,尤其是在低浓度的条件下,所以水中的浓度可能低于5mg/L,导致其对群体蓝藻的去除效果不理想,这也可能是5mg/L处理组叶绿素浓度甚至高于对照,且不同浓度K2FeO4处理后蓝藻的光合活性逐渐恢复的原因之一(图2).Na2CO4产生·OH的能力是H2O2分子30 %左右,因而相同剂量的Na2CO4对蓝藻细胞的去除效果弱于H2O2.Quimby等也发现了相似的结果[10].
3.2 初始藻密度与H2O2控藻的关系
添加H2O2虽然能够高效、选择性的抑制水中蓝藻的生长且不会引入新的污染物,具有一定的应用前景[12,16].但是,H2O2对浮游植物细胞的去除能力与其在水柱中的存在时间有一定的关系[31],而随着初始藻密度的增加,H2O2在水柱中存在的时间逐渐减少,降解率逐渐增加(图5),削弱其对水中蓝藻的去除能力.这可能有以下2个原因,一是因为水柱中的H2O2最先作用于蓝藻的细胞壁,而群体蓝藻的胞外多糖(EPS)对H2O2具有较强的去除作用[13],蓝藻密度越大,水柱中EPS的含量越高[32],因而H2O2降解较快;二是与H2O2接触后,死亡的蓝藻可能会释放一些胞内物质如MCs等,加速H2O2的消耗[33].相似的研究也曾有报道,Copper等发现H2O2(0.17mg/L)在自然水体中的存在周期为1~8h[34],而在不含藻细胞的培养基中能够稳定存在8d[35].
此外,水柱中浮游植物的种类及其细胞形态常常影响化学氧化剂对其的去除效果.Plummer等就发现3mg/L的O3能有效的去除水柱中初始密度为10×104cells/L的小环藻,且不会明显引起其细胞膜的破裂;但是,0.3mg/L的O3就会导致相同藻密度蓝藻的死亡和细胞破裂[36].这可能是因为大型真核浮游藻类如硅藻和绿藻,它们细胞内部具有蓝藻细胞不具有的抗坏血酸过氧化物酶(APX),这种酶位于叶绿体内,它能够通过抗坏血酸-谷胱甘肽循环将H2O2转化为H2O和O2[37-38],降低对藻细胞的氧化伤害.Drábková等也认为与硅藻和绿藻相比,H2O2对蓝藻的选择性抑制性应归因于不同种类藻细胞对氧化伤害的响应差异[12].虽然本次实验所用的蓝藻群体以微囊藻为主,但是也存在其他种类的藻如小球藻等,其生物量可能随着藻密度的增加而增大,减弱H2O2对初始藻密度较高的群体藻细胞的去除能力.
藻细胞的光合活性常用作对外界不利环境的耐受能力指标,最大光量子产量(F/F)越高则意味对H2O2越不敏感,适应能力越强[21].本研究也发现5mg/L H2O248h后能够显著(<0.05)去除水柱中初始Chl-浓度为10μg/L的蓝藻细胞,抑制其光合活性,而随着初始Chl-浓度的增加,需要H2O2浓度增加至20mg/L时才能显著减少水柱中叶绿素的浓度(<0.05),抑制蓝藻的光合活性(图4).该结果表明,在蓝藻密度较低的时候,低浓度H2O2就足够去除其生物量,达到控藻的目的.但是,随着蓝藻密度的增大,H2O2对蓝藻生长的抑制能力逐渐减弱,需要增加H2O2的用量达到控藻的目的.但用高浓度H2O2控藻可能更容造成蓝藻胞内有机物如藻毒素等物质的释放[25],存在较大的潜在生态风险;值得注意的是,H2O2在水中的存在时间与其初始浓度成明显的正相关关系,对蓝藻生长的抑制效果存在一定的时效性.因此,建议在蓝藻密度较低的时候(低于10μg/L)采用低浓度H2O2(低于5mg/L)控制其生长,同时在使用时采取低浓度多次添加的方式,以在一定程度上延缓H2O2对蓝藻生长的抑制效果.
4 结论
4.1 相同浓度条件下,H2O2对群体蓝藻的去除和对蓝藻光合活性的抑制效果好于K2FeO4和 Na2CO4.
4.2 初始藻细胞密度对H2O2除藻效果影响较大,5mg/L H2O2后能够有效降低初始蓝藻密度为10μg/L处理组水柱中叶绿素浓度,抑制蓝藻的光合活性,而当蓝藻密度增加至50μg/L时,需要20mg/L H2O2才能有效减少水柱中叶绿素的浓度.
[1] 王 林,吴纯德,倪木子,等.硅藻土强化混凝去除铜绿微囊藻的影响因素研究 [J]. 中国环境科学, 2014,34(1):156-160.
[2] Yang M, Yu J W, Li Z L, et al. Taihu Lake not to blame for Wuxi's Woes[J]. Science, 2008,319:157-159.
[3] 范成新,张 路,杨龙元,等.湖泊沉积物氮磷內源负荷模拟[J]. 海洋与湖沼, 2002,33(4):370-378.
[4] 秦伯强,范成新.大型浅水湖泊内源营养盐释放的概念性模式探讨[J]. 中国环境科学, 2002,22(2):150-153.
[5] 王国祥,成小英,濮培民.湖泊藻型富营养化控制—技术、理论及应用[J]. 湖泊科学, 2002,14(3):273-282.
[6] Daniel J, Blahoslav M. Critical review of actually available chemical compounds for prevention and management of cyanobacterial blooms[J]. Chemosphere, 2011,85(34):1415-1422.
[7] Drábková M, Matthijs H C P, AdmiraaL W, et al. Selective effects of H2O2on cyanobacterial photosynthesis[J]. Photosynthetica, 2007,45(8):363-369.
[8] 刘 伟,马 军.高铁酸盐预氧化对藻类细胞的破坏作用及其助凝机理[J]. 环境科学学报, 2002,22(1):24-28.
[9] 苑宝玲,曲久辉.高铁酸盐氧化絮凝去除藻类的机制[J]. 中国环境科学, 2002,22(5):397-399.
[10] Quimby P C, Kay S H, Ouzts J D. Sodium carbonate peroxyhydrate as a potential algicide[J]. Journal of Aquatic Plant Management, 1988,26(8):67-68.
[11] Jiang J Q, Lloyd B. Progress in the development and use of ferrate(VI) salt as an oxidant and coagulant for water and wastewater treatment[J]. Water Research, 2002,36(6):1397-1408.
[12] Drábková M, Admiraal W, Marsalek B. Combined exposure to hydrogen peroxide and light - selective effects on cyanobacteria, green algae and diatoms[J]. Environmental Science and Technology, 2007,41(7):309-314.
[13] Gao L, Pan X L, Zhang D Y, et al. Extracellular polymeric substances buffer against the biocidal effect of H2O2on the bloom-forming cyanobacterium[J]. Water Research, 2015,69(5):51-58.
[14] 汪小雄,姜成春,朱 佳,等.臭氧灭活水中铜绿微囊藻影响因素研究 [J]. 中国环境科学, 2012,32(4):653-658.
[15] Randhawa V, Thakkar M, Wei L P. Effect of algal growth phase onsusceptibility to hydrogen peroxide[J]. Aquatic Toxicology, 2013,142-143(5):230-238.
[16] Matthijs H C P, Petra M V, Bart R, et al. Selective suppression of harmful cyanobacteria in an entire lake with hydrogen peroxide[J]. Water Research, 2012,46(18):1460-1472.
[17] Wang Z C, Li D H, Qin H J, et al. An integrated method for removal of harmful cyanobacterial blooms in eutrophic lakes[J]. Environmental Pollution, 2012,160(5):34-41.
[18] Jia Y H, Yang Z, Su W, et al. Controlling of cyanobacteria bloom during bottleneck stages of algal cycling in shallow Lake Taihu (China). Journal of Freshwater Ecology[J]. 2014,29(1):129-140.
[19] 孔繁翔,高 光.大型浅水湖泊的蓝藻水华形成机理研究的思考[J]. 生态学报, 2005,25(3):589-595.
[20] Wert E C, Korak J A, Trenholm R A, et al. Effect of oxidant exposure on the release of intracellular microcystin, MIB, and geosmin from three cyanobacteria species[J]. Water Research, 2014,52(18):251-259.
[21] Zhang M, Kong F X, Wu X D, et al. Different photochemical responses of phytoplankters from the large shallow Taihu Lake of subtropical China in relation to light and mixing. Hydrobiologia[J]. 2008,603(1):267-278.
[22] Lu C P, Lin C T, Chang C M, et al. Nitrophenylboronic acids as highly chemoselective probes to detect hydrogen peroxide in foods and agricultural products[J]. Journal of Agriculture and Food Chemistry, 2011,59(18):11403-11406.
[23] Jespensen A M, Christoffesrsen K. Measurements of chlorophyll a from phytoplankton using ethanol as extraction solvent[J]. Archiv für Hydrobiologie, 1987,109(15):445-454.
[24] 陈宇炜,陈开宁,胡耀辉.浮游植物叶绿素测定的热乙醇法及其测定误差的探讨[J]. 湖泊科学, 2006,18(5):550-552.
[25] Qian H F, Yu S Q, Sun Z Q, et al. Effects of copper sulfate, hydrogen peroxide and N-phenyl-2-naphthylamine on oxidative stress and the expression of genes involved photosynthesis and microcystin disposition in Microcystis aeruginosa[J]. Aquatic Toxicology, 2010,99(12):405-412.
[26] Zhou S Q, Shao Y S, Gao N Y, et al. Effects of different algaecides on the photosynthetic capacity, cell integrity and microcystin-LR release of Microcystis aeruginosa[J]. Science of the Total Environment, 2013,463-464(8):111-119.
[27] 任 晶. UV/H2O2对铜绿微囊藻抑制特性及其对微囊藻毒素降解机理研究[D]. 上海:复旦大学, 2011.
[28] Dummermuth A L, Karsten U, Fisch K M, et al. Response s of marine macroalgae to hydrogen-peroxide stress[J]. Journal of Experimental Marine Biology and Ecology, 2003,289(1):103-121.
[29] Samuilov V D, Timofeev K N, Sinitysn S V, et al. H2O2induced inhibition of photosynthetic O2evolution byCells[J]. Biochemistry (Moscow), 2004,69(8):1139-1148.
[30] Ma J, Liu W. Effectiveness and mechanism of potassium ferrate(VI) preoxidation for algae removal by coagulation. Water Research[J]. 2002,36(16):871-878.
[31] Mikula P, Zezulka S, Jancula D, et al. Metabolic activity and membrane integrity changes in—New finding on hydrogen peroxide toxicity in cyanobacteria[J]. European Journal of Phycology, 2012,47(3):159-206.
[32] 肖 艳.群体微囊藻响应光照和毒素的方式及其机理探析[D]. 武汉:中国科学院水生生物研究所, 2011.
[33] 丁 奕.微囊藻对几种胁迫因子的响应及其机理研究[D]. 武汉:中国科学院水生生物研究所, 2013.
[34] Cooper W J, Lean D R S, Carey J H. Spatial and temporal patterns of hydrogen peroxide in lake waters[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1989,46(7):1227-1231.
[35] Fan J J, Lionel H, Justin B. Evaluating the effectiveness of copper sulphate, chlorine, potassium permanganate, hydrogen peroxide and ozone on cyanobacterial cell integrity[J]. Water Research, 2013,47(8):5153-5164.
[36] Plummer J D, Edzwald J K. Effects of chlorine and ozone on algal cell properties and removal of algae by coagulation[J]. Journal of Water Supply Research and Technology, 2002,51(6):307-318.
[37] 卜令君,周石庆,施 周,等.藻源性内毒素在铜绿微囊藻灭活过程中的释放 [J]. 中国环境科学, 2017,37(12):4675-4680.
[38] Huo X C, Chang D W, Tseng J H, et al. Exposure ofto hydrogen peroxide under light: kinetic modeling of cell rupture and simultaneous microcystin degradation[J]. Environmental Science and Technology, 2015,49(18):5502-5510.
Research on the Control of Chemical Oxidants over Water-Blooming Cyanobacteria.
CHEN Chao1,2,3, FAN Fan1,3, SHI Xiao-li1*, YANG Zhen1, CHEN Kai-ning1, LI Yun-xiang2
(1.State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;2.College of Environmental Science and Engineering, China West Normal University, Nanchong 637009, China;3.University of Chinese Academy of Sciences, Beijing 100049, China)., 2018,38(11):4307~4313
Algaecide treatment is a management strategy to control cyanobacterial blooms. This study assessed three oxidizers such as hydrogen peroxide (H2O2), potassium ferrate (K2FeO4) and sodium percarbonate (Na2CO4), on mitigating cell numbers and inhibiting the photosynthetic activity of cyanobacteria colonies collected from natural lake. Addition of those three algaecides could disrupt cyanobacteria cells and inhibit the maximum (Fv/Fm) and actual (Fv’/Fm’) quantum yield of cyanobacteria, and the inhibitory effect was enhanced when the concentration of algaecides increased. Cyanobacteria cells tended to be more sensitive to H2O2, in comparison with other two algaecides. In addition, H2O2decomposed more rapidly, and mitigating efficiency as well as the inhibitory effect of photosynthetic activity declined when cyanobacteria biomass increased. When the initial cell density was 10and 100μg/L, the inhibition rate of 5mg/L H2O2on the maximum quantum yield of cyanobacteria was 10% and 1%, while the degradation rate was 64.9% and 97.5%, respectively. These results indicated that using H2O2for cyanobacterial bloom control should be exerted when cyanobacteria biomass is relatively low, since the low dosage could function well at the early stage of cyanobacterial bloom.
cyanobacterial bloom;oxidant;hydrogen peroxide;photosynthetic activity
X524
A
1000-6923(2018)11-4307-07
陈 超(1988-),男,四川绵阳人,讲师,博士,主要从事藻类水华防治技术研究.发表论文9篇.
2018-04-18
国家水体污染控制与治理科技重大专项项目(2017ZX07603- 005);国家自然科学基金资助项目(31670462);西华师范大学博士启动项目(412675).
* 责任作者, 副研究员, xlshi@niglas.ac.cn

