3D打印气体扩散电极产H2O2及其对焦化废水的处理研究
邱 珊,高伟杰,邓凤霞,朱英实,马 放,杨基先
3D打印气体扩散电极产H2O2及其对焦化废水的处理研究
邱 珊1,2*,高伟杰1,2,邓凤霞1,2,朱英实1,2,马 放1,2,杨基先1,2
(1.哈尔滨工业大学环境学院,黑龙江 哈尔滨 150090;2.哈尔滨工业大学,城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
利用3D打印技术设计出一种高效产H2O2的3D打印气体扩散电极(3D-GDE)并将其应用于电芬顿体系对实际焦化废水降解研究.结果表明3D-GDE阴极H2O2产量高达16.1mg H2O2/cm2,而相同条件下传统气体扩散电极仅为7.16mg H2O2/cm2.通过考察不同因素对阴极产H2O2影响可知:酸性条件更有利于产H2O2;电流从200mA提高到250mA,其H2O2产量从250mg/L提高到450mg/L,但是继续提高电流时(250 ~300mA),H2O2并没有明显增加.将3D-GDE电极应用于电芬顿对实际焦化废水处理,在最适宜条件下,可以实现对焦化废水有效矿化(4h电解后高达80%),其降解过程中三维荧光指纹分析也直接证明了该体系的高效性.Microtox毒性实验表明,3D-GDE电芬顿体系可以有效的降低焦化废水体系的毒性,其最低能耗为0.9kW·h/g TOC.
3D打印技术;气体扩散电极;电芬顿;苯酚;焦化废水;Microtox
在中国,煤炭消耗占中国能源消耗总量的70%以上,仅2013年的焦炭产量为476亿t,其不可避免地伴随着每年超过12亿t的焦化废水的排放[1].然而,焦化废水因含有多种复杂的污染物,比如酚类、多环芳烃、吡啶和吲哚等物质,其高毒性和高致癌性无论是对环境还是生物都构成极大威胁.其中酚类化合物是一种原型质毒物,对生物个体有毒害作用,它可通过皮肤及黏膜的接触而吸入或经口腔浸入生物体内,与细胞原浆中的蛋白质接触后形成不溶性蛋白质而使细胞失去活性,尤其对神经系统有较大的亲和力,使神经系统发生病变,另外高浓度的酚还可引发神经系统病变[2].传统生物法很难使焦化废水达到理想的处理程度.电芬顿法作为高级氧化机制之一,因原位产氧化性物质,作为一种绿色技术而引起学者关注.电芬顿技术的主要原理是氧气或者空气在合适的阴极表面原位还原产H2O2,避免了H2O2运输的危险.原位产生的H2O2与Fe2+引发经典的芬顿反应从而产生高活性的羟基自由基(E°(•OH/H2O)=2.80V/SHE)[3-6].电芬顿优于传统芬顿原因在于Fe3+能够在阴极还原(Eq. 3)从而减少铁源的投加以及铁泥的产量.
O
2
+ 2H
+
+ 2e
-
→ H
2
O
2
(1)
H
2
O
2
+ Fe
2+
→ Fe
3+
+
•
OH +
-
OH (2)
Fe
3+
+ e
-
→ Fe
2+
(3)
电芬顿体系中氧化效能主要依赖于阴极H2O2的产量.碳材料因其良好的电催化活性,能够将O2还原为H2O2,同时具备较高的析氢电位、低H2O2分解速率,能够进一步提高电化学体系H2O2产率的电流效率,因此碳材料,比如碳毡、石墨毡、碳纤维、碳纳米管等[9-12]作为典型的阴极材料在电芬顿体系中使用[6].在电芬顿阴极研究中,气体扩散电极(GDEs)高的H2O2产量引起了学者的广泛研究[5].在气体扩散电极中,氧气或者空气通过气体扩散电极的多孔孔道,从而使气体与碳材料界面的溶液相互接触,形成薄的液膜,更加有利于氧气的还原及H2O2的积累[13]
3D打印技术是指通过连续的物理层叠加,逐层增加材料来生成三维实体的技术,与传统的去除材料加工技术不同,因此又称为添加制造[14].目前,3D打印技术主要被应用于产品原型、模具制造以及艺术创作、珠宝制作等领域,替代这些领域传统依赖的精细加工工艺,3D打印可以在很大程度上提升制作的效率和精密程度[14].3D打印具有如下特点和优势[15]:数字制造、降维制造、堆积制造、快速制造等.然而,据作者所知,目前将3D技术应用于电极制备目前尚未报道.
本研究中采用3D技术和流体模拟软件对气体扩散电极中的气体扩散部分进行设计和优化,以便提高氧气传质效率以及电极比表面积的利用.将优化后的气体扩散电极,针对其产H2O2能力进行评估,考察pH值和电流对其产H2O2的影响.然后将该气体扩散电极应用于电芬顿体系对焦化废水进行降解与矿化,考察了其降解效能.同时,毒性试验用来评估该气体扩散电极/电芬顿体系对焦化废水毒性的去除效果.最后,针对气体扩散电极/电芬顿体系对焦化废水的降解能耗进行了核算.
1 材料与方法
1.1 试剂与方法
苯酚(>99%)、H2O2(30%/)、FeSO4•7H2O(> 99%)和硫酸(95%)、硫酸钠(99%)、邻苯二甲酸氢钾、碘化钾等药品均购置于国药集团化学试剂有限公司,均为分析纯(如无特殊说明所有化学品都是在没有进一步纯化情况下使用).Millipore Milli-Q系统提供的去离子水(DI)(18.2MΩ cm).防水碳布CC6(含50%PTFE)购置于美国的Fuel Cell Earth公司.
线性扫描伏安法(LSV)研究3D-GDE在不同pH条件下对氧气还原(ORR)的影响.其中LSV由电化学工作站(Autolab, 荷兰)控制其电位,采用三电极体系,以气体扩散电极(1cm×1cm)、Pt电极、Ag/AgCl(3mol/LKCl,=0.210V/SHE)分别作为工作电极、对电极和参比电极,其扫描速率为10mV/s,扫描的电位范围为-1.0~0V.在进行扫描伏安分析之前,电解质溶液提前进行30min预曝气(氮气或者氧气)处理.
毒性试验采用Microtox®毒性仪器(吉尔福德,英国),测定溶液对费氏弧菌的抑制率,从而判断焦化废水的毒性大小.其中费氏弧菌冻干粉、渗透压调节液体、复苏液、稀释液均购置于Microtox®公司.特定时间反应后的溶液通过与费氏弧菌接触15min后测定其荧光值,费氏弧菌荧光抑制率通过如下公式进行计算:
抑制率(%)=(1-
L
s/
L
c)×100% (4)
1.2 焦化废水特点

图1 焦化废水分析的GC-MS图谱
焦化废水来自黑龙江省某焦炭生产工艺废水.该焦化废水呈现深棕色(如图1所示)取回后储存于4℃冰箱备用,废水指标如表1所示.其中的有机物质的种类采用GC-MS (Agilent 6890NGC- 5975NMSD)进行鉴别,结果如图1所示,色谱条件如下:毛细管柱(0.25mm×30m,0.25μm,Agilent 19091S- 433),采用程序升温(起始温度45℃,保温5min,然后以15℃/min速率升温到160℃,保温2min,最后以20 ℃/min的速率升温至315℃保温2min).载气氦气(99.999%),流量1mL/L,分流比50:1.质谱条件:EI离子源70eV,离子源温度230℃,传输线温度250℃,扫描质量范围/40~650.如表2所示,焦化废水中主要有机物以芳环类为主,如苯酚、吡啶、3-氨基吡啶等.因苯酚含量最高(57.33%),选择苯酚作为其代表性有机物进行条件优化.
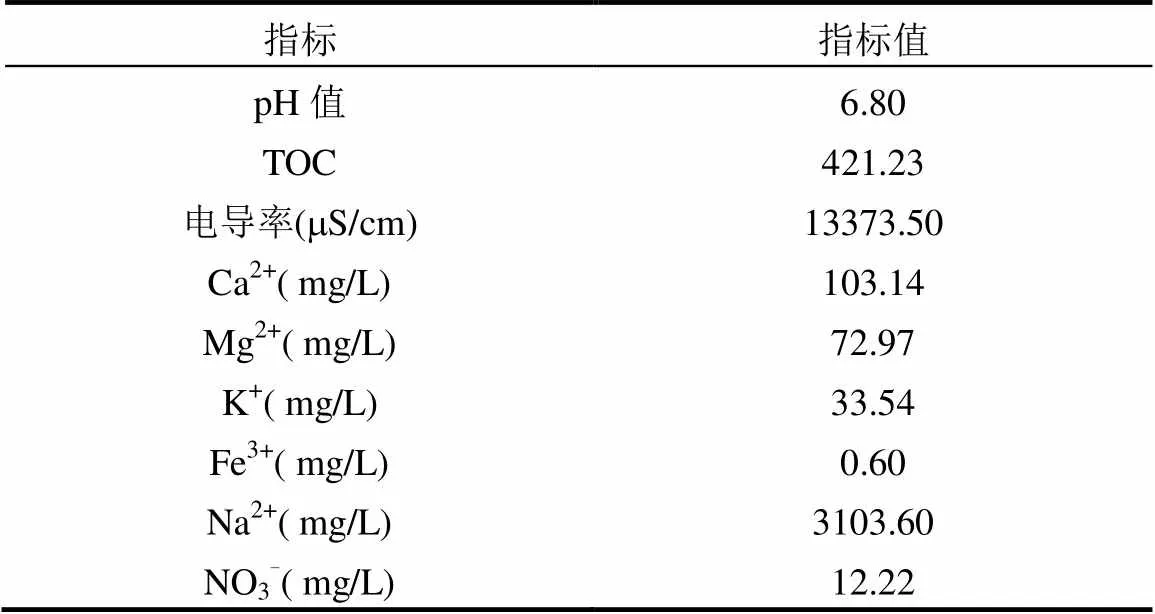
表1 焦化废水的性质

表2 GC-MS检测焦化废水中有机物及其含量

表3 H2O2积累及对比研究
1.3 3D-GDE电极的结构
本研究中3D打印的气体扩散电极(3D-GDE)最初设计思路来源于Brillas课题组[16]该气体扩散电极包括一个圆柱形外管,气体扩散器和一个直径为3cm的螺旋帽,结构如下图2所示.该设计的创新在于该气体扩散电极采用SolidWorks® 2016 3D 软件对其气体扩散器部分进行了优化,同时采用流体模拟对氧气的扩散进行改善,提高了电极表面的利用率.防水碳布(含60%的PTFE的碳布)夹在圆柱形反应器身和螺旋帽之间,其中不锈钢丝折成“O”型作为电流集流体.

图2 3D打印设计的气体扩散电极结构示意
1.4 3D-GDE电极产H2O2研究与优化
采用如图3所示的试验装置来考察气体扩散电极产H2O2的能力.图3所示的试验装置包括以下几部分:体积为250mL的圆柱形玻璃反应器、Pt电极(2cm × 2cm)、倾斜角为30° 3D-GDE.采用恒电流模式控制控制体系的电流(a HAMEG 7042-5,德国).电解过程中,以0.5L/min流量为体系提供足够的氧气.H2O2采用碘化钾分光光度法于波长351nm处进行测定[17].由于此分析方法适合微量过氧化氢测定,本论文过氧化氢浓度产量都超过100,所以测定前需要进行稀释.实验时取1mL工作液于25mL比色管中,分别加入1mL苯二甲酸氢钾溶液(0.1mol/L)和1mL碘化物(KI = 0.4mol/L,NaOH = 0.06mol/L,钼酸铵=5mol/L).用超纯水定容,摇匀后再从中取出1.5mL混合液于另一25mL干净比色管中,定容,摇匀,静置10min后于351nm波长下,用1cm比色皿测定其吸光度.

图3 实验装置
1.5 3D-GDE在电芬顿体系中对苯酚和焦化废水降解效能研究
采用上图所示的试验装置(图3),对3D-GDE电极在电芬顿体系中对污染物降解效能进行评估,因苯酚占焦化废水中有机物含量的57.33%,选择苯酚作为目标污染物进行参数优化,优化参数后对实际的焦化废水降解效果进一步考察.
苯酚及其中间产物采用高效液相色谱(HPLC) (Shimadzu SPD-M10A,日本)条件如下:利用UV检测器在280nm处进行检测,Zorbax C-18柱(150mm× 2.10mm, 5μm),流动相为1%(/)乙酸的超纯水和甲醇75:25(/),流量为0.25mL/min.Shimadzu VCSH TOC分析仪(日本)通过热催化氧化(680°C)测定的总有机碳(TOC)的变化.
电芬顿体系的能耗根据文献报道,按照式(5)进行核算:
EC
TOC
=
E
cell×
I
×
t
/(
D
TOC×
V
) (5)
式中:cell是体系的平均电压,V;是施加到体系的电流;电解时间,s;DTOC 是电解过程中总有机碳的变化,mg/L;是溶液的体积, L .
2 结果与讨论
2.1 3D-GDE阴极产H2O2影响因素探讨
2.1.1 3D-GDE阴极的LSV分析 线性扫描伏安法(LSV)作为表征电极电化学特性的有效手段之一,主要原理是对工作电极施加一个线性变化的电压,然后记录工作电极上的电流.本研究LSV评价不同pH值中气体扩散电极对氧气还原反应的能力.从图4可知,当溶液通过氮气去除氧气后,气体扩散电极的电流与电压响应值低,在LSV曲线上仅体现析氢反应(Eq. 6).当溶液经过氧气饱和处理后,电流与电压响应值增加,主要是因为氧气的存在促使阴极界面发生氧气的还原反应,其中包括氧气的4电子还原(Eq. 7)和2电子还原(Eq. 1)[18].气体扩散电极在氮气和氧气中的LSV曲线的间距表明其对氧气的还原能力大小,间隔越大表明其对氧气的还原能力越强.在O2饱和溶液中LSV电流响应随着pH值的升高而降低,因为pH越高质子含量越少,所以pH值越高质子的浓度成为限制氧气还原的关键因素之一.同时对比在氮气和氧气中的LSV曲线可知:在阴极电位约为-0.4V处,氧气的还原开始发生.
2H
+
+ 2e
-
→ H
2
(6)
O
2
+ 4H
+
+4e
-
→ 2H
2
O (7)
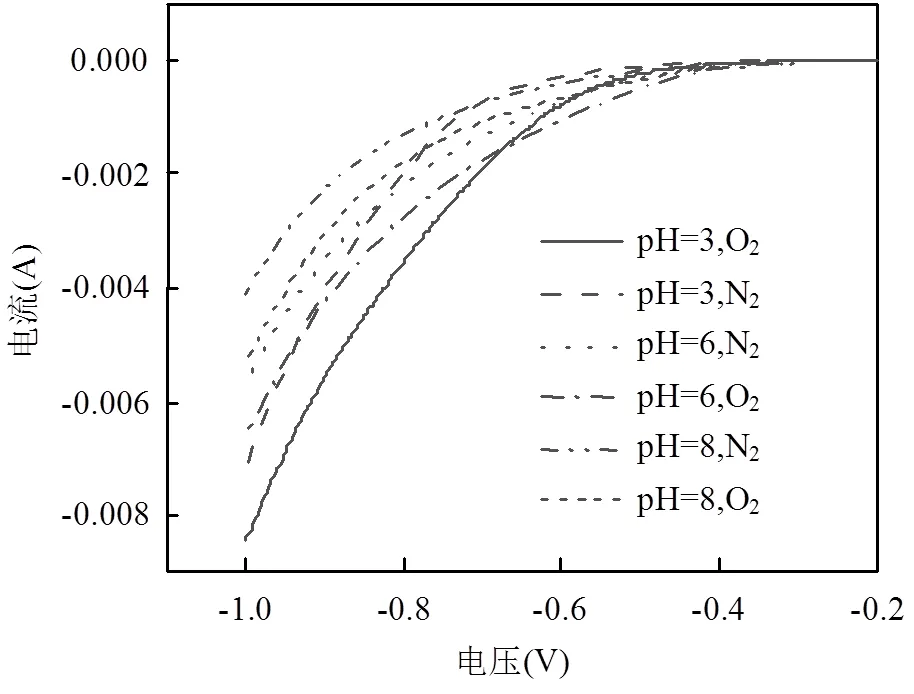
图4 不同pH值下的LSV曲线
2.1.2 pH值对3D-GDE电极产H2O2的影响 根据研究人员报道,pH是影响体系产H2O2的主要因素[19].根据式(1),在酸性电化学体系中H2O2可以通过氧气在阴极的二电子还原持续的产生,然而在强碱性条件[式(8)],氧容易还原成超氧化氢根[20].因此,排除碱性条件,本研究只考虑了pH值分别在3、5、7时体系产生H2O2的浓度随时间的变化情况.从图5可以看出,在施加电流为250mA, 曝气量为0.5L/min,H2O2在一定pH值下积累浓度随着时间的增大而增大,而且积累速率逐渐变小最后几乎为零.这表明反应120min后体系中H2O2的生成速率和消耗速率达到平衡.H2O2的消耗主要有在阳极中被氧化,如Eq. 9;阴极中进一步的电子转化为H2O,如Eq. 10;H2O2的自分解,如式(11)[21].
O
2
+H
2
O+2e
-
→HO
2
-
+OH
-
(8)
H
2
O
2
→O
2
+2H
+
+2e
-
(9)
H
2
O
2
+2H
+
+2e
-
→2H
2
O (10)
2H
2
O
2
→2H
2
O+O
2
(11)
此外,从图5中可以看出不同pH值条件下,气体扩散阴极产H2O2的能力均很优异,反应180min后产量都高于400mg/L;H2O2的产量差值不大,但依然是酸性条件更有利于产H2O2.这是因为,如Eq. 1所示,体系中溶解的氧得电子还原生成H2O2时,需要消耗溶液中的质子.最后,查阅文献得知,相同条件下,气体扩散电极对H2O2的产量远高于石墨、碳毡等常用电极,表明是优良的催化氧还原电极[22-23].

图5 pH值对气体扩散电极产H2O2影响
2.1.3 电流对3D-GDE电极产H2O2的影响 在电化学体系中电流不仅影响电极界面的电化学反应,而且决定着电化学体系的能耗和成本[24],所以考察电流对阴极H2O2的产生十分必要.本研究考察了不同电流下H2O2的产量,其结果如图6所示.从图6可以看出,随着施加的电流从200mA提高到250mA时,产生的H2O2量增加十分明显,从250mg/L 显著提高到400mg/L左右,与法拉第定律相符合.但是继续提高电流时(250 ~300mA),H2O2并没有明显增加.当电流提高时,伴随着阴极2电子还原产H2O2的同时,副反应H2O2在阴极的分解(Eq. 7)以及氢气的还原反应(Eq. 6)也会随之增加,与产H2O2的反应形成竞争,引起电流空耗,从而降低导致电流的效率,所以H2O2的增加并没有那么明显,与以前研究者报道相似[25].基于以上试验结果考虑,因此,本研究选择250mA为产H2O2的最佳电流值.
此外,为了进一步阐明3D打印技术设计的优越性,本研究在250mA电流下考察了传统模式(无本研究的设计机构)考察了C/PTEF产H2O2能力,通过图6可以发现传统模式要远低于新型模式电极下产H2O2能力, 3h产过氧化氢量仅仅为200mg/L.试验结果验证了,该3D打印技术设计的结构能够提高传统气体扩散电极产H2O2能力,可能是由于该结构进一步提高了氧气在界面利用率.
如表3所示,将本研究中的气体扩散电极产H2O2能力与前人的研究进行对比.虽然有研究报道其H2O2的产量高达1002、566mg/L,但H2O2的产量经过与其面积标准化后,本研究中的气体扩散电极产16.1mg H2O2/cm2远高于目前其他气体扩散电极产H2O2的报道,进一步说明了经过3D打印结束结合流体模拟优化后的气体扩散电极能够显著改善H2O2的产量.

图6 电流对气体扩散电极产H2O2
2.2 3D-GDE阴极电芬顿体系对焦化水主要污染物(苯酚)降解研究
通过GC-MS(图1)结果可知,焦化废水以芳香环类物质为主,其中苯酚含量占57.33%.鉴于此,本文选择苯酚作为目标污染物进行操作参数(Fe2+浓度)的优化及其降解途径分析.
2.2.1 不同Fe2+浓度对苯酚降解以及动力学分析 通过以上研究证实了3D-GDE阴极具有高效的产H2O2能力,然而其在电芬顿体系中对污染物的降解效果同样也是关注焦点.考虑到电芬顿体系对污染物降解Fe2+不仅影响•OH的产生(Eq. 2),也会影响电芬顿体系中铁泥的形成.所以,本研究首先考察3D-GDE电极电芬顿体系中不同Fe2+浓度对苯酚降解的影响,结果如图7所示.根据文献[35]同时结合H2O2的产量,选择pH 3作为体系最适宜的pH值开展接下来的研究.图7表明,当Fe2+浓度从0.1mmol/L增加到0.4mmol/L时,苯酚的降解率显著提高,在60min电解过程中从20%提高到35 %.根据Eq. 2可知亚铁此时是限制产•OH的关键因素,亚铁离子的增加从而提高了•OH产量,所以苯酚的降解率大幅提高.但是,当亚铁含量超过0.4mmol/L时,继续增加亚铁的浓度,苯酚的降解率反而呈现下降的趋势.可能是Fe2+浓度过量, Fe2+会与•OH发生副反应(Eq. 12)消耗大量的•OH, Fe2+反而成为了•OH猝灭剂,导致3D-GDE电极电芬顿体系氧化能力降低,所以苯酚降解率下降.鉴于以上分析,0.4mmol/L Fe2+选择作为最适宜的亚铁浓度.同时作者发现,本研究中最适宜的亚铁浓度(0.4mmol/L)要高于传统电芬顿中Fe2+最适宜浓度(0.25mmol/L左右),主要是因为与非气体扩散电极相比,气体扩散电极中Fe3+的还原速率(Eq. 3)更低,所以其所需的亚铁离子浓度要更高[35],也正因为此,在气体扩散电极中,尽管H2O2产率优势明显(H2O2本身的氧化苯酚能力有限),但是对苯酚的氧化能力并不突出.
Fe
2+
+
•
OH +H
+
®
Fe
3+
+H
2
O (12)
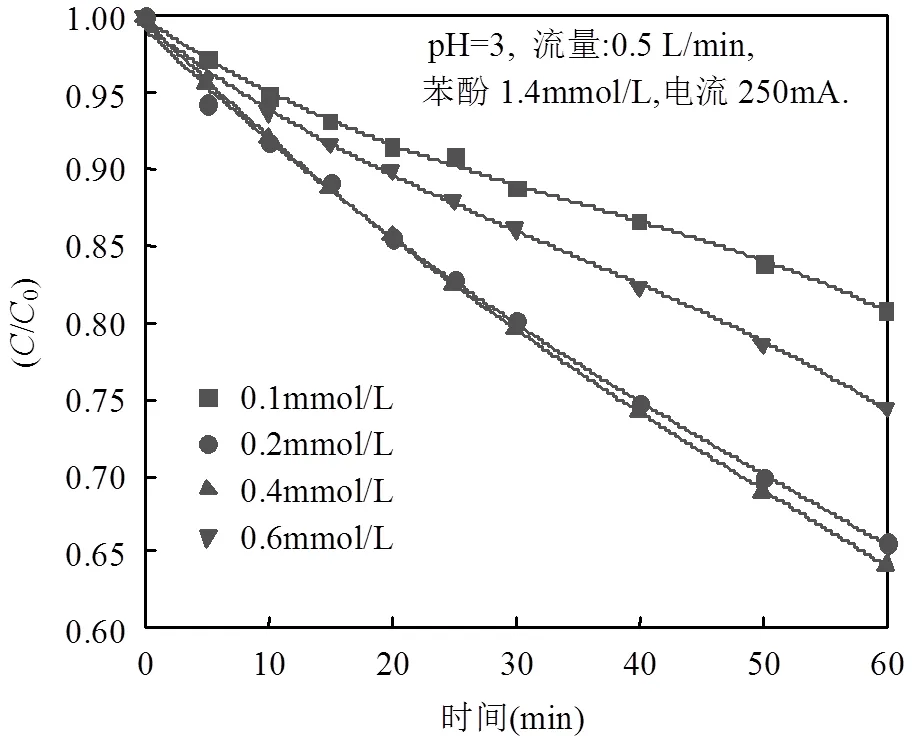
图7 不同亚铁浓度对苯酚降解影响

图8 苯酚降解过程中小分子有机酸的变化
2.2.2 3D-GDE阴极电芬顿体系对苯酚的降解过程有机酸测定及降解途径分析 考察3D- GDE阴极电芬顿体系对苯酚降解过程小分子有机酸变化及降解途径.3D-GDE阴极电芬顿体系降解苯酚过程中产生的羧酸(草酸、马来酸、甲酸、丙二酸、乙酸、乙醇酸)的变化情况如图8所示.在电解的初级阶段,苯醌降解为丙二酸和顺丁烯二酸.丙二酸和顺丁烯二酸进一步转变为甲酸、草酸、乙酸.甲酸和乙酸很快积累并且在前50min的电解中被降解.醋酸的降解形成乙醇酸,然后乙醇酸快速降解为草酸.草酸在前100min时达到0.78mmol/L,然后在接下来的4h电解中被缓慢降解.
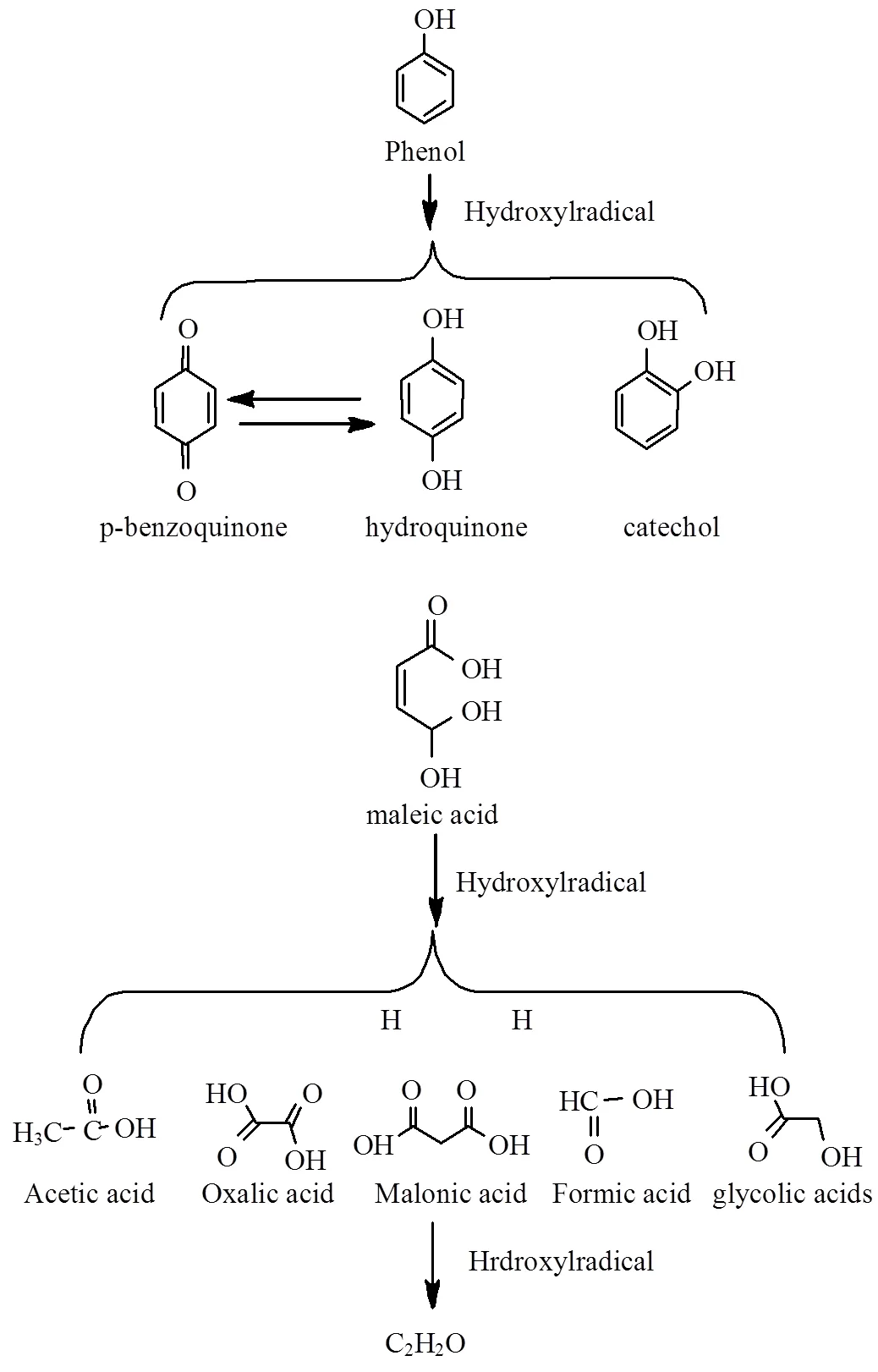
图9 3D-GDE阴极电芬顿体系对苯酚降解途径
pH=3,流量:0.5L/min,苯酚1.4mmol/L,电流250mA和亚铁0.4mmol/L
图9是3D-GDE阴极电芬顿体系对苯酚的降解途径,根据与标准物质对比,对苯二酚、对苯醌、邻苯二酚在高效液相色谱中的保留时间分别为3.20, 5.01和10.92min.因为考虑到这3种物质在的吸附能力,结合色谱峰面积,可以知道邻苯二酚为浓度最大的芳香环类中间产物.与羟基自由基进攻芳香环机理相似,对苯二酚和邻苯二酚分别是羟基自由基进攻苯环对位和邻位而形成的.对苯二酚进一步氧化形成对苯醌,然后其进一部氧化开环而形成羧酸物质.邻苯二酚的开环可能是通过形成o-苯醌(没有检测到).另外一方面,苯酚的多羟基化过程可以形成羟基苯酚,然后在开环之前形成醌类物质[36].该降解途径与以前文献报道的相似[36].
2.3 3D-GDE阴极电芬顿对实际焦化废水降解的矿化率和三维荧光分析
将3D-GDE阴极电芬顿对实际焦化废水降解的矿化率和三维荧光分析进行考察.如图10所示, 3D-GDE阴极电芬顿体系在4h电解后对焦化废水的矿化率高达80%.在0~120min内,焦化废水矿化率高达60%,但是随着电解时间的增加,其矿化率仅仅增加20%左右,说明前2h的电解过程中产生的有机物易于矿化,伴随降解时间延长,难降解物质逐渐积累,不利于矿化率的提高.对于TOC去除的贡献一部分来自电芬顿体系的•OH的氧化,另外一部分来自于电芬顿处理后调节溶液碱性后的絮凝沉淀作用.

图10 焦化废水降解过程中TOC变化
如图11所示.在初始的焦化废水中,出现了3个明显的特征指纹峰:A(络氨酸类物质)-Ex/Em= 270/298nm,B(类蛋白类物质)-Ex/Em=290/360nm, C-Ex/Em=325/365nm,其峰的强度分别为2000a.u, 1989a.u,1800a.u.根据文献报道,原始焦化废水中3个荧光峰分别表明以下物质的存在:类蛋白物质、多环芳烃类物质、可溶性微生物副产物,比如苯酚(271/295nm)、萘(265/336nm),甲酚(270/300nm),喹诺酮(310~340/380~440nm)[37].以上结果与GC-MS结果相符合.然而经过1h电解后,原始焦化废水中的3个指纹峰消失,同时在波长为360~365/445~455nm出现强度为120.12的D峰,表明电解过程中类腐殖酸物质(对苯二酚/醌类Ex/Em=360/445nm)的产生[38].随着电解时间的增加,D峰的强度减少40.23%,同时伴随着激发波长的5nm和发射波长15nm蓝移,表明大分子有机物分解为小分子有机物或多环类物质的降解,比如芳环类降解、共轭结构的破坏[39].但是,随着电解进一步进行,在三维荧光指纹区观察到了红移现象,主要是中间产物进一步降解过程中功能性官能团的增加,比如羧酸、羟基、氨基.通过三维荧光直观分析可知,3D-GDE阴极电芬顿体系可以实现对焦化废水有效降解.
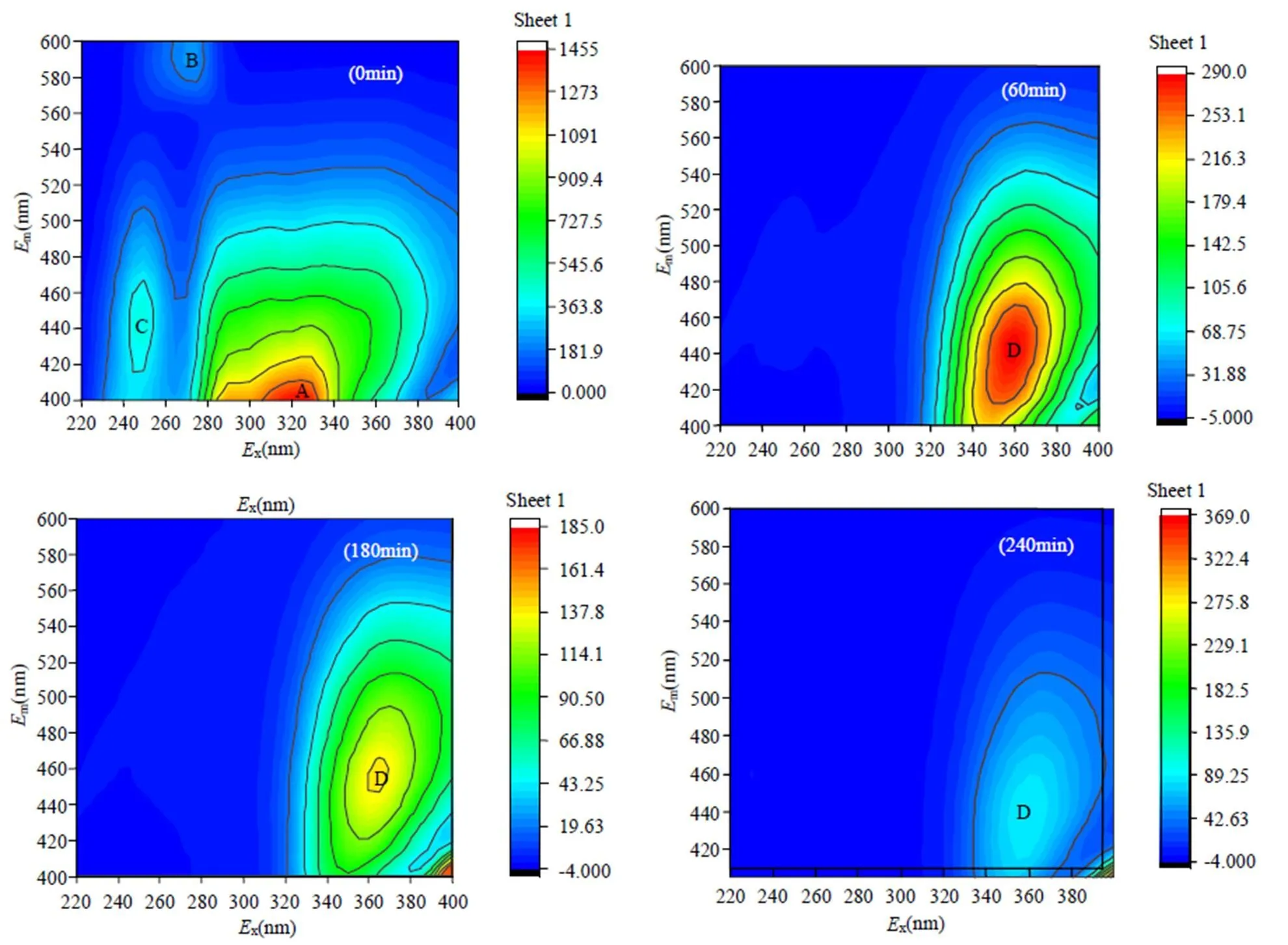
图11 不同电解时间内焦化废水电芬顿降解过程中三维荧光变化
pH=3,流量:0.5L min-1,电流250mA和亚铁0.4mmol/L
2.4 3D-GDE阴极电芬顿对实际焦化废水降解的毒性研究
目前针对污染物的去除不仅需要考虑污染物质去除效率,同时需要考虑处理后的物质排放后是否对水体中的微生物会造成危害.因此本研究采用Microtox毒性试验,测定了焦化废水降解过程中的毒性变化,其中对费氏弧菌荧光抑制率越大表明体系中的毒性越强.结果如图12所示,初始的焦化废水对费氏弧菌荧光抑制率高达70%,原始水体中存在的苯酚等芳环类有机物对细菌表现较高的毒性.在电解的初级阶段(60min),费氏弧菌荧光抑制率从初始的70%上升到100%,说明该阶段电解过程中产生了比原始有机物毒性更大的中间产物.通过文献可知,苯酚的中间产物苯醌即使在较低浓度,其毒性[40]要远高于苯酚,很好解释了电解过程毒性增加的趋势.随着电解的进行,体系的毒性逐渐降低 (20%),低于初始值的70%,说明电芬顿体系对焦化实现了很好的脱毒.所以,Microtox毒性实验表明,3D-GDE电极芬顿体系可以有效的降低焦化废水体系的毒性.

图12 苯酚降解过程中毒性变化
2.5 3D-GDE阴极电芬顿对实际焦化废水降解的能耗核算
当使用电化学体系时能耗是一个重要指标,所以我们核算了3D-GDE阴极电芬顿对焦化废水的能耗,结果如图13所示.图13表明每单位TOC对应能耗随着电解时间的变化情况.从图13可知在电解90min时,体系的能耗最低,为0.9kW·h/g TOC.随着电解时间的增加,逐渐形成的难降解中间产物(羧酸等)及溶液中减少的有机物导致了体系的能耗增加.

图13 电解过程中能耗核算
3 结论
3.1 本研究采用3D打印技术(SolidWorks® 2016 3D CAD)同时结合流体模拟软件对气体扩散进行模拟,设计出的3D-GDE阴极在电流250mA, pH=3时,其H2O2产量高达16.1mg H2O2/cm2,远高于目前文献报道.而相同条件下传统C/PTFE-GDE仅为7.16mg.
3.2 针对实际焦化废水研究表明,3D-GDE阴极电芬顿体系在最适宜条件下(250mA, pH=3, Fe2+= 0.4mmol/L),可以实现对焦化废水有效矿化(4h电解后高达80%),而且其降解过程中三维荧光指纹分析证明了该体系的高效性.
3.3 Microtox毒性实验表明,3D-GDE阴极电芬顿体系可以有效的降低焦化废水体系的毒性.通过能耗分析可知,其能耗为0.9kW·h/g TOC
[1] WANG C, ZHANG M, LIU W, et al. Effluent characteristics of advanced treatment for biotreated coking wastewater by electrochemical technology using BDD anodes [J]. Environmental Science & Pollution Research International, 2015,22(9):6827-6834.
[2] 张 锦,李圭白,马 军.含酚废水的危害及处理方法的应用特点[J]. 化学工程师, 2001,(2):36-37.
[3] MARTÍNEZ-HUITLE C A, RODRIGO M A, SIRÉS I, et al. Single and coupled electrochemical processes and reactors for the abatement of organic water pollutants: a critical review [J]. Chemical Reviews, 2015,115(24):13362-13407.
[4] QIU S, HE D, MA J, et al. Kinetic modeling of the electro-Fenton process: quantification of reactive oxygen species generation [J]. Electrochimica Acta, 2015,176:51-58.
[5] SIRÉS I, BRILLAS E, OTURAN M A, et al. Electrochemical advanced oxidation processes: today and tomorrow. A review [J]. Environmental Science and Pollution Research, 2014,21(14):8336- 8367.
[6] BRILLAS E, SIRES I, OTURAN M A. Electro-Fenton process and related electrochemical technologies based on Fenton's reaction chemistry [J]. Chemical reviews, 2009,109(12):6570-6631.
[7] YANG K S, MUL G, MOULIJN J A. Electrochemical generation of hydrogen peroxide using surface area-enhanced Ti-mesh electrodes [J]. Electrochimica acta, 2007,52(22):6304-6309.
[8] LEI H, LI H, LI Z, et al. Electro-Fenton degradation of cationic red X-GRL using an activated carbon fiber cathode [J]. Process safety and environmental protection, 2010,88(6):431-438.
[9] LIU X, YANG D, ZHOU Y, et al. Electrocatalytic properties of N-doped graphite felt in electro-Fenton process and degradation mechanism of levofloxacin [J]. Chemosphere, 2017,182:306-315.
[10] SANDU C, POPESCU M, ROSALES E, et al. Electrokinetic oxidant soil flushing: A solution for in situ remediation of hydrocarbons polluted soils [J]. Journal of Electroanalytical Chemistry, 2017,799: 1-8.
[11] CHEN W, YANG X, HUANG J, et al. Iron oxide containing graphene/carbon nanotube based carbon aerogel as an efficient E- Fenton cathode for the degradation of methyl blue [J]. Electrochimica Acta, 2016,200:75-83.
[12] SOLANO A M S, MARTÍNEZ-HUITLE C A, GARCIA-SEGURA S, et al. Application of electrochemical advanced oxidation processes with a boron-doped diamond anode to degrade acidic solutions of Reactive Blue 15 (Turqueoise Blue) dye [J]. Electrochimica Acta, 2016,197:210-220.
[13] BANUELOS J A, EI-GHENYMY A, RODRIGUEZ F J, et al. Study of an air diffusion activated carbon packed electrode for an electro- Fenton wastewater treatment [J]. Electrochimica Acta, 2014,140(SI): 412-418.
[14] 王雪莹.3D打印技术与产业的发展及前景分析[J]. 中国高新技术企业, 2012,(26):3-5.
[15] 李小丽,马剑雄,李 萍,等.3D打印技术及应用趋势[J]. 自动化仪表, 2014,(1):1-5.
[16] BRILLAS E, LLOSA E, CASADO J, et al. Electrochemical destruction of aniline and 4-chloroaniline for wastewater treatment using a carbon-PTFE O2-fed-cathode [J]. Journal of the Electrochemical Society, 1995,142(6):1733-1741.
[17] JUNGLEE S, URBAN L, SALLANON H, et al. Optimized assay for hydrogen peroxide determination in plant tissue using potassium iodide [J]. American Journal of Analytical Chemistry, 2014,5:730- 736.
[18] MOUSSET E, KO Z T, SYAFIQ M, et al. Electrocatalytic activity enhancement of a graphene ink-coated carbon cloth cathode for oxidative treatment [J]. Electrochimica Acta, 2016,222:1628-1641.
[19] 肖 华,周荣丰.电芬顿法的研究现状与发展[J]. 上海环境科学, 2004,(6):253-256.
[20] 张 锋.电芬顿法降解苯酚废水的研究[J]. 广州化工, 2014, (10):116-117.
[21] 毕 强,薛娟琴,郭莹娟,等.电芬顿法去除兰炭废水COD [J]. 环境工程学报, 2012,(12):4310-4314.
[22] POZZO A D, PALMA L D, MERLI C, et al. An experimental comparison of a graphite electrode and a gas diffusion electrode for the cathodic production of hydrogen peroxide [J]. Journal of Applied Electrochemistry, 2005,35(4):413-419.
[23] YU X, ZHOU M, REN G, et al. A novel dual gas diffusion electrodes system for efficient hydrogen peroxide generation used in electro- Fenton [J]. Chemical Engineering Journal, 2015,263:92-100.
[24] 邱 珊,柴一荻,古振澳,等.电芬顿反应原理研究进展[J]. 环境科学与管理, 2014,(9):55-58.
[25] XIA G, LU Y, XU H. Electrogeneration of hydrogen peroxide for electro-Fenton via oxygen reduction using polyacrylonitrile-based carbon fiber brush cathode [J]. Electrochimica Acta, 2015,158: 390-396.
[26] 郁青红,周明华,雷乐成.新型气体扩散电极体系高效产H2O2的研究[J]. 物理化学学报, 2006,(7):883-887.
[27] 汤 培.石墨/聚四氟乙烯气体扩散电极的制备及其性能研究[D]. 河北:燕山大学, 2012.
[28] VALIM R B, REIS R M, CASTRO P S, et al. Electrogeneration of hydrogen peroxide in gas diffusion electrodes modified with tert- butyl-anthraquinone on carbon black support [J]. Carbon, 2013,61: 236-244.
[29] GARCÍA-RODRÍGUEZ O, BAÑUELOS J A, EL-GHENYMY A, et al. Use of a carbon felt-iron oxide air-diffusion cathode for the mineralization of Malachite Green dye by heterogeneous electro- Fenton and UVA photoelectro-Fenton processes [J]. Journal of Electroanalytical Chemistry, 2016,767:40-48.
[30] ZHANG Z, MENG H, WANG Y, et al. Fabrication of graphene@graphite-based gas diffusion electrode for improving H2O2generation in electro-Fenton process [J]. Electrochimica Acta, 2018, 260:112-120.
[31] LIU T, WANG K, SONG S, et al. New electro-Fenton gas diffusion cathode based on nitrogen-doped graphene@carbon nanotube composite materials [J]. Electrochimica Acta, 2016,194(Supplement C):228-238.
[32] CHEN Z, DONG H, YU H, et al. In-situ electrochemical flue gas desulfurization via carbon black-based gas diffusion electrodes: performance, kinetics and mechanism [J]. Chemical Engineering Journal, 2017,307:553-561.
[33] BANUELOS J A, EI-GHENYMY A, RODRIGUEZ F J, et al. Study of an air diffusion activated carbon packed electrode for an electro- Fenton wastewater treatment [J]. Electrochimica Acta, 2014,140(SI): 412-418.
[34] FORTI J C, VENANCIO C E, LANZA M R V, et al. Effects of the modification of gas diffusion electrodes by organic redox catalysts for hydrogen peroxide electrosynthesis [J]. Journal of The Brazilian Chemical Society, 2008,19(4):643-650.
[35] BRILLAS E, SIRÉS I, OTURAN M A. Electro-Fenton process and related electrochemical technologies based on Fenton's reaction chemistry. [J]. Chemical Reviews, 2009,109(12):6570-6631.
[36] PIMENTEL M, OTURAN N, DEZOTTI M, et al. Phenol degradation by advanced electrochemical oxidation process electro-Fenton using a carbon felt cathode [J]. Applied Catalysis B: Environmental, 2008, 83(1):140-149.
[37] ALARCÓN F, BÁEZ M E, BRAVO M, et al. Feasibility of the determination of polycyclic aromatic hydrocarbons in edible oils via unfolded partial least-squares/residual bilinearization and parallel factor analysis of fluorescence excitation emission matrices [J]. Talanta, 2013,103(21):361.
[38] ARIESE F, ASSEMA S V, GOOIJER C, et al. Comparison of laurentian fulvic acid luminescence with that of the hydroquinone/ quinone model system: evidence from low temperature fluorescence studies and EPR spectroscopy [J]. Aquatic Sciences, 2004,66(1):86- 94.
[39] LI J, LIU X, WANG S, et al. Synthesis and optimization of a novel poly-silicic metal coagulant from coal gangue for tertiary-treatment of coking wastewater [J]. Journal of Chemical Technology & Biotechnology, 2017.
[40] BARHOUMI N, OTURAN N, OLVERA-VARGAS H, et al. Pyrite as a sustainable catalyst in electro-Fenton process for improving oxidation of sulfamethazine. Kinetics, mechanism and toxicity assessment [J]. Water Research, 2016,94:52-61.
Enhancement of H2O2accumulationat gas diffusion electrodes (GDEs) optimized by 3D-printed technique and its utilization in electro-Fenton for coking wastewater treatment.
QIU Shan1,2*, GAO Wei-jie1,2, DENG Feng-xia1,2, ZHU Ying-shi1,2, MA Fang1,2, YANG Ji-xian1,2
(1.School of Environment, Harbin Institute of Technology, Harbin 150090, China;2.State Key Laboratory of Urban Water Resource and Environment,Harbin Institute of Technology, Harbin 150090, China)., 2018,38(11):4075~4084
In this study, 3D-printed GDE (3D-GDE) with a high H2O2generation rate was designed using a three-dimensional printing approach and its application in electro-Fenton for coking wastewater treatment. Results showed that H2O2reached 16.1mg H2O2/cm2, which was superior to the conventional gas diffusion electrode in the absence of the 3D-printedstructure with 7.16mg H2O2/cm2H2O2capacity under the same conditions. Moreover, it showed acid condition was favorable for the H2O2production, and H2O2generation rose from 250mg/L to 450mg/L as current increased from 200mA to 250mA. However, a further enhancement in current failed to improve H2O2generation capacity. The proposed system was used for coking wastewater treatment following the optimization of the operating factors. Mineralization rate of coking wastewater could reach as high as 80% in 4h electrolysis by the 3D-GDE electro-Fenton process. Moreover, three-dimensional fluorescence method confirmed the effectiveness of the process in a direct approach. Microtox toxicity results revealed that the 3D-GDE electro-Fenton process was effective for coking wastewater detoxification and the lowest energy consumption for coking wastewater was calculated as 0.9kW·h/g TOC.
3D-printed technique;gas diffusion electrodes (GDEs);electro-fenton (EF);phenol;coking wastewater;Microtox
X703
A
1000-6923(2018)11-4075-10
邱 珊(1982-),女,黑龙江哈尔滨人,副教授,博士研究生,主要研究方向为环境生物技术,环境催化化学.发表论文近40篇.
2018-04-10
城市水资源与水环境国家重点实验室自主课题(HCK201708);国家重点研发计划项目(2016YFC0401102)
* 责任作者, 副教授, qiushan@hit.edu.cn

