抗赭曲霉毒素A五价纳米抗体的表达及分析
,, , ,,,,,*
(1.南昌大学食品学院,江西南昌 330047; 2.南昌大学食品科学与技术国家重点实验室,江西南昌 330047; 3.南昌大学,中德联合研究院,江西南昌 330047)
赭曲霉毒素(ochratoxin)是由曲霉菌属(Aspergillus)和青霉菌属(Penicillium)的某些种产生的次级代谢产物,包含7种结构类似的化合物[1-2]。其中赭曲霉毒素A(ochratoxin A,OTA)毒性最强,具有肾脏毒性、肝脏毒性及致畸、致癌和致突变等特性[3-4]。霍乱毒素B亚基(B subunit of Cholera toxin,CTB)通过最近邻相互作用形成自组装五元环状结构[5],通常被作为免疫佐剂,将抗原与其融合表达来提高免疫原性[6]。纳米抗体(nanobody,Nb)又被称为单域重链抗体(variable domain of heavy chain of heavy-chain)[7],由天然缺失轻链的重链可变区构成,是自然存在的可与抗原结合的最小片段[8],具有分子质量小、易改造、易于表达以及稳定性好等优点[9-12]。纳米抗体现已被广泛的应用于医学诊断、药物开发、食品安全检测等方面[13-15]。结合基因工程技术可得到不同形式的纳米抗体,如多价纳米抗体[16]、融合型纳米抗体[17]、多特异性纳米抗体[18]等均有报道,相比其他抗体,经过改造携带特定结构的纳米抗体具有更加明显的优势。在前期工作中,实验室已成功构建出pET-CTB-VHH28原核表达载体。本研究主要将该重组载体转化至大肠杆菌BL21(DE3)中进行原核表达,利用CTB自组装形成五聚体结构,从而将纳米抗体VHH28多聚化。通过优化表达条件从而得到可溶性的融合蛋白CTB-VHH28,并对其活性及稳定性进行初步分析,为后续建立检测OTA方法提供基础。
1 材料与方法
1.1 材料与仪器
重组载体pET-CTB-VHH28、表达菌株EscherichiacoliBL21(DE3) 均由本实验室保存;人工抗原OTA-BSA 由本实验室制备;OTA 美国Sigma-Aldrich 公司;HisTrapTMHP预装柱(1 mL)、兔抗 HIS[HRP]多克隆抗体 美国GE公司;异丙基β-D-硫代吡喃半乳糖苷(Isopropy-β-D-thiogalactoside,IPTG) 美国Thermo Fisher公司,三(羟甲基)氨基甲烷,3,3,5,5-四甲基联苯胺(TMB) 上海阿拉丁生化科技股份有限公司;其他试剂与药品 均为国产分析纯。
酶联免疫分析仪(Multiscan FC)、低温高速离心机(Multifuge X1R) 美国Thermo公司;Millipore超纯水仪 美国Millipore公司;恒温摇床 上海智城公司;DYY-I III琼脂糖凝胶电泳仪 北京六一仪器厂;JY92-IIDN超声波细胞破碎仪 宁波新艺超声设备有限公司。
1.2 实验方法
1.2.1 CTB-VHH28诱导条件的确定 通过将重组载体PET-CTB-VHH28转化至E.coliBL21(DE3)中,成功表达出OTA五价纳米抗体,分子量大小约150 kDa。为了得到纯度较高的五价纳米抗体及提高蛋白的表达量,本研究对诱导剂用量、诱导温度及诱导时间三个主要因素进行了优化。
1.2.1.1 诱导剂IPTG浓度的确定 将37 ℃、220 r/min培养12 h的含有质粒pET-CTB-VHH28的E.coliBL21(DE3)菌液,按1%的接种量接种至LB液体培养基(含有终浓度为100 μg/mL Amp)中,37 ℃、220 r/min培养至菌液OD600=0.6~0.8,加入不同浓度的IPTG(终浓度分别为0.02、0.05、0.1、0.2、0.5 mmol/L),20 ℃、180 r/min诱导表达12 h,取样10 μL,加入蛋白上样缓冲液,95 ℃加热变性10 min,进行SDS-PAGE电泳分析。
1.2.1.2 诱导温度的确定 将37 ℃、220 r/min培养12 h的含有质粒PET-CTB-VHH28的E.coliBL21(DE3)菌液,按1%的接种量接种至LB液体培养基(含有终浓度为100 μg/mL Amp)中,37 ℃、220 r/min培养至菌液OD600=0.6~0.8,加入诱导剂IPTG(终浓度为0.05 mmol/L),分别在16、20、25 ℃下,180 r/min诱导表达12 h,取样10 μL,加入蛋白上样缓冲液,95 ℃加热变性10 min,进行SDS-PAGE电泳分析。
1.2.1.3 诱导时间的确定 将37 ℃、220 r/min培养12 h的含有质粒pET-CTB-VHH28的E.coliBL21(DE3)菌液,按1%的接种量接种至LB液体培养基(含有终浓度为100 μg/mL Amp)中,37 ℃、220 r/min培养至菌液OD600=0.6~0.8,加入诱导剂IPTG(终浓度为0.05 mmol/L),16 ℃、180 r/min分别表达2、4、6、8、10、12 h,取样10 μL,加入蛋白上样缓冲液,95 ℃加热变性10 min,进行SDS-PAGE电泳分析。
1.2.2 纳米抗体CTB-VHH28聚合情况的分析 将37 ℃、220 r/min培养12 h的含有质粒pET-CTB-VHH28的E.coliBL21(DE3)菌液,按1%的接种量接种至LB液体培养基(含有终浓度为100 μg/mL Amp)中,37 ℃、220 r/min培养至菌液OD600=0.6~0.8,加入诱导剂IPTG(终浓度为0.05 mmol/L),16 ℃、180 r/min诱导表达10 h,收集菌体,磷酸缓冲液(phosphate buffered saline,PBS)清洗菌体,离心收集菌体,重悬至PBS中,超声破碎,收集上清,过Ni柱纯化,分别用含有20、50、100 mmol/L咪唑的缓冲溶液依次清洗柱体,洗去杂蛋白,含有200 mmol/L咪唑的缓冲液将目的蛋白洗脱,收集洗脱的目的蛋白,用1×PBS 4 ℃透析,每隔8 h更换一次透析液,透析24 h,分别取透析后的样品各10 μL,分别加入含有β-巯基乙醇的上样缓冲液加热变性和不含β-巯基乙醇的上样缓冲液,SDS-PAGE电泳分析。
1.2.3 间接ELISA测定纳米抗体CTB-VHH28效价 100 μL/孔人工抗原OTA-BSA(2 μg/mL)加入酶标板4 ℃包被过夜,PBST洗板3次,300 μL/孔4%脱脂牛奶37 ℃封闭2 h,PBST洗板3次,100 μL/孔不同稀释倍数(分别稀释400、800、1600、3200、6400、12800倍)的纳米抗体CTB-VHH28,37 ℃孵育1 h,PBST洗板3次,100 μL/孔HIS二抗,37 ℃孵育1 h,PBST洗板3次,100 μL/孔TMB显色液37 ℃显色8 min,50 μL/孔终止液终止反应,测定OD450。
1.2.4 CTB-VHH28间接竞争ELISA标准曲线的绘制 100 μL/孔人工抗原OTA-BSA(2 μg/mL)加入酶标板4 ℃包被过夜,PBST洗板3次,300 μL/孔4%脱脂牛奶37 ℃封闭2 h,PBST洗板3次,50 μL/孔纳米抗体CTB-VHH28和50 μL/孔不同浓度的OTA标准品(0、0.05、0.1、0.25、0.5、1、2.5、5、10、25 ng/mL),37 ℃孵育1 h,PBST洗板3次,100 μL/孔HIS二抗,37 ℃孵育1 h,PBST洗板3次,100 μL/孔TMB显色液37 ℃显色8 min,50 μL/孔终止液终止反应,测定OD450。以结合率(B/B0,%)=[(竞争抗原孔OD450值-空白对照OD450值)/非竞争抗原孔 OD450值]×100为纵坐标,使用逻辑斯蒂方程(y=A2+(A1-A2)/[1+(x/x0)^p)拟合绘制CTB-VHH28-ELISA竞争抑制曲线。
1.2.5 纳米抗体CTB-VHH28特异性分析 分别配制工作浓度(0、0.05、0.1、0.25、0.5、1、2.5、5、10、25 ng/mL)的黄曲霉毒素B1(Aflatoxin B1,AFB1)、玉米赤霉烯酮(Zearalenone,ZEN)、脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)标准品代替OTA标准品进行间接竞争ELISA绘制相应的竞争抑制曲线,计算其 IC50及交叉反应率(Cross Reactivity,CR)。CR(%)=[IC50(OTA)/IC50(AFB 1/ZEN/DON)]× 100。
1.2.6 纳米抗体CTB-VHH28热稳定性分析 取纯化透析后的CTB-VHH28分别在30、40、50、60、70、80、90 ℃下孵育10 min,迅速冰浴5 min,取样10 μL,加入不含有β-巯基乙醇的上样缓冲液,上样进行SDS-PAGE电泳,分析温度对CTB-VHH28结构的影响。取纯化透析后的CTB-VHH28分别在25、35、45、55、65、75、85、95 ℃下孵育10 min,采用间接ELISA分析不同温度处理的CTB-VHH28抗原结合活性。取纯化后CTB-VHH28分别置于35、55、75 ℃三种温度下,分别作用10、20、30、40、50、60 min,以剩余活性(%)=(加热处理的CTB-VHH28 OD450/未处理的CTB-VHH28 OD450)×100%为纵坐标,分析CTB-VHH28热稳定性。
1.2.7 甲醇浓度对纳米抗体CTB-VHH28的影响 配制体积分数为2.5%、5%、10%、20%、40%甲醇-PBS缓冲液稀释OTA标准品至不同的工作浓度(0、0.05、0.1、0.25、0.5、1、2.5、5、10、25 ng/mL),纳米抗体CTB-VHH28的工作浓度为0.06 μg/mL,间接竞争ELISA分析不同甲醇浓度对纳米抗体CTB-VHH28的灵敏度的影响,绘制CTB-VHH28竞争抑制曲线。
1.3 数据统计分析
数据统计分析采用Origin 8.0软件,对数据进行非线性回归分析。
2 结果与分析
2.1 诱导剂IPTG浓度的确定
如图1所示,诱导剂IPTG的浓度为0.02 mmol/L时,CTB-VHH28蛋白的表达量最低,其他浓度IPTG对CTB-VHH28的表达量没有明显的影响。IPTG作为一种强诱导剂,在菌体中不能够被代谢,可以持续地发挥作用,所以少量的IPTG就可以起到很好的诱导效果[19]。所以选择终浓度为0.05 mmol/L的IPTG作为最佳的诱导剂浓度。
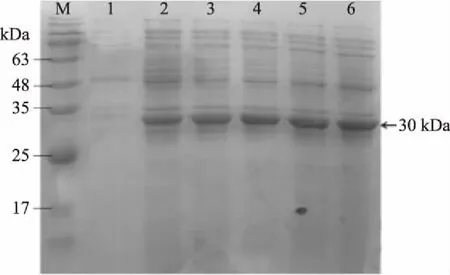
图1 IPTG浓度对CTB-VHH28表达的影响Fig.1 Effect of IPTG concentration on the expression of CTB-VHH28注:M:广谱蛋白Marker;1:未加入IPTG的菌体总蛋白; 2~6:IPTG浓度分别为0.02、0.05、0.1、0.2、 0.5 mmol/L诱导后的菌体总蛋白。
2.2 诱导温度的确定
诱导温度不仅影响菌体的生长,同样影响着重组蛋白的诱导表达及蛋白的可溶性。很多蛋白在温度较高条件下诱导表达时容易出现错误性折叠,从而形成包涵体沉淀,而低温诱导可以有助于蛋白的可溶性表达及形成正确的结构[20],如图2所示,在16、20、25 ℃三种温度下诱导表达的蛋白量基本一致,故选取温度更低的16 ℃为纳米抗体CTB-VHH28最佳的诱导表达温度,以实现可溶性表达及形成正确结构。
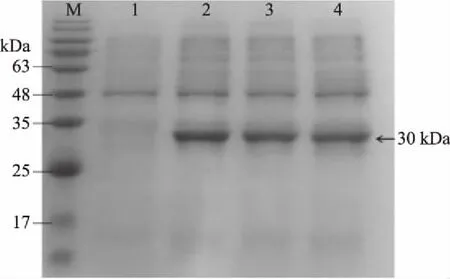
图2 诱导温度对CTB-VHH28表达的影响Fig.2 Effect of induction temperature on the expression of CTB-VHH28注:M:广谱蛋白Marker;1:诱导前菌体总蛋白; 2~4:分别在16、20、25 ℃下诱导后的菌体总蛋白。
2.3 诱导时间的确定
由图3可知,纳米抗体CTB-VHH28随着诱导时间的增加,菌液中CTB-VHH28产量呈上升的趋势,当诱导10 h后,CTB-VHH28表达量没有明显的变化,原因可能是随着诱导时间的增加,菌体产酶逐渐饱和使其表达量不再增加,同时产生的外源蛋白也可能会被菌体产生的蛋白酶降解,使其表达量降低,故而选取10 h为纳米抗体CTB-VHH28的最佳诱导时间。
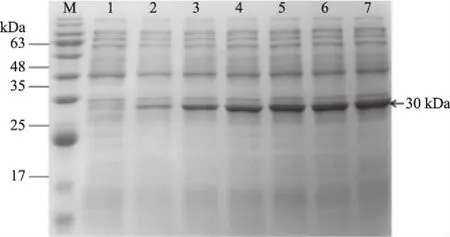
图3 诱导时间对CTB-VHH28表达的影响Fig.3 Effect of induction time on the expression of CTB-VHH28注:M:广谱蛋白Marker;1:诱导前菌体总蛋白;2~7:分别诱导表达2、4、6、8、10、12 h后的菌体总蛋白。
2.4 CTB-VHH28聚合情况分析
从图4中可以得知,菌体破碎上清经过Ni柱纯化透析后,得到了较纯的纳米抗体且以五聚体的形式存在,分子量大约为150 kDa,而经过加热变性解链为单体后的分子量大小约为30 kDa,均与软件(DNAstar)预测大小相一致。经Nanodrop 1000定量计算得出重组蛋白表达量达20 mg/L。
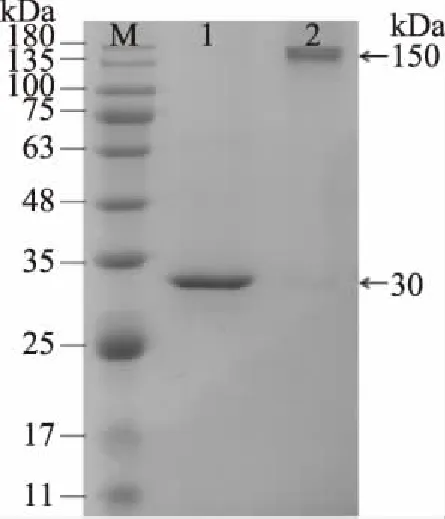
图4 CTB-VHH28聚合情况分析Fig.4 The result of CTB-VHH28 pentamer注:M:广谱蛋白Marker;1:加入含有β-巯基乙醇的上样Buffer且加热变性的CTB-VHH28;2:加入不含有β-巯基乙醇上样Buffer且不加热的CTB-VHH28。
2.5 纳米抗体CTB-VHH28的活性分析
间接ELISA测定纳米抗体CTB-VHH28的效价。由表1可知,随着纳米抗体CTB-VHH28稀释倍数的增加,OD450逐渐减小,说明因反应体系中CTB-VHH28浓度降低,与人工抗原特异性结合的抗体减少,选取显色值在1.0~1.2左右为最佳,当稀释6400倍(终浓度为:0.06 μg/mL)为最佳工作浓度。
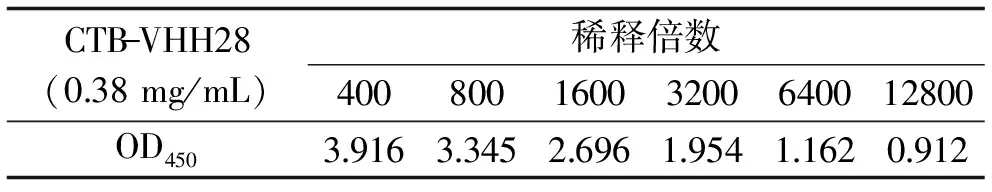
表1 纳米抗体CTB-VHH28效价测定Table 1 The test for potency of CTB-VHH28
间接竞争ELISA分析纳米抗体CTB-VHH28活性,绘制CTB-VHH28-ELISA竞争抑制曲线。如图5所示,当反应体系中OTA标品浓度增加,OD450呈下降的趋势。结果表明,纳米抗体CTB-VHH28与人工抗原OTA-BSA的结合可被竞争抗原OTA抑制且阻断,显示其出了良好特异性。在反应体系甲醇浓度为2.5%时,绘制CTB-VHH28-ELISA标准曲线,半数抑制率(IC50)为0.38 ng/mL。
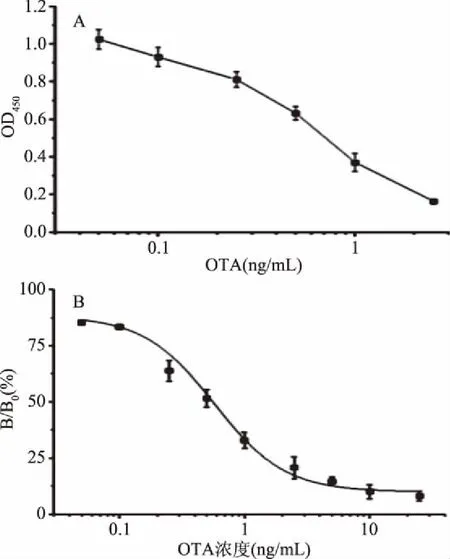
图5 间接竞争ELISA分析纳米抗体CTB-VHH28活性Fig.5 Bioactivity analysis of CTB-VHH28 by indirect competitive ELISA注:A:纳米抗体CTB-VHH28与OTA-BSA结合活性;B:CTB-VHH28间接竞争ELISA标准曲线。
2.6 纳米抗体CTB-VHH28特异性分析
如图6所示,纳米抗体CTB-VHH28与其他几种真菌毒素几乎无交叉反应,均小于1.5%,只与OTA特性结合,具有较高的特异性,可用于OTA的检测。
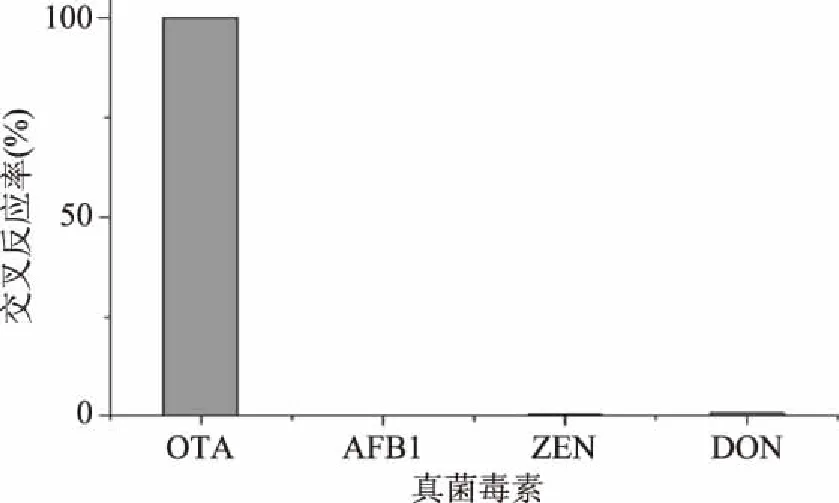
图6 CTB-VHH28与其他真菌毒素的交叉反应率Fig.6 Cross reactivity of CTB-VHH28 with other mycotoxins
2.7 纳米抗体CTB-VHH28热稳定性分析
通过SDS-PAGE初步分析五聚体结构的热稳定性。如图7所示,纳米抗体CTB-VHH28在30~60 ℃处理5 min后,纳米抗体的分子量均为150 kDa,五聚体结构基本没有被破坏,70 ℃处理5 min后,在30 kDa的位置逐渐出现条带,且150 kDa的条带变小,表明五聚体部分解链为单体。随着温度的升高,当经过90 ℃热处理5 min后,纳米抗体CTB-VHH28全部解链为30 kDa单体。纳米抗体单体及霍乱毒素B亚基的肽链上均存在两个半胱氨酸。肽链上的半胱氨酸残基的巯基基团能发生氧化反应形成分子内二硫键,当加热温度过高时,二硫键被破坏,导致五聚体结构被破坏为单体[21]。
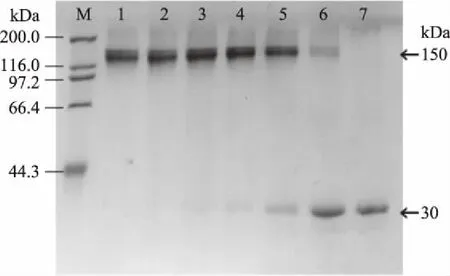
图7 温度对CTB-VHH28五聚体结构的影响Fig.7 Effect of temperature on the pentamer structure of CTB-VHH28注:M:高分子质量蛋白Marker;1~7:分别在30、40、50、60、70、80、90 ℃加热处理后的CTB-VHH28且加入不含β-巯基乙醇的上样Buffer。
通过间接ELISA分析热处理对CTB-VHH28活性的影响。如图8(A)所示,CTB-VHH28在不高于65 ℃加热10 min后,能保持75%以上活性,随着温度的升高,CTB-VHH28活性下降明显,当加热温度高于85 ℃时,抗体基本失活。由图8(B)可知,当加热温度不高于55 ℃,CTB-VHH28结构稳定,活性基本保持不变。综合以上结果,可推断CTB-VHH28失活的临界温度在55~75 ℃之间。
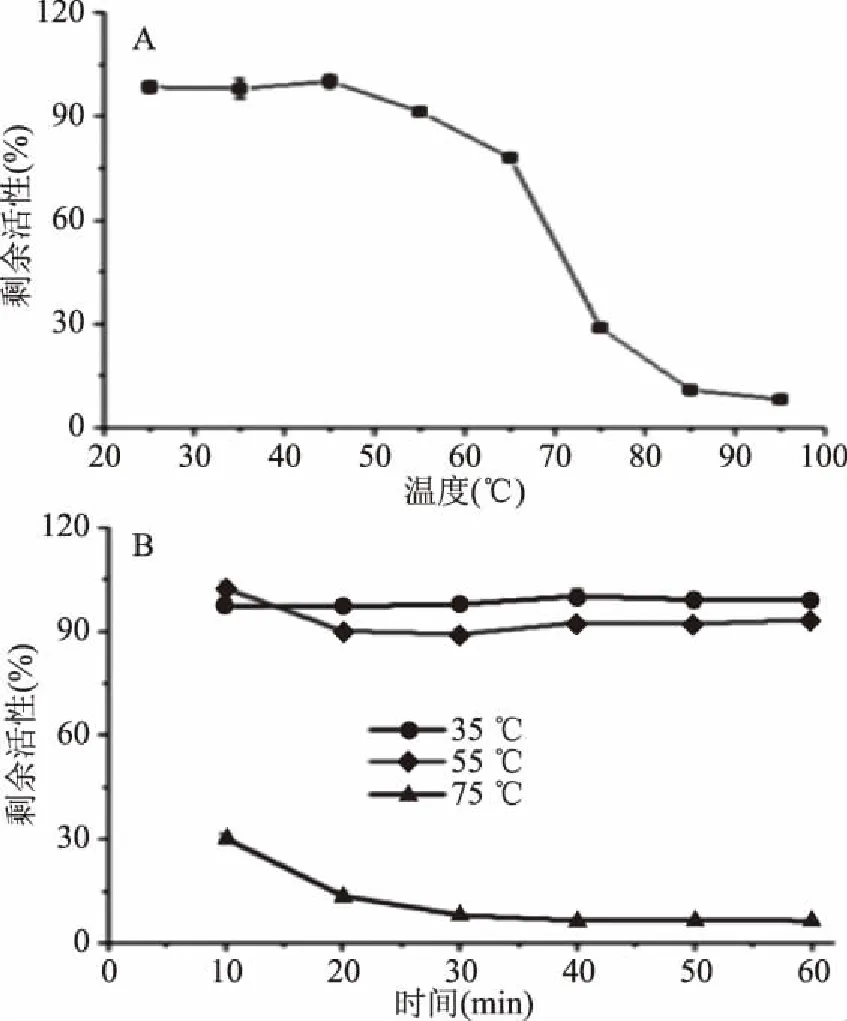
图8 热处理对纳米抗体CTB-VHH28活性的影响Fig.8 Effect of heat treatment on activity of CTB-VHH28注:A:不同温度处理对CTB-VHH28活性的影响; B:不同热处理时间对CTB-VHH28活性的影响。
2.8 纳米抗体CTB-VHH28的甲醇耐受性
OTA标准品难溶于水,易溶于有机溶剂,在ELISA试验中,OTA通常用甲醇-PBS溶解,而甲醇会影响抗体的构象和抗原抗体的相互作用。如图9所示,反应体系中甲醇浓度为2.5%时,CTB-VHH的IC50最低,可以达到0.38 ng/mL。反应体系中甲醇浓度不高于10%时,抗原与CTB-VHH28的结合能力没有明显变化。当反应体系中甲醇浓度为40%时,CTB-VHH28与抗原的相互作用明显减弱,竞争抑制率下降。
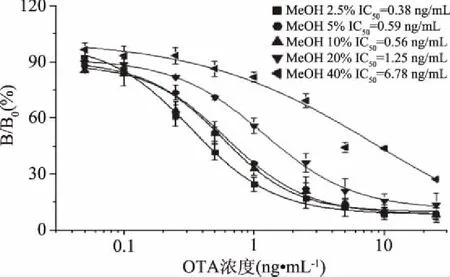
图9 CTB-VHH28甲醇耐受性分析Fig.9 Methanol tolerance analysis of CTB-VHH28
3 讨论与结论
通常情况下,纳米抗体从纳米抗体库中筛选得到,其表面有大量的亲水残基,保持严格的单体结构,即单价纳米抗体。多价纳米抗体是识别同一种表位的单价纳米抗体的聚合物,其不仅具备单价纳米抗体特性,且具有更多的抗原识别位点[22]。霍乱毒素B亚基(CTB)很容易分泌到胞外,用基因工程亦能得到高产量的CTB克隆株,即使在大肠杆菌宿主菌中,CTB仍能分泌在胞外或细胞周质[23]。本研究基于重组载体pET25b-CTB-VHH28,将其转入到大肠杆菌BL21(DE3)中进行原核表达,实现了OTA纳米抗体VHH28与CTB融合蛋白的可溶表达,并成功得到了五价的纳米抗体CTB-VHH28。通过优化纳米抗体CTB-VHH28表达条件,确定了最佳表达温度为16 ℃、诱导剂浓度为0.05 mmol/L、诱导时间为10 h。经纯化后得到了较纯的五价纳米抗体,大小为150 kDa。经测定表达量可达20 mg/L,相较于纳米抗体在E.coli中常见的表达量(10 mg/L)[24],该融合蛋白表达量较好。通过对CTB-VHH28分析,本研究制备的新型纳米抗体CTB-VHH具有良好的特异性,与其他几种常见的真菌毒素无交叉反应。在反应体系中,甲醇浓度为2.5%条件下,IC50为0.38 ng/mL。通过对纳米抗体CTB-VHH28热稳定性及甲醇耐受性分析,当加热温度高于85 ℃时,抗体基本失活,CTB-VHH28失活的临界温度在55~75 ℃之间。反应体系中甲醇浓度不高于10%时,抗原与CTB-VHH28的结合能力没有明显变化。有利于提高检测方法的重复性和稳定性,为建立OTA的检测方法奠定了基础。

