托盘根不同溶剂萃取物的活性成分及其体外抗氧化活性
,, , ,
(1.吉林化工学院,化学与制药工程学院,吉林吉林 132022; 2.吉林化工学院,图书馆,吉林吉林 132022)
托盘(RubuscrataegifoliusBunge.)为蔷薇科悬钩子属植物,又名牛迭肚、马林果、山楂叶悬钩子,为落叶小灌木[1]。广泛分布于我国东北、华东和中南部地区。托盘既有较高的食用价值,又有药用价值。其根具有抗氧化、抗炎、抗肿瘤等作用,民间广泛用于治疗风湿性关节炎、肝炎、痛风等[2]。化学成分研究表明,托盘根中含有黄酮类、皂苷类、鞣质类、芪类等化合物[3-5]。现代药理学研究表明,托盘根提取物具有抗衰老、抗肿瘤、抗炎、降血压、抗肥胖、降糖等功效[6-11],托盘根的抗氧化能力研究表明托盘根乙醇提取物和乙酸乙酯、正丁醇、氯仿萃取物对动物组织的脂质过氧化具有很强的抑制作用[12-15]。其中酚酸类和黄酮类成分是托盘根体外抗氧化活性成分[5]。目前对托盘根抗氧化活性主要采用其醇提物和不同溶剂萃取物,但对其不同溶剂萃取物中活性成分的含量分析及不同萃取物的体外抗氧化活性的比较还未见报道,因此,本研究用不同溶剂对托盘根水提物进行萃取,测定不同萃取物中总黄酮、总皂苷和总酚酸的含量,并对其体外清除DPPH自由基、ABTS自由基和超氧阴离子的能力进行评价。
1 材料与方法
1.1 材料与仪器
托盘根 采集自吉林市郊区,经长春中医药大学李勇教授鉴定为蔷薇科悬钩子植物托盘的干燥根;芦丁、齐墩果酸、没食子酸对照品 上海金穗生物科技有限公司;1,1-二苯基-2-苦肼基(DPPH)、2,2′-联氨-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、过硫酸钾 上海晶纯生化科技股份有限公司;维生素C 天津市致远化学试剂有限公司;其他试剂 均为分析纯。
TU-1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;SpectraMax Plus384型酶标仪 美国Molecular Devices公司;RE-3000型旋转蒸发器 上海亚荣生化仪器厂;KQ-118型数控超声波清洗器 昆山市超声仪器有限公司;FA2004N型分析天平 上海精密科学股份有限公司;HH-S型恒温水浴锅 江苏省金坛市正基仪器有限公司。
1.2 实验方法
1.2.1 托盘根萃取物的制备 托盘根于50 ℃烘箱中干燥,粉碎,过60目筛备用,称取粗粉100 g,加入1000 mL水,浸泡12 h,加热回流提取2次,每次2 h,过滤提取液,合并滤液,浓缩得水提液500 mL,加入95%乙醇至含醇量为80%,室温放置12 h,抽滤,上清液减压浓缩至无醇味,得托盘根水提物。依次用氯仿、乙酸乙酯、水、饱和正丁醇萃取两次,各萃取层减压浓缩干燥后分别得萃取物,即氯仿萃取物(90.9 mg),乙酸乙酯萃取物(323.6 mg),正丁醇萃取物(281.6 mg)及水萃取物(2548 mg)[16]。
1.2.2 总黄酮测定 精密称取60 ℃干燥至质量恒定的芦丁对照品10.3 mg,置于50 mL容量瓶中,加入80%乙醇溶解,并用80%乙醇溶液定容至刻度,制得芦丁对照品溶液(0.206 mg/mL)。精密吸取上述芦丁对照品溶液0.5、1.0、1.5、2.0、2.5、3.0、4.0 mL分别置于10 mL容量瓶中,加入5% NaNO2溶液0.3 mL,摇匀,放置6 min,加入10% Al(NO3)3溶液0.3 mL,摇匀,放置6 min,加入4% NaOH溶液4.0 mL,加入80%乙醇溶液定容至刻度,摇匀,放置15 min。以80%乙醇溶液为空白对照,于紫外分光光度计505 nm波长处测定不同浓度芦丁对照品溶液的吸光度A[17],以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程为:A=13.07c-0.0075,R2=0.9993,其中:A为吸光度,c为黄酮质量浓度(mg/mL)。
取托盘根不同溶剂萃取物,加无水乙醇溶解配制成0.5 mg/mL的样品溶液,按照上述方法测定样品溶液的吸光度,平行测定3次,计算平均值,根据回归方程计算总黄酮的浓度。
1.2.3 总皂苷测定 精密称取60 ℃干燥至质量恒定的齐墩果酸对照品2.0 mg,置于10 mL容量瓶中,加入无水甲醇溶解,并用甲醇定容至刻度,制得齐墩果酸对照品溶液(0.2 mg/mL)。精密吸取上述齐墩果酸对照品溶液0.4、0.6、0.8、1.0、1.2、1.4 mL,分别置于10 mL容量瓶中,与70 ℃水浴上挥发除去溶剂,加入5%香兰素-冰乙酸2 mL,70%硫酸溶液5 mL,60 ℃水浴加热20 min,流水冷却10 min,摇匀,以无水甲醇为空白对照,于紫外分光光度计544 nm波长处测定不同浓度齐墩果酸对照品溶液的吸光度A[18],以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程为:A=0.04435c-0.1968,R2=0.9997,其中:A为吸光度,c为皂苷质量浓度(mg/mL)。
取托盘根不同溶剂萃取物,加无水乙醇溶解配制成0.5 mg/mL的样品溶液,按照上述标准曲线绘制方法测定样品溶液的吸光度,平行测定3次,计算平均值,根据回归方程计算总皂苷的浓度。
1.2.4 总酚酸测定方法 精密称取60 ℃干燥至质量恒定的没食子酸对照品2.0 mg,置于10 mL容量瓶中,加入无水甲醇溶液,超声使之溶解,并用无水甲醇溶液定容至刻度,制得没食子酸对照品溶液(0.2 mg/mL)。精密吸取没食子酸对照品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL,分别置于10 mL容量瓶中,加无水甲醇至2 mL,加0.3%十二烷基硫酸钠2 mL及0.6%三氯化铁-0.9%铁氰化钾(1∶0.9)混合溶液1 mL,混匀,在暗处放置5 min,加0.1 mol/L HCl至刻度,混匀,在暗处放置20 min,以无水甲醇为空白对照,于紫外分光光度计720 nm波长处测定不同浓度没食子酸对照品溶液的吸光度A[17],以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程为A=0.0408c-0.0015,R2=0.9998,其中:A为吸光度,c为皂苷质量浓度(mg/mL)。
取托盘根不同溶剂萃取物,加无水乙醇溶解配制成0.5 mg/mL的样品溶液,按照上述总酚酸方法测定样品溶液的吸光度,平行测定3次,计算平均值,根据回归方程计算总酚酸的浓度。
1.2.5 DPPH自由基清除能力测定 DPPH自由基清除能力测定参考文献方法[19]并稍作修改,DPPH用无水甲醇溶解配制成0.16 mmol/L甲醇溶液。取浓度为0.2、0.1、0.05、0.025 mg/mL的各样品溶液和浓度为0.02、0.01、0.005、0.0025 mg/mL的VC溶液(阳性对照)100 μL加入96孔板中,并加入100 μL的DPPH测定液,空白用甲醇代替样品溶液,室温避光放置30 min。于波长517 nm下测定吸光度。每份样品平行操作三次。计算公式见式(1):
清除率(%)=[A空白-A样品]/A空白×100
式(1)
式中:A空白为空白样品的吸光度,A样品为测试样品的吸光度。
提取物的半数抑制率用IC50值表示。
1.2.6 ABTS自由基清除能力测定 清除ABTS自由基清除能力的测定是参照文献[20]方法,并稍作修改。将5 mL 7 mmol/L ABTS和88 μL 140 mmol/L的过硫酸钾(终浓度)混合,在室温避光条件下静止过夜,将生成的ABTS+工作液用水稀释20~40倍,使其在734 nm波长下的吸光度为0.7±0.02,即得到ABTS+工作液。取浓度为0.2、0.1、0.05、0.025 mg/mL的各样品溶液和浓度为0.02、0.01、0.005、0.0025 mg/mL的VC溶液(阳性对照)10 μL加入96孔板,并加入190 μL的ABTS+·工作液,空白用甲醇代替样品溶液。室温避光放置6 min,于波长734 nm下测定其吸光度。每份样品平行操作3次。计算公式见式(2):
清除率(%)=[A空白-A样品]/A空白×100
式(2)
式中:A空白为空白样品的吸光度,A样品为测试样品的吸光度。
提取物半数抑制浓度用IC50值表示。
1.2.7 超氧阴离子自由基清除能力测定 超氧阴离子自由基清除能力的测定参照文献[16]的方法,并稍作修改。取200 μL 50 mmol/L pH=8.2的Tris-HCl缓冲溶液,20 μL不同浓度(0.2、0.1、0.05、0.025 mg/mL)托盘根萃取物样品和20 μL蒸馏水(空白对照),25 ℃反应20 min。继续加入20 μL 25 mmol/L邻苯三酚溶液,充分振荡后,在酶标仪中于325 nm处测定0~4 min内每30 s的吸光度,进行线性回归分析,求其斜率得到邻苯三酚的自氧化率。不同浓度(0.16、0.08、0.04、0.02、0.01 mg/mL)的VC溶液作为阳性对照。其清除率按照式(3)计算:
清除率(%)=[A1-A2]/A1×100
式(3)
式中:A1为邻苯三酚自氧化率;A2为加入样品的邻苯三酚自氧化率。
提取物的半数抑制率用IC50值表示。
1.3 数据处理
2 结果与分析
2.1 托盘根各提取物中总黄酮、总皂苷和总酚酸的含量
如表1所示,各提取物中有机溶剂萃取物的总黄酮含量明显高于水提物和水萃取物(p<0.05),其中正丁醇萃取物中总黄酮含量为5.06%(以生药材计),高于乙酸乙酯萃取物和氯仿萃取物,与氯仿萃取物之间存在显著性差异(p<0.05)。各提取物中正丁醇萃取物的总皂苷含量最高,以生药材计其含量为7.41%,其次为氯仿提取物,含量为6.29%,乙酸乙酯萃取物中总皂苷含量显著低于正丁醇和氯仿萃取物(p<0.05),是由于三萜和甾体皂苷元易溶解于氯仿中,与糖结合成苷后极性明显增加,在正丁醇中的溶解度增大,而皂苷元和皂苷在乙酸乙酯中的溶解度低于氯仿和正丁醇,因而氯仿萃取物和正丁醇萃取物中的总皂苷含量高于乙酸乙酯萃取物。正丁醇萃取物中总酚酸的含量为6.18%,显著高于氯仿萃取物和乙酸乙酯萃取物(p<0.05),而水提物和水萃取物中总酚酸的含量最低。
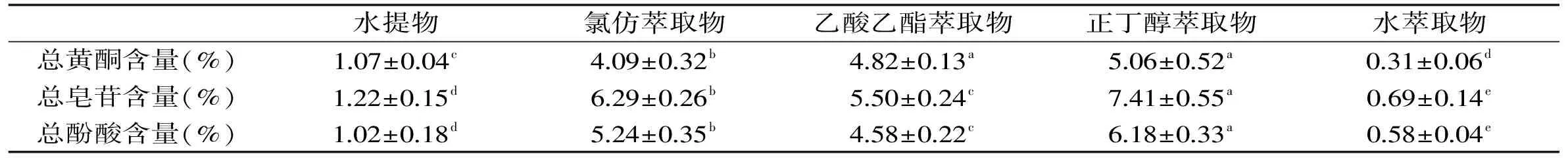
表1 托盘根不同提取物中总黄酮、总皂苷和总酚酸的含量Table 1 The total flavonoids,total saponins and total phenolic acid contents of different extract from Rubus crategefolius Bunge.
2.2 托盘根各提取物DPPH自由基清除能力
由图1可知,托盘根各提取物对DPPH自由基的清除率范围为5.20%~89.36%,各提取物对DPPH的清除能力均呈现浓度依赖关系。其中清除率最强的为0.2 mg/mL的乙酸乙酯层萃取物(IC50=94.64 μg/mL),最弱的为0.025 mg/mL的水萃取物。相同浓度的样品中,以乙酸乙酯萃取物对DPPH自由基的清除率最强,水萃取物最低。正丁醇萃取物和氯仿层萃取物比乙酸乙酯层萃取物的清除率略低,不存在显著差异(p>0.05);水提液和水萃取物的对DPPH自由基的清除率相近,显著低于乙酸乙酯萃取物、正丁醇萃取物和氯仿萃取物(p<0.05)。此结果表明,不同极性有机溶剂萃取得到的托盘根萃取物中有效成分存在较大差异,如乙酸乙酯和正丁醇萃取物中总黄酮含量高于其他提取物,而黄酮类成分的抗氧化活性较强,与萃取物中总黄酮含量的顺序基本相同,说明有机溶剂有利于黄酮类物质的提取。
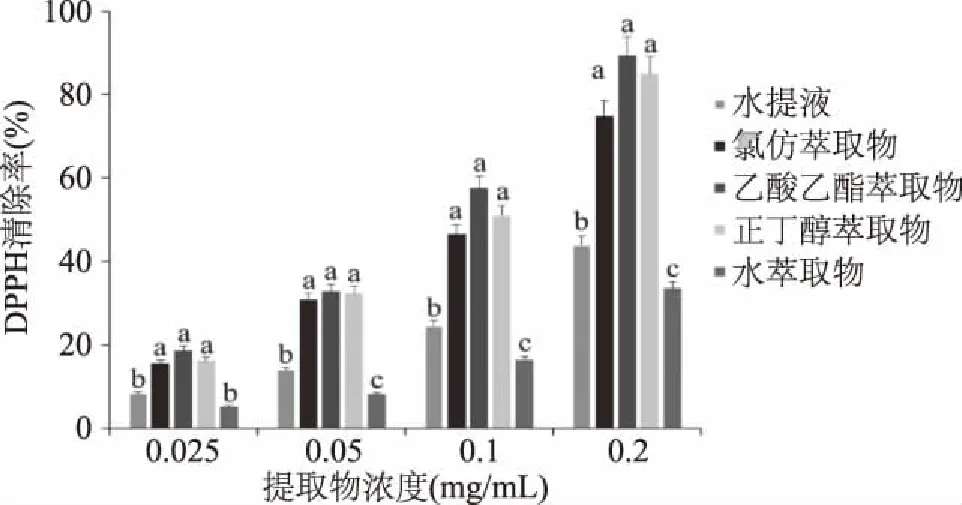
图1 托盘根不同提取物DPPH自由基清除能力Fig.1 DPPH scavenging activity of different extracts from Rubus crategefolius Bunge.注:同一浓度下不同小写字母表示差异显著(p<0.05);图2、图3同。
由表2可知,各提取物对DPPH自由基的清除能力大小:乙酸乙酯层萃取物>正丁醇层萃取物>氯仿层萃取物>水萃取物。由实验得阳性对照VC对DPPH清除作用的IC50为6.25 μg/mL,各提取物对DPPH的清除能力均低于阳性对照VC。

表2 DPPH自由基清除率IC50值Table 2 The IC50 values of DPPH scavenging activity
2.5 ABTS自由基清除能力
由图2可知,托盘根各提取物对ABTS自由基的清除率范围为4.55%~73.86%,且各提取物对ABTS的清除能力随浓度的增加而增大。其中清除率最强的为0.2 mg/mL的正丁醇萃取物(IC50=66.43 μg/mL),最弱的为0.025 mg/mL的水提液。相同浓度的供试品溶液中,以正丁醇萃取物对ABTS自由基的清除率最强,水提物最低。乙酸乙酯萃取物和氯仿萃取物比正丁醇萃取物清除率略低,不存在显著差异(p>0.05);水提物和水萃取物对ABTS自由基的清除率相近,但显著低于乙酸乙酯萃取物、正丁醇萃取物、氯仿萃取物(p<0.05)。与清除DPPH能力结果相似,总黄酮、总皂苷和总酚酸在有机溶剂萃取中的含量明显高于水提物和水萃取物,进一步说明,托盘根中的抗氧化活性成分包括总黄酮、总皂苷和总酚酸。
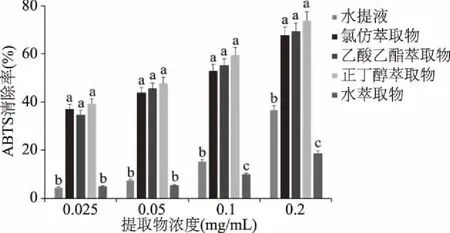
图2 托盘根不同提取物ABTS自由基清除能力Fig.2 ABTS scavenging activity of different extracts from Rubus crategefolius Bunge.
由表3可知各萃取层对ABTS自由基的清除能力大小:正丁醇层提取物>乙酸乙酯层提取物>氯仿层提取物>水萃取物。且各提取物对ABTS自由基的清除能力均低于阳性对照VC(IC50:17.55 μg/mL)。

表3 ABTS自由基清除率IC50值Table 3 The IC50 values of ABTS scavenging activity
2.6 超氧阴离子自由基清除能力
由图3可知,托盘根各提取物对超氧阴离子自由基的清除率范围为2.58%~81.23%,其中清除率最强的为0.2 mg/mL的乙酸乙酯层萃取物(IC50=50 μg/mL),最弱的为0.025 mg/mL的水提液。相同浓度的供试品溶液中,以乙酸乙酯萃取物对超氧阴离子自由基的清除率最强,水提液最低。正丁醇萃取物和氯仿萃取物比乙酸乙酯萃取物清除率低,差异显著(p<0.05);水提液和水萃取物的供试品溶液对超氧阴离子自由基的清除率相近,但显著低于乙酸乙酯萃取物、正丁醇萃取物和氯仿萃取物(p<0.05)。

图3 托盘根不同提取物超氧阴离子自由基清除能力Fig.3 Superoxide radical scavenging activity of different extracts from Rubus crategefolius Bunge.
由表4可知各提取物对超氧阴离子自由基的清除能力大小:乙酸乙酯层萃取物>正丁醇层萃取物>氯仿层萃取物>水萃取物。且乙酸乙酯提取物对超氧阴离子自由基的清除能力高于阳性对照VC(IC50:90 μg/mL),其他提取物的超氧阴离子清除能力低于VC。

表4 超氧阴离子自由基清除率IC50值Table 4 The IC50 values of superoxide radical scavenging activity
3 结论
本研究对托盘根水提液不同溶剂萃取物中总黄酮、总皂苷和总酚酸含量进行了测定及比较,结果表明托盘根氯仿、乙酸乙酯和正丁醇萃取物中均含有黄酮、皂苷及酚酸类成分,且明显高于水提液和水萃取物,其中正丁醇萃取物中各成分含量最高。通过DPPH、ABTS、超氧阴离子清除实验等体外抗氧化评价体系,评价了托盘根各提取物的体外抗氧化能力,各有机溶剂萃取物均表现出较强的体外抗氧化能力,而其中乙酸乙酯萃取物的抗氧化能力最高。本研究结果表明,托盘根中含有黄酮、皂苷和酚酸等生物活性成分,且具有明显的抗氧化活性,为进一步开发托盘根成为天然抗氧化剂或健康食品提供了理论基础。

