乳腺癌中Wnt/β-catenin信号通路相关蛋白的表达及意义
张团结, 任 敏
(安徽省医科大学第一附属医院普外科乳腺外科, 安徽 合肥 230022)
乳腺癌是我国女性最为常见的恶性肿瘤之一,近年来,其发病率和病死率逐渐呈年轻化和上升的趋势[1]。很多乳腺癌患者在初诊时就已经发生大量的淋巴结转移,同时相当一部分乳腺癌具有较高的侵袭性;从乳腺癌致死的众多临床病例观察来看,乳腺癌患者并非死于原位肿瘤,而是死于恶性肿瘤的远端转移[2-4];而乳腺癌的发生、发展、转移和侵袭是由多个基因和多条信号通路相互作用、相互协调参与的复杂生理过程[5],因此,对乳腺癌的发病机制及早期诊断研究具有重要意义。研究发现经典的Wnt/β-catenin信号通路与肿瘤信号转导调控有关[6-7]。Wnt/β-catenin信号通路密切参与调节结直肠癌、前列腺癌和卵巢癌等肿瘤的发生、发展,主要作用是促进肿瘤细胞的增值、分化和转移[8],但有关Wnt/β-catenin信号通路在乳腺癌发病机制中的研究较少。有研究发现在乳腺癌MCF-7细胞系中,Wnt1反义RNA可以诱导凋亡并引起下游蛋白表达水平的变化,在Wnt1转基因小鼠肿瘤模型中,Wnt1信号的减弱导致小鼠乳腺癌肿瘤消退及肺脏转移延迟[9]。肿瘤细胞在细胞浆和细胞核内的β-catenin异常积聚最常见,是恶性肿瘤中的普遍事件,在结、直肠腺瘤及结、直肠癌中均发现β-catenin的异常表达,已证明其与肿瘤发生密切相关[10]。因此,本研究将选取我院于2015年1月~2017年1月间收治的150例乳腺癌患者和乳腺癌MCF-7细胞作为研究对象,检测乳腺癌组织和细胞中Wnt/β-catenin信号通路相关蛋白Wnt-1和β-catenin的表达,为今后通过阻断Wnt/β-catenin信号通路为措施的乳腺癌靶向治疗提供了有效的实验依据。
资 料 和 方 法
1 临床资料
选取2015年1月~2017年1月间我院收治的150例乳腺癌患者作为研究对象,纳入标准为:(1)临床病理检查证实为乳腺癌;(2)患者均未经任何药物治疗。排除标准为:(1)合并慢性感染性疾病,恶性肿瘤病史者;(2)心、肺、肝或肾功能严重损伤或障碍患者;(3)合并心理精神疾病或不能积极配合治疗的患者。150例乳腺癌的肿瘤组织样本来源于手术切除的临床病理资料保存完整的乳腺癌石蜡切块;非肿瘤组织样本取自相应的临近0.5~1 cm乳腺肿瘤组织的癌旁组织。本研究通过我院伦理委员会审核,所有患者在治疗前均知情同意并签署同意书。
2 仪器和试剂
二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma;高糖DMEM培养基、胎牛血清和胰蛋白酶均购自Gibco;抗Wnt-1和 β-catenin抗体、Wnt/β-catenin信号通路激动剂Wnt3a和拮抗剂DKK1均购自Abcam; II 抗购自碧云天公司;免疫组化检测试剂盒购自南京建成生物工程研究所;TRIzol试剂盒、逆转录试剂盒和PCR扩增试剂盒均购于TaRaKa。高速冷冻离心机(TGL-16G-A型)购于上海安亭科学仪器厂;实时荧光定量PCR仪(7300型)购于Applied Biosystems;基础电泳仪(Bio1645050)购于Bio-Rad; 电子天平(EL204)购于上海特勒-托多利多仪器有限公司。
3 实验方法
3.1细胞培养 乳腺癌细胞株MCF-7购自中科院上海细胞库。MCF-7细胞培养于高糖DMEM完全培养液中(含 10% 胎牛血清、 100 U/mL青霉素和100 mg/L链霉素),置于 5% CO2、 37 ℃条件下的培养箱中进行细胞培养,隔天进行换液。
3.2Real-time PCR检测乳腺癌患者肿瘤组织和MCF-7细胞中Wnt-1和β-catenin的mRNA表达水平 根据TRIzol法提取乳腺癌组织总RNA,对RNA纯度和浓度使用核酸测定仪进行测定,取1 μg RNA逆转录成cDNA并进行定量检测,Wnt-1、β-catenin及GAPDH(内参照)的扩增条件及计算方法参考文献[8]。Wnt-1的上游引物序列为5’-CTGCAGAGCATGGACTCGTC-3’, 下游引物序列为5’-CCGTTGAAGAGAGTGGAGTG-3’; β-catenin的上游引物序列为5’-TACTCACGCCTCGAAACCT-3’, 下游引物序列为5’-GTCTGCTTTCCTCCCTGATG-3’; GAPDH的上游引物序列为5’-CCTAGTTCGTCATGGGTGTGAACCA-3,下游引物序列为5’-GCCAGTAGAGGCAGGGATGATGTTC-3。
用含10%胎生血清的DMEM培养基培养MCF-7乳腺癌细胞。取处于对数生长期的细胞(5×106/L)接种于6孔板,37 ℃、5% CO2培养箱中培养。实验分组:(1)阴性对照(control)组:乳腺癌MCF-7细胞+DMEM高糖完全培养液(含10% FBS);(2)激动剂(agonist)组:乳腺癌MCF-7细胞+Wnt3a(1 mg/L);(3)拮抗剂(antagonist)组:乳腺癌MCF-7细胞+DKK1 (16 μmol/L)。Real-time PCR检测乳腺癌MCF-7细胞中Wnt-1和β-catenin的mRNA表达水平,具体引物设计以及实验操作同上。
3.3Western blot检测乳腺癌组织和细胞中Wnt-1和β-catenin蛋白的表达水平 常规方法提取乳腺癌组织的总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)方法测定蛋白浓度和含量后确保每孔上样量为20 μg,进行SDS-PAGE并转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)薄膜,脱脂奶(3%)封闭条带2 h,分别4 ℃过夜孵育 I 抗,隔天用TBST洗膜,孵育 II 抗后用显色液显色。采用Quantity One软件对条带亮度进行分析。MCF-7细胞Wnt-1和β-catenin的蛋白表达水平检测方法大致相同。
3.4免疫组化检测乳腺癌组织Wnt-1和β-catenin蛋白的表达水平 采用常规石蜡包埋方法制备石蜡切片(每张5 μm),进行免疫组织化学染色,在pH 6.0柠檬酸盐缓冲液(10 mmol/L)中介导抗原复性,进行热激持续30 min,分别采用抗Wnt-1和β-catenin单克隆抗体进行切片组织孵育,4 ℃过夜。PBS洗涤后,孵育 II 抗并显色曝光。
4 统计学分析
统计分析实验数据采用SPSS 17.0软件。两组间计量资料使用t检验进行比较;多组间计量资料使用方差分析进行比较,组间计数资料采用卡方检验分析进行比较。以P<0.05表示差异有统计学意义。
结 果
1 乳腺癌患者肿瘤组织Wnt-1和β-catenin的表达水平结果
乳肿瘤组织Wnt-1和β-catenin mRNA和蛋白表达量均高于癌旁组织(P<0.05),见图1。
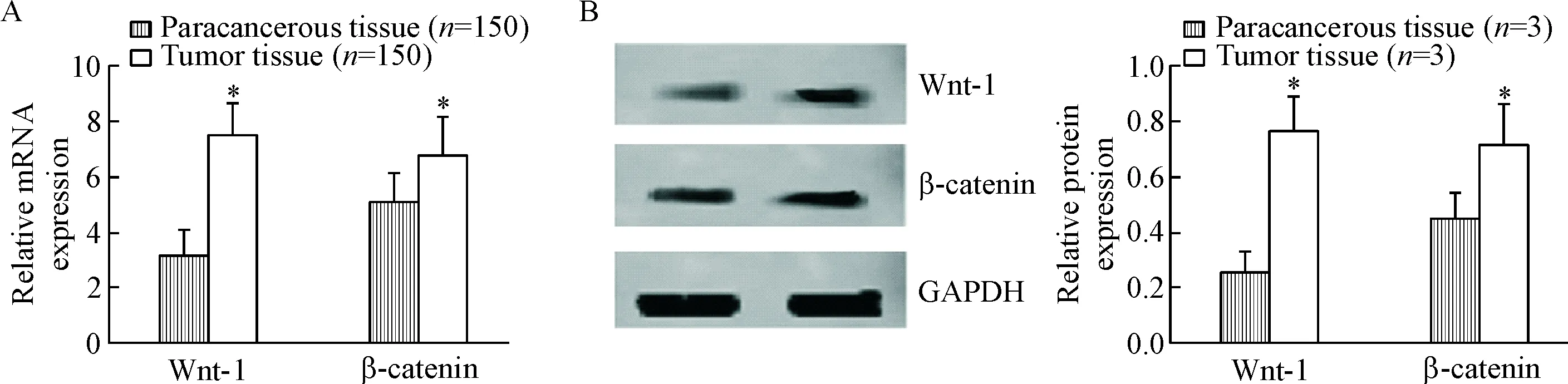
Figure 1.The expression of Wnt-1 and β-catenin at mRNA (A) and protein (B) levels detected by real-time PCR and Western blot. Mean±SD. *P<0.05 vs paracancerous tissue.
2 Wnt-1和β-catenin表达与乳腺癌患者临床病理学特征关系的分析
乳腺癌患者肿瘤组织Wnt-1阳性率26.00%(39/150)高于癌旁组织Wnt-1阳性率8.67%(13/150)(P<0.05);乳腺癌患者肿瘤组织β-catenin阳性率24.67%(37/150)高于癌旁组织β-catenin阳性率8.00%(12/150)(P<0.05)。统计分析证实,Wnt-1表达与乳腺癌患者肿瘤转移、肿瘤分期及肿瘤直径密切相关(P<0.05);β-catenin表达与乳腺癌患者肿瘤转移和肿瘤分期密切相关(P<0.05),见表1。

表1 乳腺癌患者Wnt-1和β-catenin表达与患者临床病理学特征关系分析
3 乳腺癌MCF-7细胞Wnt-1和β-catenin的表达水平
与NC组相比,激动剂组Wnt-1和β-catenin的mRNA和蛋白表达量升高(P<0.05);与control组相比,拮抗剂组Wnt-1和β-catenin的mRNA和蛋白表达量降低(P<0.05),见图2。

Figure 2.The expression of Wnt-1 and β-catenin detected by real-time PCR (A) and Western blot (B). Mean±SD. n= 3.*P<0.05 vs control group.
讨 论
本文旨在探讨乳腺癌组织和细胞中Wnt/β-catenin信号通路中Wnt-1和β-catenin表达情况及其监测的临床意义。Jang等[11]研究发现乳腺癌干细胞中Wnt/β-catenin信号水平要高于实质肿瘤细胞,通过抑制该信号通路可阻止乳腺癌干细胞和实质肿瘤细胞的生长,如视黄酸受体应答蛋白3[12],干扰巢蛋白的表达[13],可抑制Wnt/β-catenin信号通路,证明Wnt/β-catenin通路的活化状态与乳腺癌干细胞的异常分化程度呈正相关。Choi等[14]实验证实抑制乳腺癌的小鼠模型中Wnt1的表达可减少肿瘤干细胞的富集。而β-catenin蛋白是一种多功能的细胞浆蛋白质,在疾病状态下,由于体内环境的变化,游离的β-catenin蛋白进入细胞核,参与调节相关基因的表达。另外,乳腺癌组织中存在着异常Wnt通路,β-catenin在乳腺癌中异常表达,且β-catenin的异常表达与腋窝淋巴结转移有关。在超过60%的乳腺癌癌细胞的核和/或胞浆观察到β-catenin的积累,并与预后不良相关[15-16]。
本研究首先通过对乳腺癌组织中Wnt-1和β-catenin的mRNA表达水平蛋白的表达水平进行测定。实验结果显示,乳腺癌患者肿瘤组织中Wnt-1和β-catenin mRNA和蛋白表达量高于癌旁组织,说明了蛋白与基因水平的一致性。与各种肿瘤相关的β-catenin复合物和下游信号分子组分的其它突变常常导致β-catenin的相似异常稳定和WNT靶基因在没有刺激的情况下的不适当表达[17]。这与本研究中癌组织β-catenin和Wnt-1表达量高于癌旁和正常组织的结果一致。我们更进一步分析了Wnt-1和β-catenin表达与乳腺癌患者临床病理学特征关系。实验结果显示,乳腺癌患者肿瘤组织中Wnt-1阳性率和β-catenin阳性率高于癌旁组织Wnt-1阳性率和β-catenin阳性率,上述2种实验结果揭示乳腺癌与Wnt/β-catenin信号通路的正相关性。有研究显示β-catenin可负向调节IRF3向细胞核的转运,从而抑制细胞的先天免疫反应[20]。本研究还在细胞水平通过Wnt/β-catenin信号通路激动剂Wnt3a和拮抗剂DKK1细胞实验,从正面和反面表明乳腺癌细胞中Wnt-1和β-catenin在Wnt/β-catenin信号通路中呈过表达状态。这暗示了乳腺癌细胞中的先天免疫系统受到β-catenin过表达的抑制,这可能是肿瘤的发生和发展的重要因素。除此之外,β-catenin蛋白的不断积累提示,可能包括Wnt升高对Wnt/β-catenin信号通路以及β-catenin降解障碍导致胞浆内游离的β-catenin聚集并与TCF/LEF结合进入细胞核内,启动下游基因转录,诱发Wnt/β-catenin信号通路的异常改变。
综上所述,深入解析Wnt/β-catenin信号通路可对乳腺癌发生机制和侵袭转移过程,有利于为今后通过阻断Wnt/β-catenin信号通路上相关靶点蛋白以治疗乳腺癌提供实验依据。

