脐带间充质干细胞移植治疗子宫切口瘢痕缺陷大鼠的疗效观察*
罗惠娟, 王 宁, 周 娟, 汤小湄, 陈宇毅, 罗文斌, 肖小敏△
(1暨南大学附属第一医院产科, 广东 广州 510632; 2深圳市第二人民医院产科, 广东 深圳 518035)
我国是全球剖宫产率最高的国家之一,剖宫产率从上世纪70年代的5%增长到2007~2008年的46.2%,不少地区甚至超过60%[1]。2014年全国剖宫产率已高达54%[2]。剖宫产相关的并发症也增加,其中子宫切口瘢痕缺陷(previous cesarean scar defect,PCSD)是剖宫产术后,子宫下段由于切口部位血肿或感染导致愈合不良,切口肌层薄弱而形成的凹陷,发病率为20%~60%[3],宫腔镜诊断的发生率可高达75%[4]。目前对于PCSD的治疗主要为手术:包括宫腹腔镜联合手术、经阴道手术和开腹手术,成功的概率约60%~87%[5-6]。虽然手术治疗提高了再次妊娠的机会,并减少了妊娠的风险,但需要2年的恢复期才能再次妊娠。随着二胎政策的开放,许多高龄的PCSD妇女有尽早妊娠的强烈要求,也有许多PCSD患者不能接受有创修复手术。本研究利用干细胞的多向分化潜能尝试修复PCSD模型大鼠,为PCSD患者寻找一种无创、高效的治疗方法提供实验依据。
材 料 和 方 法
1 实验动物和细胞
SPF级SD雌性大鼠60只, 6~8周龄,体重(180±220) g,SD雄性大鼠15只, 8~10周龄,体重(230±260) g,由广州中医药大学动物实验中心提供,合格证号为44005800003952。
脐带华通胶间充质干细胞(Wharton jelly-derived mesenchymal stem cells,WJMSCs)购于Cyagen。收到细胞后立即复苏,置于37 ℃、5% CO2的恒温培养箱,以1∶3比例进行传代培养,每3 d传代 1次,使用当天用生理盐水稀释至1×109/L待用。
2 实验方法
2.1PCSD大鼠制模方法 通过预实验确定子宫肌壁注射脂多糖(lipopolysaccharide,LPS; 1 g/L,1 mL/kg)联合电频离子治疗仪电凝子宫切口两侧(功率为10 W),3-0可吸收线间断缝合子宫切口,可以达到较高PCSD模型SD大鼠成功率(80%)。
2.2实验动物的分组和处理 雌雄鼠2∶1同笼,阴道拭子见精子即标记为妊娠第0天,1只未成功妊娠,余59只孕鼠随机分3组,分别为正常手术(normal operation,N-O)组11只,模型组48只,所有孕鼠均在孕第19天进行剖宫产。N-O组:子宫系膜对侧缘从宫角至宫颈纵剖双侧子宫,取出鼠仔和胎盘,3-0可吸收线连续缝合子宫切口,逐层关腹。模型组:行剖宫产后切口两侧肌壁注射LPS,同时用电频离子治疗仪电凝子宫切口两侧,缝合及关腹同上。N-O组术后大鼠无死亡,模型组术后8 只大鼠24 h内死亡,存活40只,考虑为LPS导致败血症。随机剔除N-O组1只,最终进行实验的N-O组10只,模型组随机分模型对照(model control,M-C)组20只和模型治疗(model treatment,M-T)组20只。其中M-T组又随机分成A、B组(n=10),建模后第4周开始移植WJMSCs。A组尾静脉注射0.5 mL+宫腔插管灌注 0.5 mL的1×109/L WJMSCs,每周1次,共3次;B组为单纯宫腔插管灌注1 mL的1×109/L WJMSCs悬液,每周1次,共3次。M-C组亦随机分成A、B组(n=10),术后第4周开始用生理盐水替代WJMSCs进行治疗。A组予尾静脉注射0.5 mL+宫腔插管灌注0.5 mL的生理盐水,每周1次,共3次;B组宫腔插管灌注1 mL的生理盐水,每周1次,共3次,取标本同上。N-O组剖宫产后,常规饲养。于模型组相对应的时间取材,即模型组治疗结束后 1和4周,分别随机处死6和4只大鼠,取双侧子宫标本备检。
2.3体视学分析 所有图像采用Leica QWin Plus 3计算机图像分析系统进行拍照和测试。每组10个双角子宫,共20个标本,每个标本随机选子宫上、中和下段组织1块进行石蜡包埋,固定包埋方向,保证每个切面都包括完整的子宫横断面。标本块连续切片,再随机选片染色备检:(1)Masson染色:光镜下可见蓝色胶原纤维和红色肌纤维,胞核黑蓝色。找到瘢痕区域,放大100倍拍照,计算子宫肌层的胶原纤维体积密度(Vv)。(2)细胞角蛋白(cytokeratin,CK)免疫组化染色:可见子宫内膜上皮细胞和腺上皮细胞被染成棕黄色颗粒。100倍视野下拍照瘢痕区域,通过CK染色定位子宫内膜腺上皮,计算其表面积密度(Sv)、子宫内膜厚度(τ)和子宫内膜缺陷率。(3)肌动蛋白(actin)免疫组化染色:可见子宫肌层细胞被染成棕黄色颗粒。100倍视野下拍照,评估子宫肌层actin的Vv。
3 统计学处理
用SPSS 22.0统计软件进行分析。计量资料采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析;计数资料的统计推断采用卡方检验和Fisher确切概率法。以P<0.05为差异有统计学意义。
结 果
1 各组瘢痕区的HE染色观察
治疗后1周,N-O组可见子宫肌层稍薄,排列整齐,少量炎性细胞浸润。M-C组的A、B 2组相似,肌层变薄,严重者消失,大量炎性细胞浸润,间质增生、水肿,肉芽组织形成。M-T组的A组有少量炎性细胞浸润,肌纤维排列整齐,较M-C组明显增多;B组肌层较A组稍增厚,见较多的新生毛细血管。治疗后第4周,N-O组肌层较治疗后1周时稍增厚;M-C组和M-T组与治疗后1周时相似,见图1。
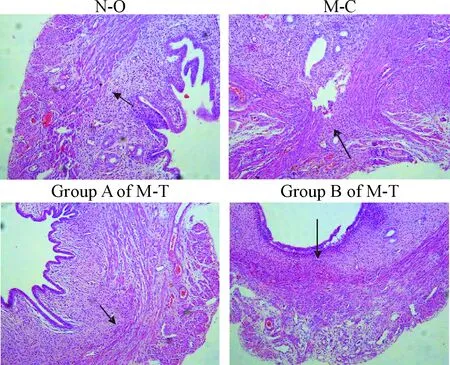
Figure 1.Observation of the scar regions in each group with HE staining (×100). ↑: the myometrium of the scar area.
2 瘢痕区的Masson染色观察
治疗后1周,N-O组的子宫肌层内含少量蓝色胶原纤维,大量的红色肌纤维,胶原纤维与肌纤维相间排列整齐。M-C 2组的Masson染色相似,肌层内含大量蓝色胶原纤维,肌纤维少见甚至消失。M-T 2组均可见胶原纤维较模型对照组明显减少,肌纤维增多,排列规则,且肌层恢复红色。治疗后4周,各组光镜下的表现与治疗后1周相似,见图2。
3 瘢痕区actin的免疫组化染色观察
治疗后1周,N-O组的子宫肌层内含有大量棕黄色颗粒的actin,呈条索状,排列整齐,与内膜分界清楚。M-C 2组的actin染色相似,肌动蛋白片状稀疏分布,排列不连续,与内膜分界不清楚。M-T 2组镜下与正常手术组相似。治疗后4周,各组与治疗后1周相似,见图3。

Figure 2.Observation of the scar areas in each group with Masson staining (×100). ↑: the scar area.

Figure 3.Observation of actin in the scar area with immunohistochemical staining (×100). ↑: the scar area.
4 瘢痕区CK的免疫组化染色观察
治疗后1周,N-O组子宫内膜呈单层柱状上皮细胞,排列整齐,形成皱襞,间质内见单管状腺体;M-C 2组CK染色相似,子宫内膜单层柱状上皮排列疏松,大片缺失,间质内含有单管状腺体;M-T 2组与N-O组相似。治疗后4周各组SD大鼠子宫CK免疫组化与治疗结束后1周时相似,见图4。
5 瘢痕区域的体视学比较
5.1N-O与M-C组子宫体视学比较 M-C组造模后 7和10周(相当于治疗结束后1和4周)的瘢痕区域肌层厚度和actin Vv较N-O组均显著减少(P<0.05),而M-C组的肌层胶原纤维Vv高于N-O组(P<0.05);2组子宫内膜厚度和内膜细胞Sv的差异无统计学显著性,M-C组内膜缺陷率第7和10周都显著高于N-O组(P<0.05)。N-O组术后第7和10周的各个指标同组自身比较,差异均无统计学显著性;M-C组术后第10周的肌层胶原纤维Vv低于术后第7周(P<0.05),显示建模是成功的,见表1、2。
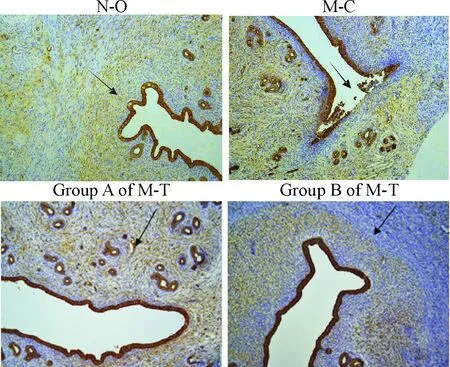
Figure 4.Observation of CK in the scar area with immunohistochemical staining (×100). ↑: the scar area.
5.2各组治疗后1周子宫肌层的体视学比较 M-C组肌层厚度和actin Vv均显著低于N-O和M-T各组(P<0.05);而M-C肌层胶原纤维Vv显著高于N-O组和M-T各组(P<0.05);M-T 2组与N-O组比较,肌层厚度和肌层actin Vv的差异均无统计学显著性;但M-T的B组肌层胶原纤维Vv低于N-O组(P<0.05);M-T 2组间比较,各项指标的差异均无统计学显著性,见表1。
5.3各组治疗后4周子宫肌层相关体视学比较 M-C组肌层厚度、肌层actin Vv均显著低于N-O组和M-T各组(P<0.05);而M-C肌层胶原纤维Vv仍显著高于N-O组和M-T各组(P<0.05);M-T各组与N-O组比较,肌层厚度、肌层actin Vv的差异均无统计学显著性,但M-T B组的肌层胶原纤维Vv低于N-O组(P<0.05)。M-T 2组间比较,各指标的差异均无统计学显著性,见表1。
5.4治疗后1、4周子宫肌层相关指标的体视学比较 M-C、N-O和M-T同组之间治疗后1和4 周的肌层厚度、肌层actin Vv和肌层胶原纤维Vv的差异均无统计学显著性。M-C组的肌层胶原纤维Vv,治疗后4周低于1周,差异有统计学意义(P<0.05);但它仍高于N-O组、M-T的A和B组,差异有统计学意义(P<0.05),见表1。
5.5各组子宫内膜相关指标的体视学比较 无论治疗后1还是4周,各组之间内膜厚度无显著差异,并且各组治疗后1、4周自身比较,差异均无统计学显著性。各组1周的内膜细胞Sv比较,差异无统计学显著性;但是M-C组和M-T的B组治疗后4周的内膜细胞Sv高于A组(P<0.05)。M-C治疗后1周的瘢痕区域内膜缺陷率显著高于N-O组(P<0.05),但与M-T组比较差异无统计学显著性;治疗4周后,M-C组的内膜缺陷率显著高于N-O组(P<0.05),但与M-T组比较差异无统计学显著性;每组治疗后1和4周的子宫内膜缺陷率自身比较,差异也无统计学显著性,见表2。
5.6非瘢痕区域各组各个指标的体视学比较 无论是治疗后1还是4周,各组之间的差异均无统计学显著性,见表3。

表1 治疗后第1和4周子宫肌层相关指标的体视学比较
*P<0.05vsN-O group;#P<0.05vs1 week.
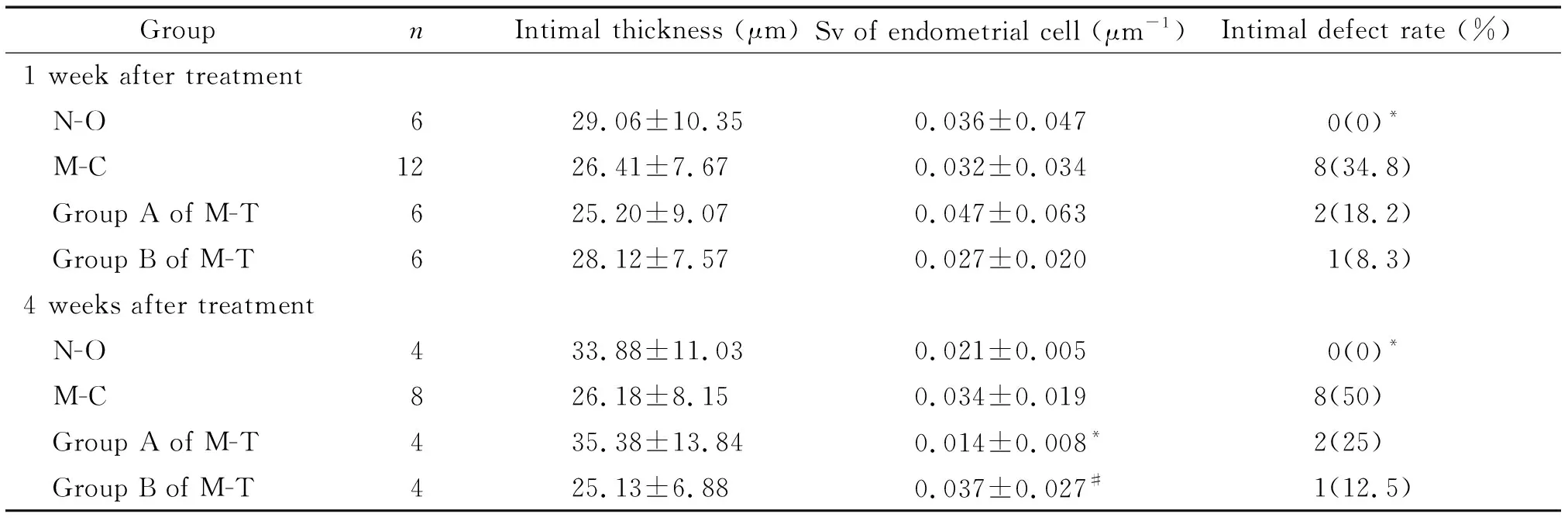
表2 各组瘢痕区子宫内膜相关指标的体视学比较
*P<0.05vsM-C group at the same time;#P<0.05vsgroup A of M-T at the same time.
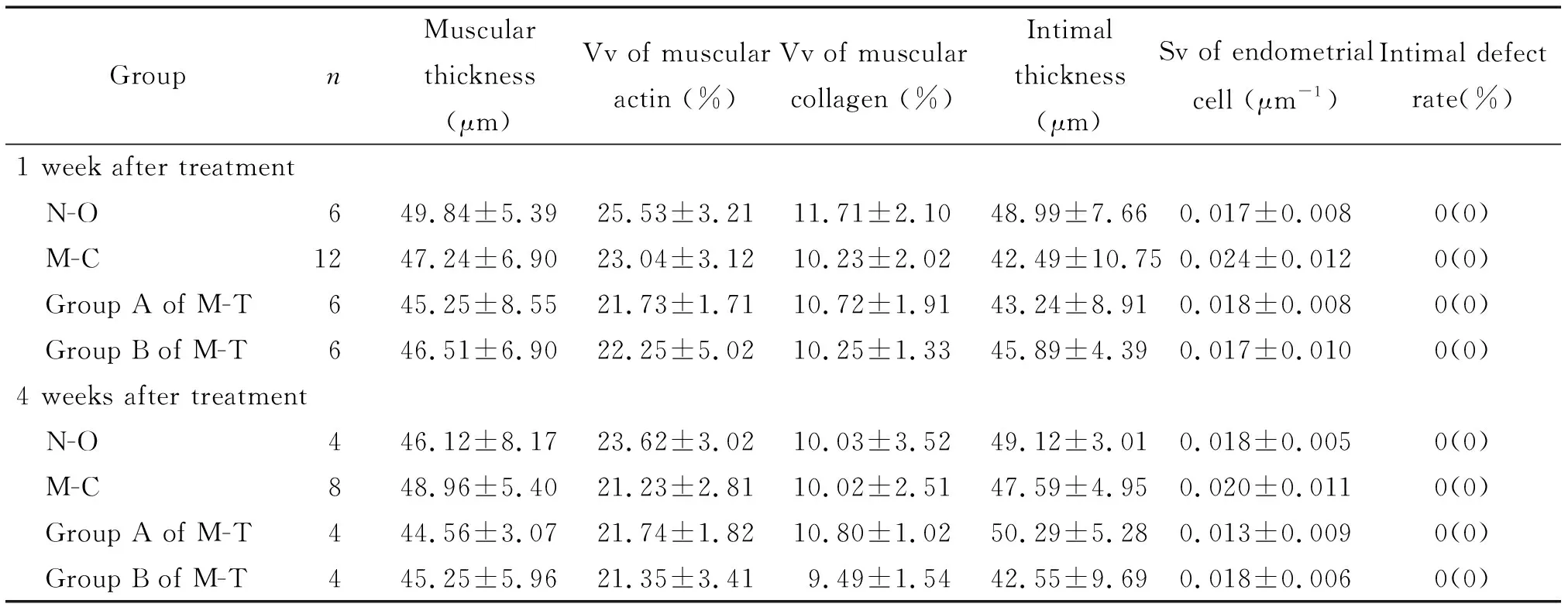
表3 非瘢痕区域各组各个指标的体视学比较
讨 论
近几十年剖宫产率的增加,PCSD作为一种比较常见的剖宫产远期并发症成为妇产科医师关注的焦点。PCSD患者再次妊娠发生早产和子宫破裂的风险高,如能找到一种简单、有效的修复和预防办法,无疑会降低再次妊娠的风险。
随着干细胞研究的深入,WJMSCs已被广泛应用于中枢神经系统、肝脏疾病、心血管疾病、移植物抗宿主病和自身免疫性疾病等各个领域。许多研究已提示MSCs具有分化为血管平滑肌细胞和输尿管平滑肌的潜力[7]。本课题组在既往的研究中发现,WJMSCs在输卵管等生殖器官的炎性损伤中有良好的治疗效果[8],但干细胞对于瘢痕子宫的修复能力,尚未见报道。目前监测瘢痕子宫愈合状态的三维超声方法存在形态和功能不符的明显缺陷。本研究通过子宫肌壁注射LPS联合电凝子宫切缘,建立了PCSD大鼠模型,可以达到高成功率的子宫肌层受损的目的,是一种有效的建模方法。通过观察子宫平滑肌、胶原纤维形态和子宫内膜缺损程度的改变,间接反映子宫肌层和内膜的功能,初步探索WJMSCs是否对PCSD大鼠有修复和预防作用。通过2种不同的移植方式把WJMSCs移植到PCSD大鼠体内,发现无论在治疗后1周还是4周,模型治疗组的肌层厚度和肌层actin Vv均显著高于模型对照组,可见,WJMSCs可以促进瘢痕区域子宫肌层结构和功能的修复,此修复作用可能与WJMSCs可向子宫平滑肌细胞分化有关。模型对照组肌层胶原纤维Vv高于正常手术组,治疗A和B组的肌层胶原纤维Vv显著低于模型对照组,可见PCSD大鼠经过WJMSCs 治疗,可以抑制瘢痕区域纤维化的发生。此结果与目前研究证明间充质干细胞可在许多疾病系统中发挥抗纤维化作用一致[9-11]。本研究结果也与文献报道的使用骨髓间充质干细胞移植可促进大鼠子宫单纯创伤后的再生修复作用相同[12-13]。2种不同的移植方式相比较,对PCSD大鼠的修复效果并无明显差别,考虑与WJMSCs的归巢作用有关[14]。这也为未来局部使用干细胞治疗提供思路,避免了全身使用干细胞治疗的一些风险。
细胞角蛋白是上皮细胞中的主要结构蛋白,作为细胞骨架对维持细胞或组织结构完整性发挥了重要的作用,在腺上皮内也有强的表达[15]。林娜成等[16]报道,子宫内膜损伤严重程度与子宫内膜厚度呈负相关。本研究结果显示,子宫内膜厚度和内膜的Sv,无论是否治疗,各组之间互相比较,还是同组不同时间的自身比较,均无显著差异;但从CK免疫组化实验可见,模型对照组的内膜的受损伤程度和内膜缺陷率明显较正常手术组和模型治疗组严重,但差异无统计学显著性,可见子宫内膜一旦受到损伤,比子宫肌层更难以修复,原因可能是内膜基底层血管受损,可能不利干细胞的定植和分化,导致子宫内膜重建需要时间较久甚至无法修复。文献报道干细胞在宫腔粘连的治疗中是一种非常有效的子宫内膜替代再生剂[17],结果与本实验结果不符,增加疗程和剂量对子宫内膜的修复是否有效还待进一步研究。
综上所述,对PCSD大鼠移植WJMSCs后,子宫肌层变厚,肌纤维明显增加,胶原纤维减少,内膜缺损情况好转,可见WJMSCs可促进PCSD大鼠子宫肌层结构和功能性的修复。静脉+局部联合治疗和单纯阴道治疗2种不同的移植方式,对子宫切口瘢痕缺陷大鼠的修复作用无明显区别。

