大鼠肾小管上皮细胞NRK-52E中VDR、PKC及其相互作用对NaDC1表达的影响*
朱晨曦, 李文洲, 郭永连, 陈 琳, 彭 松, 卫 丹
(华中科技大学同济医学院附属武汉市中心医院泌尿外科, 湖北 武汉 430014)
枸橼酸为人类尿中含量丰富的结石抑制物,主要在肾近端小管被钠离子依赖性二羧酸协同转运蛋白1(Na+/dicarboxylate cotransporter 1,NaDC1)介导转运重吸收[1]。NaDC1是一种酶调控参与的二羧酸跨膜转运载体蛋白,其表达上调时,枸橼酸的转运重吸收会增多,引起终尿里枸橼酸含量下降,最终导致低枸橼酸尿症[2]。因此探究NaDC1对低枸橼酸尿症发病的调控机制具有重要意义。
蛋白激酶C(protein kinase C,PKC)为细胞质激酶之一,维生素D受体(vitamin D receptor,VDR)是一种配体依赖性核转录因子,两者均在细胞的生长代谢及增殖分化等方面发挥重要作用。研究表明,PKC和VDR分别与二羧酸跨膜转运的酶调控与蛋白表达相关[3]。同时有研究证实,PKC与VDR表达调控间存在相互作用[4-5],但其相互作用对NaDC1表达的影响却鲜有报道。
本研究分别采用PKC激动剂(agonist)、PKC抑制剂(inhibitor)、VDR过表达载体及VDR-shRNA载体干预体外培养的大鼠肾小管上皮细胞NRE-52E,Western blot检测细胞内PKC、VDR和NaDC1的蛋白表达,并分析PKC、VDR及其相互作用对NaDC1蛋白表达的影响,为低枸橼酸尿症的临床治疗提供理论参考。
材 料 和 方 法
1 材料与试剂
大鼠肾小管上皮细胞NRK-52E购自中国科学院细胞库。DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco;PKC激动剂佛波醇12-豆蔻酸酯13-乙酸酯(phorbol 12-myristate 13-acetate, PMA)和PKC抑制剂Gö6983购自Sigma;VDR过表达载体质粒、VDR-shRNA载体质粒及空载体质粒购自武汉华联科生物科技有限公司; 抗PKC抗体、抗VDR抗体、抗NaDC1抗体和抗GAPDH抗体购自Abcam;RIPA裂解液、DAB试剂盒和Lipo6000转染试剂购自碧云天。
2 方法
2.1细胞培养 解冻复苏大鼠肾小管上皮细胞NRK-52E,培养条件为37 ℃、5% CO2,培养基为含10% FBS的DMEM培养基,每3~5 d 继代1次。
2.2Western blot实验 6孔板上每孔接种2 mL(2×105个)处于对数生长期的NRK-52E细胞,24 h 后弃去旧培养液,分为对照(control)组、PKC agonist组和PKC inhibitor组。Control组每孔加2 mL新鲜培养液,PKC agonist组每孔加2 mL含PKC激动剂PMA(终浓度为10 μmol/L)的新鲜培养液,PKC inhibitor组每孔加2 mL含PKC抑制剂Gö6983(终浓度为10 μmol/L)的新鲜培养液,继续培养6 h后收集细胞。用RIPA缓冲液提取总蛋白,SDS-PAGE后,以抗PKC(1∶800)、VDR(1∶800)、NaDC1(1∶800)和GAPDH(1∶1 000)抗体为 I 抗,4 ℃孵育过夜;洗膜,室温孵育II抗(1∶10 000)1 h,DAB显色,采用全自动化学发光仪曝光条带,Fluor Chem软件读取条带吸光度,以GAPDH为内参照做相对定量分析,每个实验均重复3次,取平均值。
2.3细胞转染与验证实验 VDR过表达载体质粒、VDR-shRNA载体质粒及空载体质粒均由武汉华联科生物科技有限公司构建并鉴定。NRK-52E细胞转染按Lipo6000产品说明书操作,阳性克隆筛选方法参照文献[6]进行。连续培养筛选后的细胞,确定空载体、VDR稳定过表达和VDR稳定干扰的NRK-52E细胞株,分别于对数生长期取上述3种细胞株各1瓶,6孔板上分为control组、VDR overexpression组和VDR interference组,分别接种2 mL (2×105个)空载体、VDR稳定过表达和VDR稳定干扰的NRK-52E细胞。培养24 h 后收集细胞,检测细胞中VDR蛋白表达(后续Western blot操作同2.2)。
2.4PKC激动剂/抑制剂联合VDR异常表达处理实验 分别于对数生长期取上述3种细胞株各1瓶,6孔板上分为control组、VDR interference组、VDR interference+PKC agonist组、VDR over-expression组、VDR over-expression+PKC inhibitor组。 Control组每孔接种2 mL (2×105个)空载体NRK-52E细胞;VDR interference组、VDR interference+PKC agonist组每孔接种2 mL (2×105个)VDR稳定干扰的NRK-52E细胞;VDR over-expression组、VDR over-expression+PKC inhibitor组每孔接种2 mL (2×105个)VDR稳定过表达的NRK-52E细胞。培养24 h 后弃去旧培养液,control组、VDR interference组和VDR over-expression组每孔加2 mL新鲜培养液,VDR interference+PKC agonist组每孔加2 mL含PKC激动剂PMA(终浓度为10 μmol/L)的新鲜培养液,VDR over-expression+PKC inhibitor组每孔加2 mL含PKC抑制剂Gö6983(终浓度为10 μmol/L)的新鲜培养液。继续培养6 h 后收集细胞,检测细胞中PKC和NaDC1的蛋白表达(后续Western blot操作同2.2)。
3 统计学处理
数据用SPSS 20.0软件进行处理,计量数据以均数±标准差(mean±SD)表示,组间差异采用单因素方差分析(one-way ANOVA)比较,以P<0.05为差异有统计学意义。
结 果
1 PKC活性对PKC、VDR和NaDC1蛋白表达的影响
与control组比较,PKC agonist组PKC表达量显著上调,PKC inhibitor组PKC表达量显著下降(P<0.05),表明PKC激动剂和PKC抑制剂分别促进和降低PKC蛋白表达。PKC agonist组VDR和NaDC1表达量显著上调(P<0.01),而PKC inhibitor组VDR表达量与control组相比差异没有统计学显著性,NaDC1的表达量显著下降(P<0.05),表明PKC活性增强时VDR和NaDC1的表达显著上调,PKC活性降低时对VDR的表达无影响,而NaDC1的表达显著下调,见图1。

Figure 1. The effects of PKC activity on the protein expression of PKC, VDR and NaDC1. Mean±SD. n=3. * P<0.05, ** P<0.01 vs control group.
2 VDR稳定过表达与稳定干扰NRK-52E细胞株的鉴定结果
VDR over-expression组和VDR interference组的VDR蛋白表达量分别较control组和空载体细胞组上调和下降(P<0.05),表明本研究成功建立稳定过表达VDR和 稳定敲减VDR表达的NRK-52E细胞株,效果良好,见图2。
3 PKC活性变化和VDR异常表达对PKC和NaDC1蛋白表达的影响
为进一步研究大鼠肾小管上皮细胞NRK-52E中PKC、VDR及其相互作用对NaDC1表达的影响,本实验分别给予PKC激活剂和PKC抑制剂处理VDR干扰表达及VDR过表达的NRK-52E细胞6 h,再检测干预前后PKC和NaDC1的蛋白表达情况。与control组比较,VDR interference组的PKC和NaDC1表达量均显著下降(P<0.05); VDR over-expression组的PKC和NaDC1表达量均显著上升(P<0.05),表明VDR过表达时PKC和NaDC1的表达显著上调,VDR表达减少时PKC和NaDC1的表达显著下降。给予PKC激活剂和PKC抑制剂分别干预VDR干扰表达及VDR过表达的大鼠肾小管上皮细胞后,VDR interference+PKC agonist组和VDR over-expression+PKC inhibitor组的PKC和NaDC1蛋白表达水平的差异均存在统计学显著性,且均显著高于control组和VDR interference组的表达量,并均显著低于VDR over-expression组的表达量,见图3。

Figure 2.The protein expression of VDR in different NRK-52E cell lines. Mean±SD. n=3. * P<0.05 vs control group.
讨 论
本研究首先采用PKC激动剂和PKC抑制剂分别处理正常大鼠肾小管上皮细胞NRK-52E,结果表明PKC活性增强时VDR和NaDC1表达显著上调,PKC活性降低时对VDR表达无影响,而NaDC1表达下调。前期研究发现,在人肾近曲小管上皮细胞HK2中VDR与NaDC1间存在明显正相关,它通过调节NaDC1的活性参与了尿枸橼酸的调控[7]。在大鼠、小鼠及人体中PKC可以具有种属及组织特异性地在mRNA及蛋白水平上调控VDR的表达[8]。PKC激活剂可以诱导大鼠肝脏中VDR的表达,并且该诱导作用可被PKC抑制剂抑制[9]。因此,我们推断PKC信号通路和VDR功能之间存在关联,PKC激动剂通过增强PKC活性诱导VDR高表达,VDR高表达时NaDC1的表达亦增高。本研究还显示,PKC抑制剂降低PKC活性引起NaDC1表达下调,而对VDR表达无影响。国内外研究者也有类似的发现,Reinhardt等[10]采用PKC激动剂和PKC抑制剂分别处理大鼠成骨肉瘤细胞,表明PKC激动剂可以在2~4 h和6~20 h间持续增强VDR表达,而PKC抑制剂对VDR表达无影响。张萍等[3]指出PKC抑制剂能显著阻止高糖导致的人近端肾小管上皮细胞HKC过度表达hNaDC3。但也有研究发现,在爪蟾卵母细胞中PKC信号通路参与NaDC1活性的快调节,PKC激活剂通过剂量依赖性增强移除细胞膜上载体蛋白的胞吞作用,联合对NaDC1载体本身活性的削弱作用共同抑制NaDC1的功能,并且这种抑制作用并不依赖PKC对NaDC1的磷酸化[11]。关于PKC激动剂促进NaDC1表达的研究目前国内外报道较少,通过本实验我们也无法完全确定PKC激动剂与NaDC1表达间的调控关系。究其原因可能是PKC对特定生物反应的功能影响因素复杂,与细胞的类型、生长状态、分化阶段和外界刺激等诸多调节因素有关,其机理还有待进一步研究。
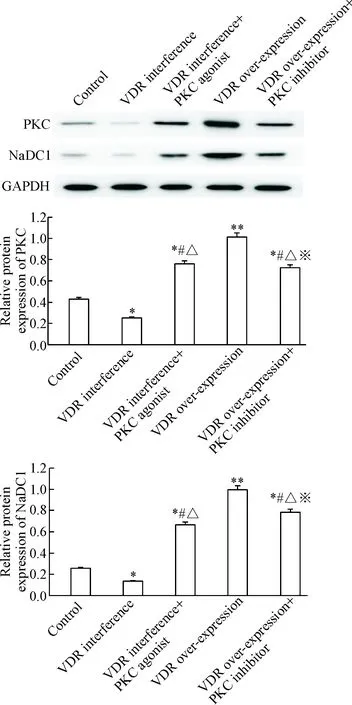
Figure 3. PKC activity and VDR abnormal expression on protein expression of PKC and NaDC1. Mean±SD. n=3. *P<0.05, ** P<0.01 vs control group; # P<0.05 vs VDR interference group; △ P<0.05 vs VDR over-expression group; ※ P<0.05 vs VDR interference+PKC agonist group.
本实验接下来在成功建立VDR稳定过表达和VDR稳定干扰的NRK-52E细胞株基础上,进行VDR过表达及VDR干扰的NRK-52E细胞中PKC和NaDC1蛋白表达情况的研究。由结果可以看出,与control组比较,VDR活性增强时PKC和NaDC1表达显著上调,VDR活性降低时PKC和NaDC1表达显著下降。在VDR对PKC表达调控的研究中发现,VDR含量增加可以增进PKC活性,而抑制VDR表达则抑制PKC活性[12]。因此我们推断VDR高表达时可促进PKC和NaDC1表达;VDR低表达时则抑制PKC和NaDC1表达,同时受抑制的PKC会进一步降低NaDC1的表达水平。本研究给予PKC激动剂PMA和PKC抑制剂Gö6983分别干预VDR干扰表达及VDR过表达的NRK-52E细胞。结合前面的分析,VDR interference+PKC agonist组中PKC激动剂增强PKC活性从而诱导干扰组的VDR增量表达,VDR的增量表达又会进一步加强PKC活性和NaDC1表达,PKC激动剂和VDR的增量表达对PKC和NaDC1蛋白表达的正向积累已高于control组,完全消除了VDR干扰处理带来的影响,但均低于VDR over-expression组的蛋白表达量;而VDR over-expression+PKC inhibitor组中PKC抑制剂降低PKC活性会减少部分NaDC1表达,但由于PKC活性降低并不影响VDR表达,VDR高表达对PKC及NaDC1有促进作用,所以尽管VDR over-expression+PKC inhibitor组中PKC和NaDC1表达与VDR over-expression组存在差异,但依然高于control组并远高于VDR interfe-rence组,因此PKC抑制剂并未完全消除VDR过表达处理带来的影响。由上可知,PKC激动剂与VDR过表达对促进或维持NRK-52E细胞中NaDC1表达量发挥重要作用。同时,VDR interference+PKC agonist组和VDR over-expression+PKC inhibitor组的PKC和NaDC1表达水平间的差异也存在统计学显著性,VDR与PKC间相互作用及因此对NaDC1表达产生影响的复杂性可见一斑。
综上所述,在大鼠肾小管上皮细胞NRK-52E中PKC活性增强诱导VDR表达, PKC活性减弱抑制NaDC1表达;VDR与PKC和 NaDC1的表达存在明显正相关;PKC与VDR间相互作用对NaDC1表达的影响中,PKC高活性和VDR过表达为促进或维持NaDC1蛋白表达的主要因素。

