氟代柠檬酸抑制缺血后适应对树鼩脑缺血后海马HIF-1α/iNOS信号通路调控的脑损伤机制*
何 亮, 谭树芬, 张富荣, 李树清
(1昆明医科大学附属延安医院麻醉科, 云南 昆明 650051; 2昆明医科大学第三附属医院妇瘤科, 云南 昆明 650018; 3昆明医科大学基础医学院病理生理学教研室, 云南 昆明 650500)
中风是导致成人残疾的主要原因,是危害人类健康的主要疾病,也是国际脑保护研究关注的重点领域[1]。尽管中风后的身体锻炼和药物治疗被广泛采用,但实际效果并不明显[2]。近年的研究提示,非药物干预是一种可以快速而简便地使大脑免受缺血损伤的新举措,即缺血后适应(postconditioning, PC)[3-5]。临床实践证明,缺血PC 技术简便,可通过将止血带或膨胀的血压计袖带快速实施,其优点还在于可使国内外倡导脑缺血治疗的6 h时间窗延至24 h。业已证明,星形胶质细胞(astrocytes, AS)为中枢神经系统的一种动态细胞,其通过调节神经递质,处理突触信息、能量代谢、抗氧化和炎症反应来维持脑内稳态[6]。AS的标志蛋白——胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)参与了中枢神经系统细胞结构、细胞形状、机械稳定性以及突触功能的维护[6-8],其线粒体功能障碍可使氧化/氮化应激增加,RNA氧化,超氧化物水平及诱导型一氧化氮合成酶(inducible nitric oxide synthase, iNOS)表达增强[7,9]。本室前期研究提示,树鼩缺血PC的脑保护与反复夹闭颈总动脉介导的机械信号转导[7]、Toll样受体活化[10]、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/Akt通路[11]和JAK-STAT(Janus kinase-signal transducers and activators of transcription)通路[12]有关。资料显示,低氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)的活化可促进下游靶基因iNOS的表达,进而影响缺血缺氧的病理进程[13-14]。但有关HIF-1α/iNOS信号通路是否参与了树鼩脑缺血PC的细胞保护,迄今未见报道,其信号通路在缺血PC中的分子机制也尚待阐明。因此,本实验采用低等灵长类动物树鼩为实验对象,在建立血栓性局灶脑缺血及缺血PC模型的基础上,通过侧脑室注射AS代谢抑制剂——氟代柠檬酸盐(fluorocitrate, FC),观察抑制AS代谢对缺血PC脑保护作用的影响,并探讨缺血PC对树鼩脑缺血海马HIF-1α/iNOS信号通路调控的脑保护机制,为脑缺血的保护治疗提供实验依据。
材 料 和 方 法
1 材料
1.1实验动物及分组 清洁级健康雄性成年树鼩67只,体重(125±20) g,由昆明医科大学实验动物中心提供[许可证号:SCXK(滇)2013-0002]。按照随机数字法分为:假手术对照(control)组(n=9);缺血组(n=18),又分为缺血4 h(ischemia 4 h, Is 4 h)组(n=9)和缺血24 h(Is 24 h)组(n=9);缺血PC(Is+PC)组,又分为Is+PC 4 h组(n=9)和Is+PC 24 h组(n=9);FC预处理组,又分为FC+Is+PC 4 h组(n=11)和FC+Is+PC 24 h组(n=11)。实验流程见图1。
1.2主要仪器设备及试剂 SQ-Ⅲ型血栓形成装置(专利号:ZL201420068737.2)[7]由光源、散热装置以及光学系统(包括干涉滤镜及聚光透镜)组成,光源中心波长(λ)560 nm, 带宽(Δλ)60 nm,光强度1.0 W/cm2,用时间继电器控制照射时间;AB204-S 台秤(Mettler Toledo);KW-Ⅱ型脑立体定位仪(西北光学仪器厂产品);Multiskan GO酶标仪(Thermo);ImageJ图像分析软件(NIH);Mini-Protein 3 装置(Hercules);CM1940UV冰冻切片机(Leica)。孟加拉红(rose bengal)购自Fluka; 抗iNOS抗体及2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)购自Sigma;RIAP裂解液和BCA蛋白测定试剂盒购自碧云天生物技术研究所;NO和NOS试剂盒购自南京建成生物工程研究所;Ⅱ抗即用型快速免疫组化MaxVisionTM试剂盒购自福州迈新生物技术开发有限公司;HIF-1α ELISA试剂盒购自R&D Systems;用于Western blot的辅助试剂均购自Bio-Rad Laboratories。
2 主要方法

Figure 1. The schematic diagram of experimental design. FC: first clamping; SC: secondary clamping; TC: third clamping.
2.1树鼩血栓性局灶性脑缺血及缺血PC模型的建立 按照既往实验步骤复制缺血模型[7]:用3%硫喷妥钠(0.30 g硫喷妥钠加入灭菌双蒸水共计10 mL)腹腔麻醉(50 mg/kg)树鼩,麻醉起效后,仰卧固定动物,消毒右颞部皮肤,在距离矢状缝1.0 cm的直线与耳廓前缘所在的与矢状缝垂直的直线上的交汇处向尾侧切开右顶部皮肤约1 cm,暴露右侧颅骨,精心分离软组织以免损伤颅骨表面而影响透光性。于切口处嵌入一外径为1 cm×2.5 cm的消毒铜片,其中心含一直径为0.5 cm的窗孔,以便光束通过该窗孔直接照射于颅骨表面。铜片以外的组织用避光纸遮盖。至此,于动物舌下静脉一次性缓慢注入浓度为1.5 %的孟加拉红(用0.85%灭菌生理盐水配制)20 mg/kg(1.3 mL/kg体重),循环10 min后,将树鼩置于实验装置下,立体定位,使右侧顶区颅骨(铜片中心区)对准光源,在光强度为1.0 W/cm2,颅骨表面温度(36±1) ℃(与颅肌温度接近)条件下垂直照射15 min(时间继电器控制)。缺血PC模型:于光化学反应4 h后再次麻醉动物,仰卧固定,颈部正中作纵形切口,分离出右侧颈总动脉,以无创动脉夹在甲状软骨上缘平面夹闭颈总动脉5 min后去除动脉夹再灌5 min,重复3次以复制缺血PC模型,术后缝合动物颈部创口,保暖入笼观察。
2.2AS代谢抑制剂FC侧脑室注射 FC应用液(10 nmol/L)配制:称取barium DL-fluorocitrate 8.0 mg溶解于1 mL 0.1 mol/L的HCl溶液中,充分搅拌后加入2滴0.1 mol/L的Na2SO4沉淀出Ba2+,再加入2 mL 0.1 mol/L Na2HPO4,搅拌,188.8×g离心5 min,取上清,用0.15 mol/L的灭菌NaCl稀释,调节pH值至7.4备用。将麻醉动物固定在脑立体定位仪上,备皮,消毒顶部皮肤,沿顶部正中线切开皮肤,暴露颅骨。根据法兰克福平面(Frankfurt plane)作为立体定位坐标系统的基础,在右侧(患侧)脑室以AP 0.0平面前9.5 mm(A9.5)、矢状缝右侧1.2 mm (R1.2)坐标点作为进针部位,在数字式微电极驱动器控制下,将微灌流探针垂直进入4.0~4.5 mm (H4.0~4.5)至侧脑室;按5 μL/min的灌流速度分别对各组动物行侧脑室微灌注,10 μL注射完毕后消毒并缝合切口,保暖回笼,观察并进行后续研究。
2.3TTC染色及梗死体积测定 光化学反应后4 h及24 h,将实验动物麻醉、迅速开颅取脑,肉眼直接观察光化学反应区脑皮层可见一直径约0.5 cm的缺血水肿区;将树鼩大脑于-20 ℃冰箱中速冻约20 min,自脑前极与视交叉连线中点处为起点,将大脑切为2 mm厚的5~6片,置于37 ℃的1% TTC液中水浴30 min,不时翻动脑片,使其均匀染色。正常脑组织TTC 染色呈红色,而梗塞区则呈苍白色,界限清楚。照相留底记录,采用CAD 2007 版制图软件测定梗死面积×层厚为梗死体积[15]。
2.4HE染色及光镜观察 脑缺血后上述时点麻醉动物,开胸并剪开心包,自心尖部插入一聚乙烯管使其进入升主动脉并结扎固定;剪开右心耳,在120 mmHg压力下灌注10%甲醛200 mL行内固定2 h。将内固定的大脑开颅取出并用新配制的10%甲醛溶液再固定24 h,于视交叉后1.7~4.0 mm行冠状切片,取中间切块梯级脱水、透明、浸蜡,常规石蜡包埋制成蜡块标本,进行HE染色,在光镜下观察脑皮层组织结构及神经元的形态学变化。
2.5局部脑血流测定 采用激光多普勒血流监测仪(periflux system 5000, perimed, sweden)经颅测量区域性脑血流(regional cerebral blood flow,rCBF)。将麻醉的树鼩固定于立体定位仪上,以法兰克福平面作为立体定位坐标系统的基础(如前所述),于缺血后适应4 h及24 h用Perimed提供的Perisoft配套软件进行曲线输出记录,血流仪将采集信号转换成血流灌注单位(perfusion unit, PU)[=CMBC(一定体积内细胞的分布率)×V(平均血细胞的移动速率)],选取稳定记录血流曲线300S,所有数据取平均值为rCBF。经仪器对接收到的反射激光进行分析处理后并显示灌注量值即PU,其代表测量深度范围的相对单位,可直接反映rCBF的改变[7]。
2.6免疫组化检测iNOS表达 将圈定的树鼩大脑冰冻切片的脑组织,PBS冲洗3次,每次3 min,加入Ⅰ 抗(iNOS,兔抗人,1∶200))并用PBS稀释(加入5%马血清);3%的H2O2,室温孵育10 min,PBS冲洗3次,每次3 min;擦干圈外PBS水渍,置于湿盒上,逐片快速加入适量iNOSⅠ抗(兔抗人,1∶200),室温静置60 min,PBS冲洗3次,每次3 min;除去PBS,加Max VisionTM试剂(山羊抗兔,福州迈新生物技术开发有限公司)室温孵育15 min,PBS冲洗3次,每次3 min;除去PBS,加新鲜配制的DAB,显微镜下观察3~5 min;冲洗,苏木素复染,冲洗返蓝,梯度酒精脱水干燥,二甲苯透明,中性树胶封固。阴性对照实验用PBS代替I抗,其余步骤相同。各组用于此项观察的脑组织一起切片,并同时进行免疫组化染色,以保证免疫组化条件一致。在Olympus BX50光学显微镜下观察各组树鼩海马区iNOS阳性细胞的显色程度。用HPIAS-1000高清晰度彩色病理图文采集分析系统拍摄切片进行观察分析。
2.7Western blot检测海马组织iNOS表达 于各时点深度麻醉动物,迅速断头取海马,蛋白裂解液RIAP裂解(10 μL/mg组织),4 ℃、12 000×g离心10 min。BCA法测定蛋白浓度。分离胶10% SDS-PAGE电泳(初始电压120 V,每30 min递减10 V电压,总时间为90 min)。PVDF转膜(150 mA稳流转移2 h),TBS-T洗膜3次,每次10 min,加入兔抗鼠iNOS抗体(1∶500),4 ℃冰箱孵育过夜。TBS-T洗膜3次,每次10 min;HRP标记的羊抗兔IgGⅡ抗(1∶10 000)封闭,室温下振摇60 min,TBS-T洗膜3次,每次10 min;化学发光试剂暗室中曝光30 s,洗片,扫描成图像,ImageJ图像灰度分析[16]。
2.8NO产量检测 分光光度计检测蛋白中NO含量,按照试剂盒(南京建成生物工程研究所)要求进行操作,取混合试剂、双蒸水或样品混匀,37 ℃准确水浴60 min,加辅助试剂并充分漩涡混匀30 s,室温静置40 min,3 020×g离心10 min,取上清、混匀,室温静置10 min,蒸馏水调零,550 nm波长,0.5 cm光径,测定各管吸光度(A)值。NO浓度(mmol/g protein)的计算公式如下:
NO含量(mmol/g protein)=
/待测样本蛋白浓度 (g/L)。
2.9ELISA检测海马组织HIF-1α蛋白表达 按照试剂盒方法提取各时点各组海马组织总蛋白,BCA法测定样品浓度。HIF-1α标准测定液及样品待测液室温孵育2 h,洗板3次;室温孵育HIF-1α稀释抗体2 h,洗板3次;室温孵育稀释辣根过氧化物酶20 min,洗板3次;用反应底物溶液室温避光孵育20 min后加终止液,用酶标仪于450 nm波长测量HIF-1α浓度。测定总HIF-1α的标准曲线及公式参数如图2所示。
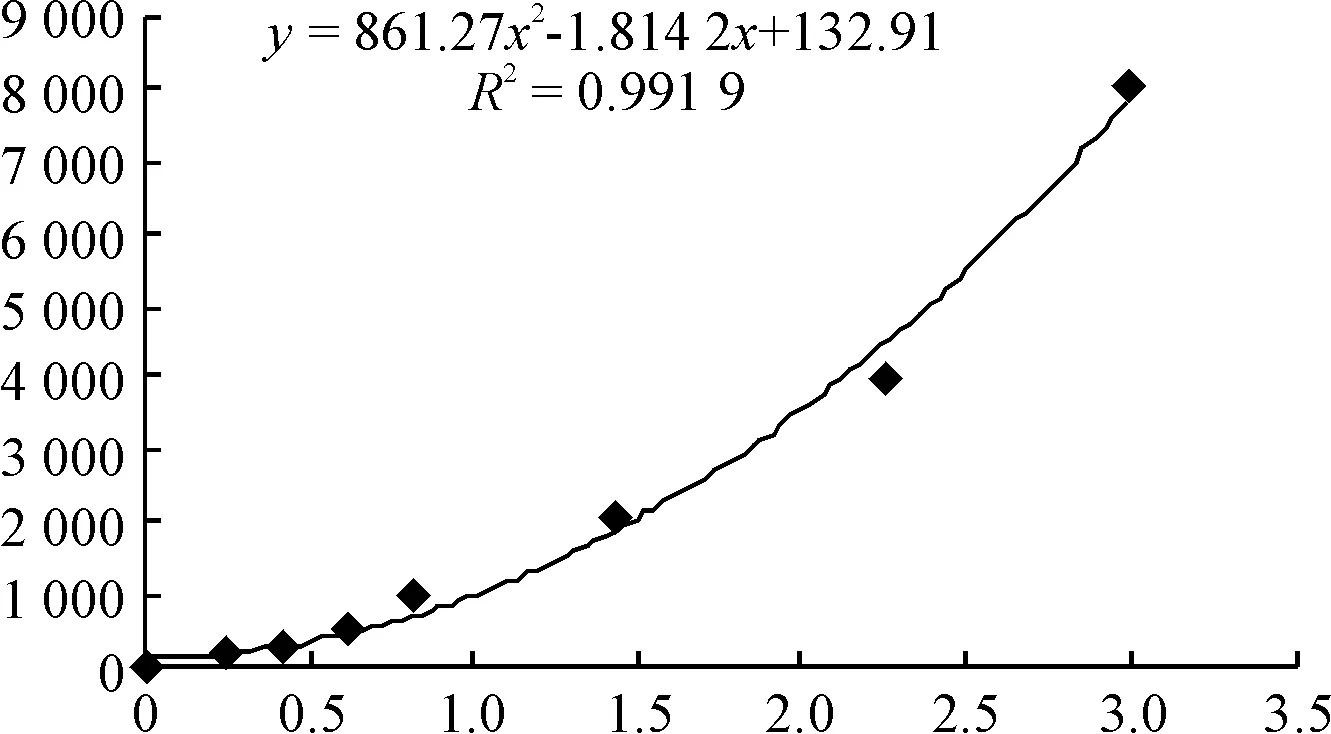
Figure 2.The standard curve of total standard HIF-1α protein.
3 统计学处理
实验数据以均数±标准差(mean±SD) 表示,组间均数比较采用单因素方差分析(多重两两比较采用LSD-t法),用SPSS 11.5统计软件进行分析,以P<0.05为差异有统计学意义。
结 果
1 缺血PC及FC对树鼩脑梗死体积的影响
TTC染色显示树鼩脑缺血24 h脑皮层光照区梗死灶明显,缺血区呈苍白色,边界清楚,缺血中心可见光照后的皮层血管阻塞,缺血PC处理后梗死灶明显缩小,PC处理后梗死加重;肉眼观察与TTC染色结果基本一致,见图3。此时树鼩脑皮层梗死体积为(1.26±0.14)%,缺血PC处理后脑梗死体积减小(0.96±0.10)%(P<0.05);而FC预处理后24 h脑梗死体积显著增大(1.67±0.31)%(P<0.05),见图4。
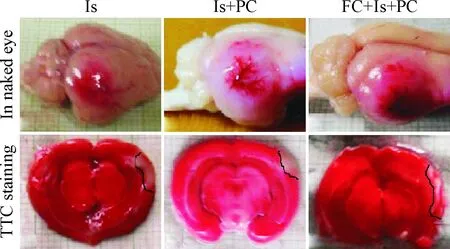
Figure 3.The results of visual observation and TTC staining.
2 缺血 PC及FC对树鼩脑缺血后海马神经元损伤的影响
光镜下对照组海马CA1区呈条索状,神经元排列整齐、形态正常;缺血后24 h神经元大量坏死,排列明显紊乱;缺血PC处理后24 h组神经元的排列趋于整齐,细胞形态趋于恢复;而用FC预处理组海马CA1区形态规整的神经元数量显著减少,排列极度紊乱,缺血PC对神经元的保护效果明显减弱,见图5。
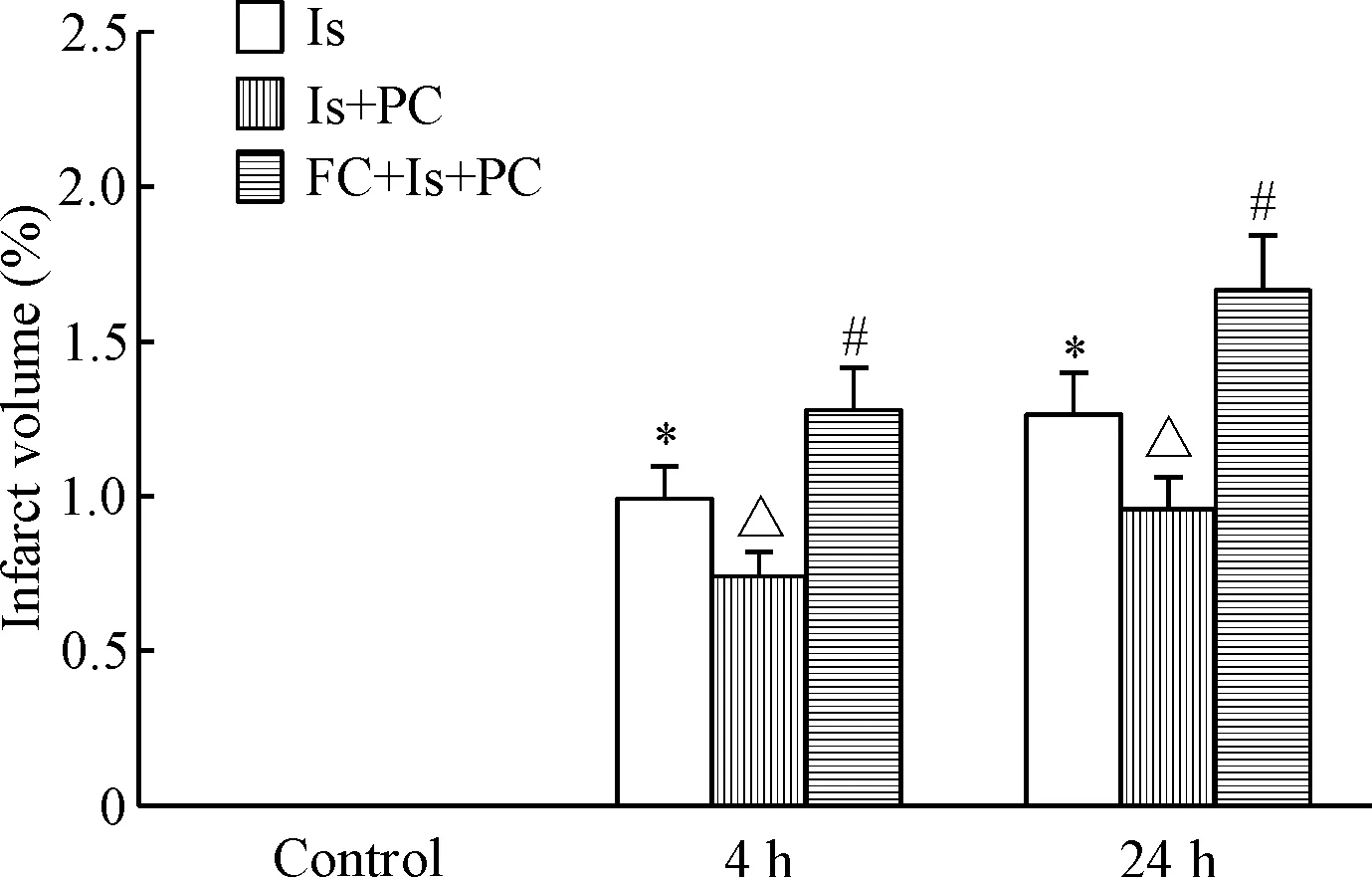
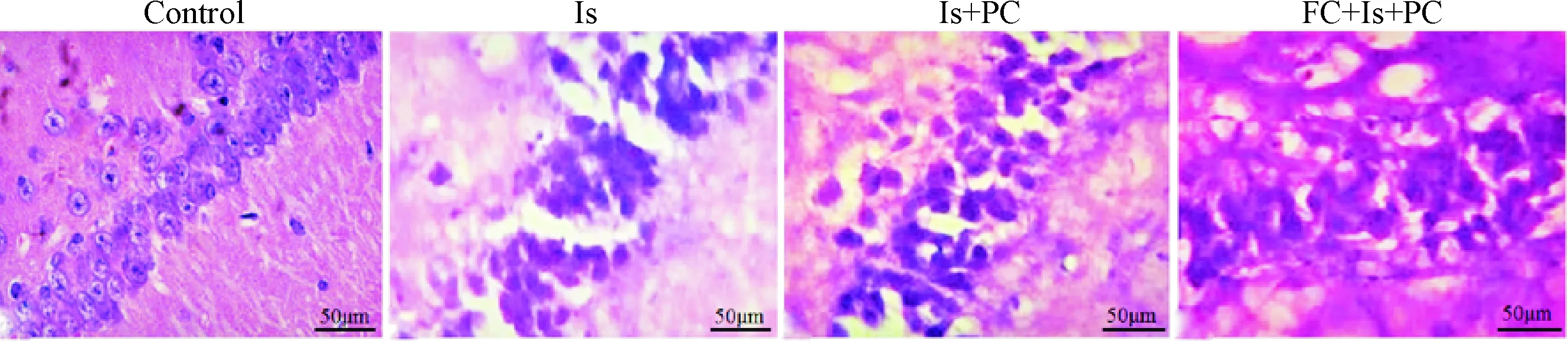
Figure 5.Effects of FC and ischemic PC on morphological changes of hippocampal neurons after cerebral ischemia in tree shrews (HE staining, ×400).
3 缺血PC及FC 对树鼩脑缺血后皮层rCBF的影响
对照组树鼩皮层rCBF为(438.53±24.11) PU;脑缺血时皮层rCBF进行性降低,4 h及24 h分别为(165.85±13.85) PU和(133.78±18.85) PU,以缺血24 h的改变为显著(P<0.05);缺血PC组的rCBF呈恢复性增加,分别为(234.75±17.11) PU和(193.45 ±16.41) PU(P<0.05);而FC预处理后4 h及24 h, rCBF均无恢复性改变,见图6。
4 缺血PC及FC对树鼩脑缺血后海马神经元iNOS表达的影响
免疫组化检测显示,iNOS主要表达于细胞浆。与对照组比较,海马iNOS于缺血24 h表达增多,缺血PC处理后其表达明显下降; FC预处理组24 h海马iNOS几乎无表达,见图7。
Western blot检测可见,缺血4 h 海马iNOS略有表达;缺血PC处理后4 h其表达变化不明显;FC预处理组4 h海马iNOS表达显著减弱(P<0.05)。与对照组比较,海马iNOS于缺血24 h表达显著升高(P<0.05),而缺血PC处理后24 h则显著降低(P<0.05);但FC预处理组24 h海马iNOS表达显著减弱(P<0.05),见图8。
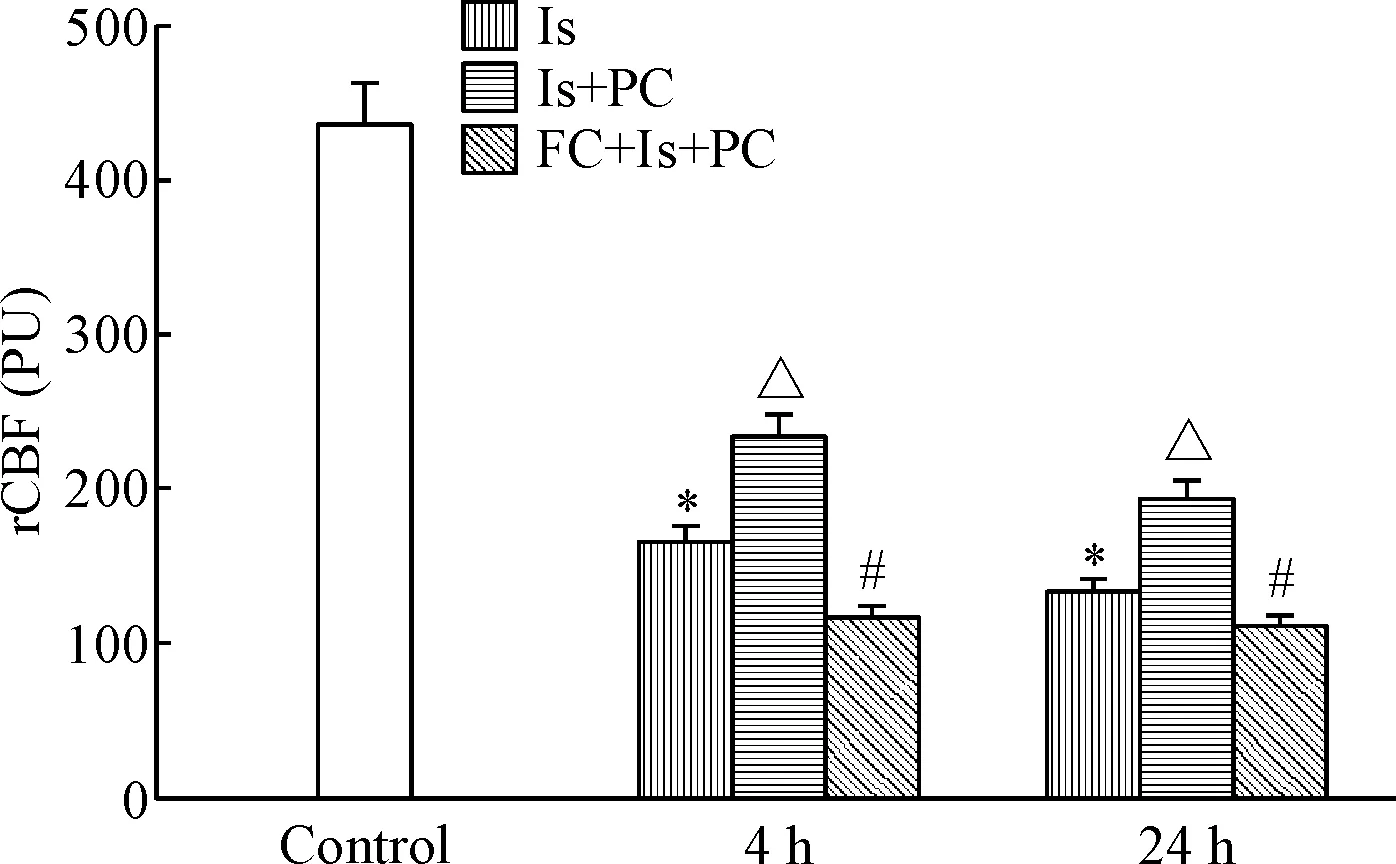
Figure 6.Effects of FC and ischemic PC on cortex rCBF after cerebral ischermia in tree shrews. Mean±SD.n=9.*P<0.05 vs control group;△P<0.05 vs Is group, #P<0.05 vs Is+PC group.

Figure 7.Effects of FC and ischemic PC on iNOS expression in hippocampal neurons after cerebral ischemia in tree shrews (×400).
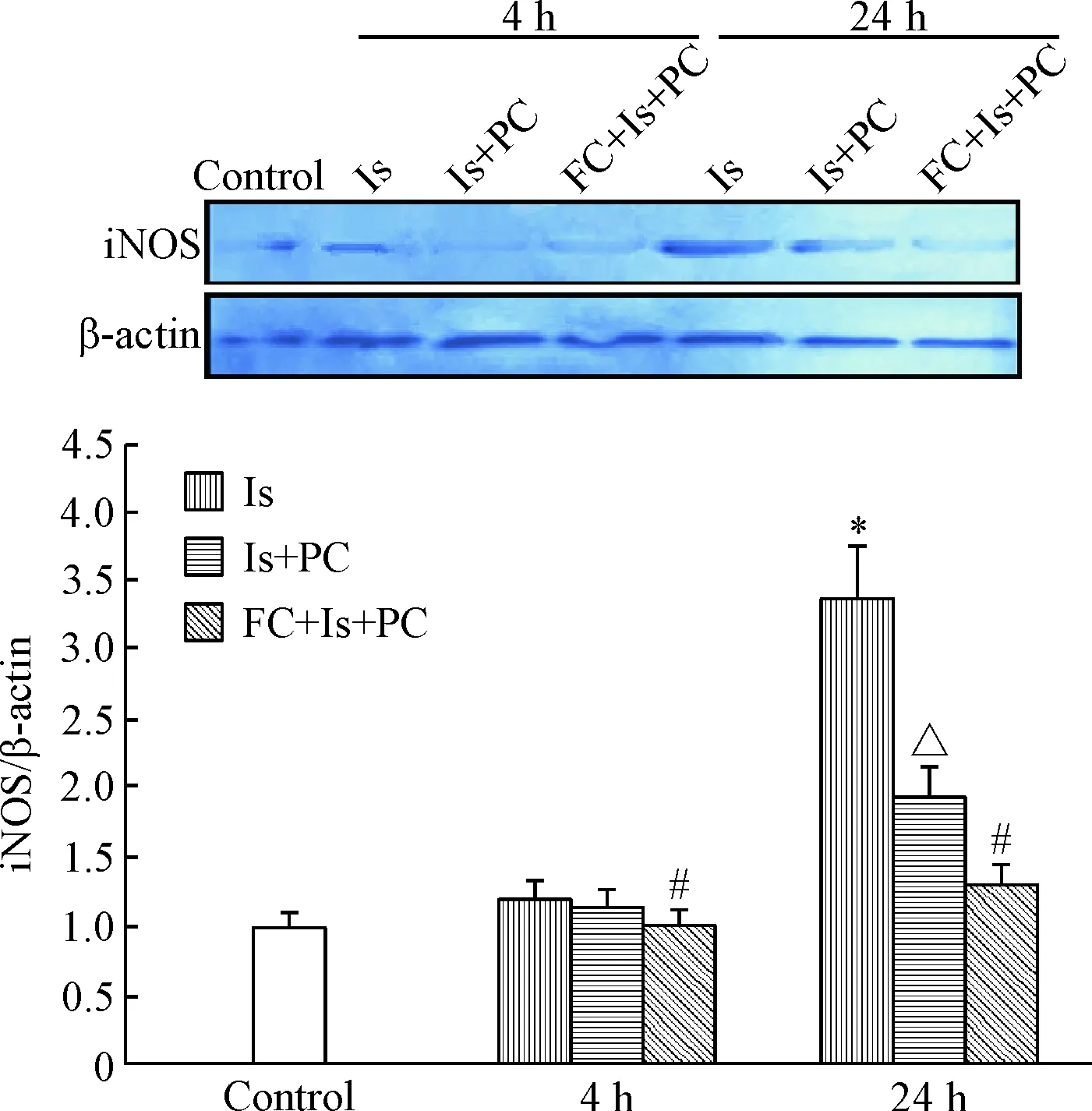
Figure 8.Effects of FC and ischemic PC on the protein expression of iNOS in hippocampus after cerebral ischemia in tree shrews. Mean±SD. n=3. *P<0.05 vs control group;△P<0.05 vs Is group;#P<0.05 vs Is+PC group.
5 缺血PC及FC对树鼩脑缺血后海马NO产量的影响
与对照组比较,脑缺血4 h海马NO升高(P<0.05);缺血24 h进一步升高(P<0.05);缺血PC干预后24 h海马NO显著降低(P<0.05);与Is+PC组相比,FC干预后24 h海马NO又升高(P<0.05),见图9。
6 缺血PC及FC对树鼩脑缺血后海马HIF-1α表达的影响
ELISA结果显示,树鼩脑缺血后各组海马HIF-1α表达较对照组升高(P<0.05),其中缺血24 h的HIF-1α表达显著高于缺血4 h组(P<0.05);缺血PC干预后HIF-1α表达进一步上调(P<0.05),以缺血24 h的改变为显著;FC预处理后4 h海马HIF-1α表达即显著升高(P<0.05),见图10。

Figure 9.Effects of FC and ischemic PC on the production of NO in hippocampus after cerebral ischemia. Mean±SD. n=3. *P<0.05 vs control group; △P<0.05 vs Is group; #P<0.05 vs Is+PC group.

Figure 10.Effects of FC and ischemic PC on HIF-1α expression after cerebral ischemia in tree shrews. Mean±SD. n=3. *P<0.05 vs control group; △P<0.05 vs Is group; #P<0.05 vs Is+PC group.
讨 论
树鼩(Tupaiabelangeri)的中枢神经系统比犬、兔、大鼠和小鼠更为高级,与人类更接近。因此,将树鼩用作脑缺血发病机制及其防治的实验动物,相对于大鼠和小鼠等啮齿类动物而言,其具有更好的神经生物学与解剖学基础。由于光化学诱导脑血栓形成无需开颅,操作简单,对动物机体损伤小,动物成模后的存活率较高,且脑梗塞面积和损伤程度易于调控[17],符合国际脑缺血研究关于脑缺血模型需“创伤小、不改变颅内压、稳定性好”的特点。
TTC结果分析显示,树鼩脑缺血24 h脑梗死灶明显(P<0.05);缺血区rCBF且随着缺血时间延长而进行性降低,缺血后4 h及24 h的rCBF分别下降62.18%和69.49%(P<0.05);同时观察到树鼩脑梗死体积随缺血时间延长而明显增大(P<0.05),神经元损伤的程度与脑梗死体积增加的趋势平行。已知NOS分为固有型和诱导型,前者包括nNOS和eNOS,具有神经保护作用,后者即iNOS[6,18]。iNOS可加速NO生成并氧化生成硝酸盐,此间产生的过氧亚硝酸盐阴离子(ONOO-)可能参与脑缺血所致血脑屏障(blood-brain barrier, BBB)损伤引起的神经元微环境的改变[19-20]。正常时CNS并不表达iNOS,只有在脑缺血、脑外伤、神经毒性损伤及炎症反应等条件下才表达iNOS[21]。本研究证实,缺血后4 h海马iNOS蛋白呈弱表达,但其催化活力却显明显升高(P<0.05),提示脑缺血4 h的超早期病理改变与iNOS的高活力有关;缺血24 h海马iNOS蛋白表达显著上调,可能是脑缺血24 h神经损伤加剧的主要原因[22],缺血PC 处理后24 h时iNOS表达显著减少(P<0.05),提示缺血PC抑制iNOS的表达,对eNOS和nNOS的平衡具有调节作用,其结果既减少NO的生成,又降低BBB通透性而缓解血管源性脑水肿。研究发现缺血PC处理后AS的活化程度与rCBF增加的趋势相平行[7],提示AS在PC脑保护中具有着重要的调节作用。为揭示其可能机制,本研究通过侧脑室注入AS代谢特异性抑制剂FC,经确认GFAP及GS表达下调的条件下,探讨AS活化在PC大脑保护的病理生理机制,为临床脑缺血性的防治提供新的实验依据[23]。结果表明FC可使AS的GS活性显著抑制,缺血PC的脑保护效应也因FC的应用而明显减弱。主要变化为海马神经元损伤加剧和脑梗死体积显著增大;其机制可能涉及以下几方面:(1)FC抑制AS内谷氨酸(aminoglutaric acid,AA)的转化,导致缺血微环境AA堆积而削弱缺血PC的保护效应;(2)FC干扰AS的三羧酸循环使线粒体能量生成不足,导致神神经元损伤和脑梗死体积扩大;(3)FC对缺血PC下调海马iNOS表达和抑制NO生成的抗损伤作用具有逆转效应,与文献报道相吻合[24-26]。资料证实,全脑缺血动物实施低氧后适应(hypoxic postconditioning)后HIF-1可通过上调PI3K/Akt和p38 MAPK信号级联反应以及下调ERK1/2信号传导而介导神经保护作用[27];但相反的研究结果显示,HIF-1可促凋亡蛋白的反激活而介导细胞凋亡[27-28]。事实上,HIF在神经系统疾病中发挥双重作用,既可以促进神经细胞存活,也可以促进神经细胞凋亡。如何在神经系统疾病的发生发展尤其在缺血性脑血管病的治疗中利用HIF的神经保护效应而避免其损伤作用,仍然是未来研究的热点[29]。本研究结果表明,树鼩脑缺血时rCBF降低导致细胞供氧匮乏,而HIF-1α表达明显升高既是细胞缺血缺氧的一种代偿反应,又是激活其下游靶基因使iNOS上调的重要因素[22];缺血PC干预后HIF-1α表达进一步上调可能是缺血PC脑保护的机制所在,与我们先前关于缺血PC促进JAK2/STAT3活化以及Akt Ser473/Thr308位点磷酸化的结果一致[10,12]。应用AS抑制剂后24 h树鼩脑梗死范围明显扩大,显然与AS维持脑内稳态功能受抑制有关[7]。而FC预处理后海马HIF-1α表达仍上调而未受抑制,提示FC的作用环节可能在其靶基因下游而对其上游的HIF-1α则无直接影响[22]。但FC干扰AS代谢而降低AS的脑保护作用与HIF-1α上调之间是否具有因果关系尚待阐明。显然,AS在“神经-血管单元”中发挥的桥梁作用在缺血PC介导的“机械信号转导”以及“PI3K/Akt、JAK2/STAT3、HIF-1α/iNOS”等[7,10,12]生物信号通路的调控可能在增强机体内部抗损伤能力,抑制神经元继发性损伤中起着重要作用。尽管上述信号通路在缺血PC的保护中发挥着重要作用,但迄今对这些通路之间相互作用的调节机制仍不明确,其基因差异表达的研究仍有待进一步探索。

