环境因子对塔里木马鹿种群遗传多样性的影响
塔依尔江·麦麦提塔吉古丽·吐热甫布威海丽且姆·阿巴拜科日苏比奴尔·艾力马合木提·哈力克
(1.新疆大学生命科学与技术学院,乌鲁木齐,830046;2.库尔勒市第六中学,库尔勒,841000;3.新疆维吾尔医学专科学校,和田,848000)
塔里木马鹿(Cervuselaphusyarkandensis)是中国马鹿8个亚种中唯一高度适应荒漠生境的特殊亚种,属国家II级重点保护动物,又是重要的经济动物[1]。近年来,在人为因素和自然因素的双重影响下,塔里木马鹿适宜栖息地环境不断丧失、退化和片段化,给处于濒危状态的野生塔里木马鹿的生存带来了严重的威胁。因此本文通过探讨塔里木马鹿遗传多样性与环境因子之间的关系,找出影响塔里木马鹿种群遗传多样性的主导环境因子,为塔里木马鹿的保护与管理提供科学性依据。
1 材料与方法
1.1 实验材料
本研究采用非损伤性取样法,在新疆塔里木盆地设3个取样点进行野生塔里木马鹿样本收集,分别为:沙雅种群14个个体粪便样本,尉犁种群11个个体粪便样本,且末种群8个个体粪便样本和当地护林站提供的自然死亡的2头马鹿肌肉样本,总共采集了35个个体样本,采集时,在野生塔里木马鹿经常出现的区域内沿其足迹寻找粪便,为了避免样本的污染保证粪便样本的新鲜程度,采集到的样本分别放入到装满无水乙醇的50 mL离心管中,带回实验室,保存在-80℃冰箱待用。为比较塔里木马鹿和天山马鹿两种群的状况,我们以小渠子、白石头和寒气沟3种群的天山马鹿样本数据为主进行了研究,具体操作均参考了周璨林的采样信息[2](图1)。
PCR扩增所用引物:上游引物:5′-GAA AAA CCA TCG TTG TCA TTC A-3′,下游引物:5′-GGA GGT TGG AG CTC TCC TTT T-3′[3]。

图1 塔里木马鹿和天山马鹿采样点显示图Fig.1 The sampling site diagram of Tarim red deer and Tianshan red deer 注:图中三角形图标表示塔里木马鹿采样点,方形图标表示天山马鹿采样点 Note:Triangle dot represents the sampling site of Tarim red deer;Square dot represents the sampling site of Tianshan red deer
1.2 方法
1.2.1 环境因子
为了进行塔里木马鹿种群遗传多样性与环境因子的相关性研究,本文选用塔里木马鹿分布区和天山马鹿分布区近31年(1984~2014)的年均降水量、年均气温、年均日照、人口、年均耕地面积、年均畜牧数量、年均无霜期、经度、纬度和海拔等总共10个因子作为环境因子(表1)。有关天山马鹿经纬度与海拔数据参考了周璨林的数据[2],塔里木马鹿经纬度和海拔是采集样本时收集到的(表2),而相关气象数据则向新疆维吾尔自治区气象局信息中心索取。
表1 各地理种群环境数据
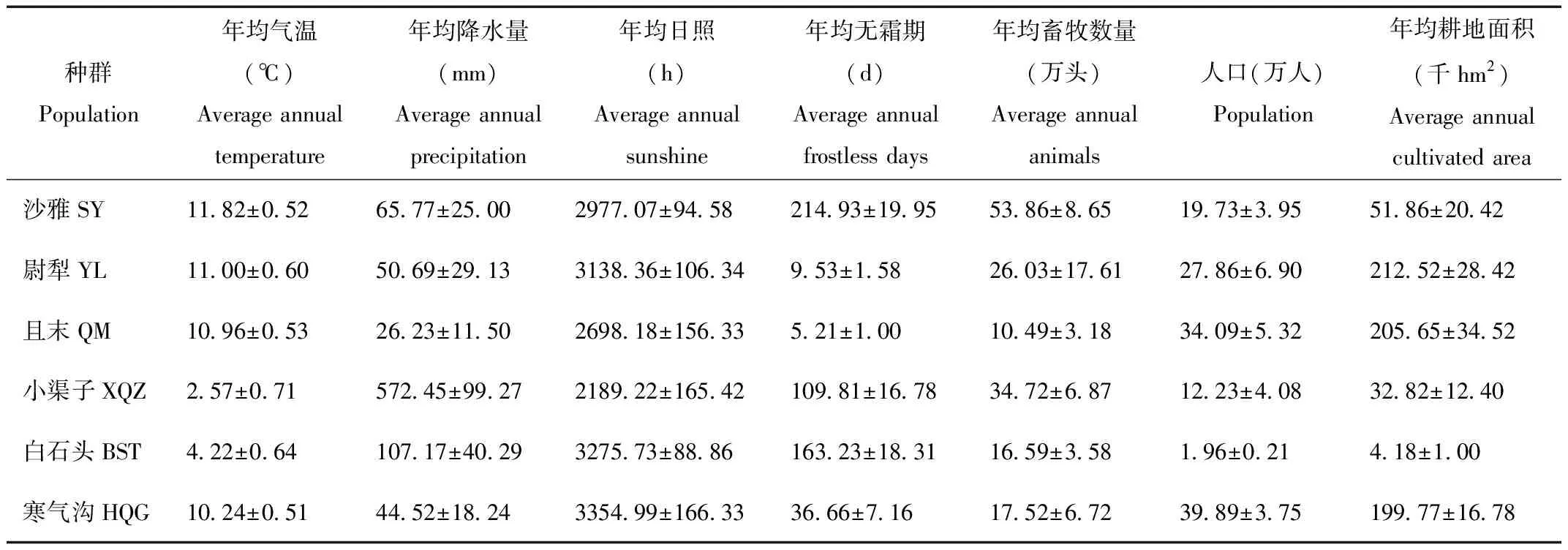
Tab.1 Each population environmental data
注:所有数据是平均值±标准差形式表示,Mean±SD
Note:All data were expressed in the form of mean±standard deviation(SD)
表2 马鹿采样点地理坐标与海拔数据

Tab.2 Geographic coordinates and elevationdata of sampling plots of red deer
1.2.2 DNA提取
提取粪便DNA所用的试剂配制与提取方法参考日沙来提等人改良的CTAB裂解法进行[4],提取肌肉DNA参考赵建军的方法[5]。
1.2.3 PCR反应
反应体系为DNA模板(含DNA10~100 ng)4 μL,上游引物(10 μM)3 μL,下游引物(10 μM)3 μL,Primer Star Max DNA Polymerase 24 μL,ddH2O 19 μL。设计不加模板的空白对照。反应条件为94℃预变性5 min,94℃变性60 s,55℃退火60 s,72℃延伸90 s,35个循环后72℃延伸10 min,4℃保存。纯化扩增产物送至宝生(大连)生物技术有限责任公司测序部进行测序。
1.2.4 数据处理
从表可以看出,P值均为0.25,大于显著性水平0.05,卡方对应的P值具有统计显著性,通过显著水平为95%的显著性检验。卡方与自由度之比为1.622,小于2。同时,GFI接近于1,RMSEA小于0.05,以上几个指标均满足模型检验与拟合优度的要求,说明模型拟合效果较好。
序列结果首先用DNAStar 5.0软件包中的Editseq和Seqman子程序进行基因片段的合并。编辑后序列在GenBank中进行BLAST同源性比对,去除非同源的样本,确认扩增片段是否我们所需要的目的片段。用Clustal W 1.83排序[6],并手动修改那些显而易见的排序错误。应用DNASP 5.10软件[7]计算各地理种群单倍型多样性(Haplotype diversity,h)和核苷酸多样性(Nucleotide diversity,π)。应用Arlequin 3.1软件计算各个地理种群之间的基因流和遗传分化程度[8]。本文有关天山马鹿的种群遗传多样性数据参考周璨林的数据[2]。利用SPSS 19.0对塔里木马鹿和天山马鹿种群遗传多样性与环境因子进行多元逐步回归分析。 应用Canoco 4.5软件对塔里木马鹿和天山马鹿种群遗传多样性与环境因子之间分别进行冗余(RDA)分析,进一步探讨塔里木马鹿种群遗传多样性与环境因子的相关性。
2 结果
2.1 序列特征
目的片段的扩增通过马鹿mtDNA Cytb基因特异性引物来完成。扩增长度为1140 bp的PCR产物,扩增产物的条带亮而清晰,没有杂带,与引物设计的扩增条带相符。因此,确定为目的条带,可以进行测序。测序所得的塔里木马鹿Cytb基因1140 bp序列中,各碱基的平均含量分别为29.3%(T)、27.3%(C)、13.4%(G)、30.1%(A),A+T的含量为(59.4%),C+G的含量为 40.6%,A和T的比例高于C和G的比例,A+T的含量明显高于C+G的含量,碱基含量显示出一定的偏歧性(表3)。各密码子位点碱基含量不均匀,第一位各碱基含量在27%(T)和17%(G)之间,第二密码子位点12%(G)和32%(T)之间,第三密码子位点33%(A)和12%(G)之间,密码子三位点G的含量最低而A的含量最高。野生塔里木马鹿Cytb基因序列中G碱基相对缺乏。
表3 塔里木马鹿Cyt b基因碱基组成
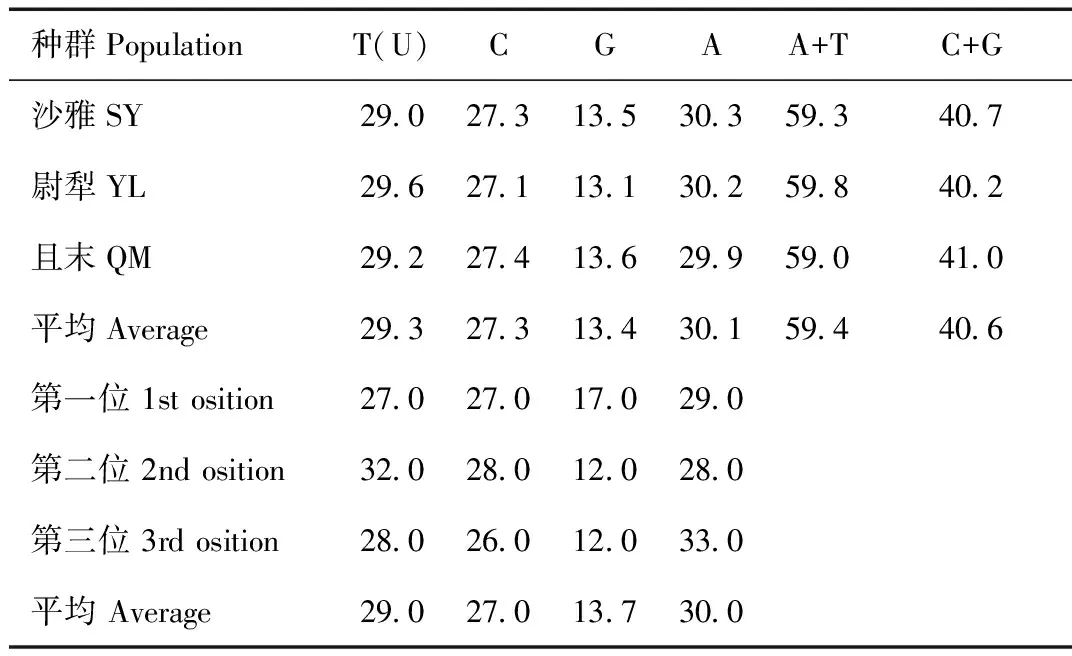
Tab.3 The Tarim red deer Cyt b gene composition
2.2 种群遗传多样性
塔里木马鹿3个地理种群的单倍型多样性(h)和核苷酸多样性(π)为:沙雅种群0.911~0.016,尉犁种群0.664~0.008,且末种群0.363~0.005,其中遗传多样性相对较高的是沙雅种群,相对较低的是且末种群(表4)。塔里木马鹿种群总体具有较高的单倍型多样性和较低的核苷酸多样性,整体遗传多样性不平衡,处于较低水平。
2.3 基因流
应用Arlequin 3.1软件计算各个地理种群之间的基因流(Nm)和遗传分化程度(FST),结果显示各地理种群之间具有显著的遗传分化现象。塔里木马鹿3个地理种群(表5)中尉犁种群与且末种群之间Nm=0.724,尉犁种群与沙雅种群之间Nm=5.562,且末与沙雅种群之间Nm=0.910,尉犁种群与沙雅种群之间的基因流值Nm大于4,说明两个种群之间有一定程度的基因交流,是个随机交配的群体。且末种群与沙雅种群、尉犁种群之间的基因流值Nm均小于1,说明且末种群与其他两个种群之间的基因交流缺乏,分化程度显著。
表4 塔里木马鹿3个地理种群的遗传多样性

Tab.4 The three population genetic diversity of Tarim red deer
表5 塔里木马鹿的遗传结构参数
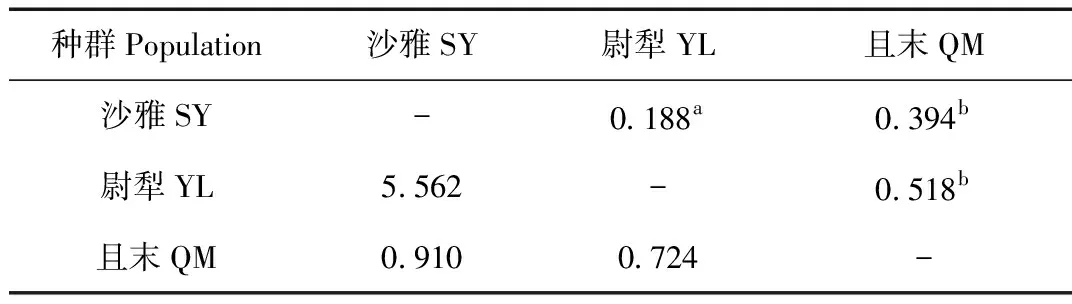
Tab.5 Population parameters for Tarim red deer
注:a:P>0.05,无显著差异;b:P<0.01,有极显著差异;上方为遗传分化值,下方为基因流值
Note:a:P>0.05,Not significant;b:P<0.01,Statistical significant;above diagonal is the value of genetic differentiation,and below is the gene flow value(Nm)
2.4 环境因子对塔里木马鹿种群遗传变异的影响
将马鹿种群内遗传多样性和各地区经度、纬度、海拔、年均降水量、年均气温、年均日照、人口、年均耕地面积、年均畜牧数量和年均无霜期10个因子作为环境因子进行相关性分析。
通过SPSS 19.0软件的结果可以看出(表6)基于线粒体DNA Cytb基因的塔里木马鹿和天山马鹿核苷酸多样性(π)与年均降水量、海拔和纬度呈正相关,其中与年均降水量(r=0.783,P<0.05)和海拔(r=0.997,P<0.05)呈显著的正相关,与纬度(r=0.414,P>0.05)呈无显著的正相关;与年均无霜期、年均气温、年均日照、经度、人口、年均畜牧数量和年均耕地面积呈负相关,其中与年均无霜期(r=-0.341,P>0.05)、年均日照(r=-0.263,P>0.05)和经度(r=-0.065,P>0.05)呈无显著的负相关,与年均气温(r=-0.619,P<0.05)、年均畜牧数量(r=-0.537,P<0.05)和年均耕地面积(r=-0.534,P<0.05)呈显著的负相关,与人口呈极显著的负相关(r=-0.511,P<0.01);单倍型多样性(h)和核苷酸多样性(π)的相关性均与年均降水量、海拔和纬度呈正相关以外剩下的因子都呈负相关。
表6 塔里木马鹿和天山马鹿种群遗传多样性与环境因子的相关性

Tab.6 Crolation coefficent between genetic diversity and environment factors
注:h:单倍型多样性;π:核苷酸多样性;*:0.01 Note:h:haplotype diversity;π:nucleotide diversity;*:0.01 Canoco 4.5软件的结果来看(图2),塔里木马鹿线粒体DNA Cytb的核苷酸多样性指标(π)的箭头与表示年均气温(QW)、纬度(WD)、海拔(HB)和年均降水量(JSH)箭头方向相同,表明这4个环境因子与核苷酸多样性呈正相关;人口(RK)、年均日照(RZH)、年均畜牧数量(XM)、年均耕地面积(GD)、经度(JD)和年均无霜期(WSH)的箭头与塔里木马鹿核苷酸多样性指标(π)的箭头方向相反,表明以上因子与核苷酸多样性呈负相关。根据箭头的长短可知环境因子对塔里木马鹿遗传多样性的相关程度。其中年均气温(QW)和人口(RK)与塔里木马鹿遗传多样性的相关性最高;经度(JD)与塔里木马鹿遗传多样性的相关性最低。 Canoco 4.5软件的结果来看(图2),天山马鹿线粒体DNA Cytb的核苷酸多样性指标(π)的箭头与年均降水量(JSH)、海拔(HB)、纬度(WD)和年均无霜期(WSH)的箭头方向相同,表明这4个环境因子与核苷酸多样性呈正相关;与年均气温(QW)、人口(RK)、年均畜牧数量(XM)、年均耕地面积(GD)、年均日照(RZH)和经度(JD)的箭头方向相反,表明以上因子与核苷酸多样性呈负相关。根据箭头的长短可知与海拔(HB)和年均降水量(JSH)相关性最大;与经度(JD)相关性最低。 蒙特卡洛里检验的结果来看,显著影响天山马鹿遗传多样性的环境因子分别为海拔(r=0.883,F=7.36,P=0.031)、年均降水量(r=0.789,F=7.44,P=0.045)、年均气温(r=-0.517,F=5.86,P=0.047)和人口(r=-0.780,F=7.821,P=0.048),因此这些环境因子是影响天山马鹿遗传多样性的主要环境因子。 图2 塔里木马鹿(左)和天山马鹿(右)种群遗传多样性与环境因子的RDA分析图Fig.2 The RDA analysis between the Tarim red deer andTianshan red deer genetic diversity and environmental 注:图中红色箭头表示环境因子年均降水量(JSH)、年均气温(QW)、年均日照(RZH)、年均无霜期(WSH)、海拔(HB)、经度(JD)、纬度(WD)、人口(RK)、年均畜牧数量(XM)和年均耕地面积(GD);蓝色箭头表示遗传多样性参数核苷酸多样性(P)、单倍型多样性(h) Note:The red arrow represents the environmental factor,annual precipitation(JSH),annual temperature(QW),annual sunshine(RZH),annual frost free period(WSH),altitude(HB),longitude(JD),latitude(WD),population(RK),average annual animals(XM)and annual cultivated area(GD).Blue arrows represents genetic diversity parameters,nucleotide diversity(P)and haplotype diversity(h) 计算种群的单倍型多样性(h)和核苷酸多样性(π)是准确评价种群遗传多样性的重要参数。马合木提等[9]通过微卫星遗传标记来分析野生塔里木马鹿的遗传多样性,结果表明塔里木马鹿种群的遗传多样性低于北美马鹿的遗传多样性,种群可能正受到近亲繁殖的威胁;董晓宇等[10]基于mtDNA D-Loop区的野生塔里木马鹿种群遗传多样性的研究,结果表明各地理种群的遗传多样性较低,处于不平衡状态。本研究基于mtDNA Cytb基因的野生塔里木马鹿种群遗传多样性的结果来看,具有较高的单倍型多样性和较低的核苷酸多样性,整体遗传多样性还是不平衡,处于较低的水平,这与董晓宇等的结果相一致。种群基因流分析,与董晓宇等的结果比较也有明显的提高,其中且末种群与其他两个种群之间的基因交往有所频繁,这在一定程度上表明了较为独立的且末种群遗传多样性趋向于恢复状态。另一方面表现出我国政府对塔里木河流域生态环境综合治理的有效性,于2000年到2009年进行的塔里木河下游9次应急输水工程成功实现台特玛湖接近30年干枯的环境重新得到滋润[11]。尉犁种群与且末种群之间形成的约320 km的绿色走廊随着塔里木河下游综合治理工程的推动下慢慢恢复,两个种群开始基因交流的表现。 分析环境因子对遗传结构的影响,可以进一步了解生存在特定生态环境中的生物对特定环境的反应机制[12-13]。 从本研究的结果可知,塔里木马鹿和天山马鹿种群遗传多样性与海拔、年均降水量和纬度呈正相关性,其中与海拔和年均降水量呈显著的正相关;与年均气温和采样点人口呈显著的负相关,说明海拔是影响塔里木马鹿和天山马鹿种群遗传多样性的主要环境因素,这与刘艳华等[14]的结果相一致。随着纬度和海拔的升高马鹿种群遗传多样均表现出增加的趋向。这可能是海拔因素引起的气候变化的结果,随着海拔和纬度的升高,相对气温和气压下降,湿度升高[15]。各种气候因子发生的剧烈变化,对塔里木马鹿和天山马鹿的生存会产生影响,导致马鹿遗传结构上的变化。还有可能与马鹿的起源有关,鹿类是天生生活在山地森林地区的动物[16],因此可能喜欢或更适应于湿度高,气温低的环境。采样点人口数量与马鹿种群遗传多样性呈显著的负相关性。虽然很多时候人类活动不能直接影响动物遗传多样性,但是以人为主题的各项活动会间接地影响动物的遗传多样性。1984年到2014年当中马鹿栖息地环境随着人口的增多、大量的开垦耕地和畜牧业的发展等人类活动的频繁,导致了马鹿水资源的短缺和栖息地面积的减少以及片段化,片段化程度的加重会形成马鹿种群独立化,高度独立的种群内会发生近亲交配和遗传票变现象,进一步导致遗传多样性降低。 对马鹿这种警惕性特别强的动物来说,人类活动的影响是必然会有的[17]。苏化龙等的研究结果表明人为因素是影响有蹄类动物生存的关键因子[18];Hartl 等的研究结果表明人类活动在一定程度上影响马鹿种群的遗传多样性[19],本研究的结果支持苏化龙等 和Hartl等的结果。 塔里木马鹿种群遗传多样性与环境因子的RDA分析结果显示(图2),塔里木马鹿种群遗传多样性与年均气温、人口和年均降水量呈显著的相关性,其中与年均气温呈显著的正相关。随着温度适当上升,塔里木马鹿种群遗传多样性均表现出增高的现象。原因可能是野生塔里木马鹿的被毛不多,对低温比较敏感,而且适当的温度变化有利于马鹿体内的酶活性,从而影响相关基因的表达,进而影响表现型。塔里木马鹿在冬季以积雪作为重要的水资源,随着气温升高雪融化随之加快,这为塔里木马鹿提供水资源[20]。塔里木马鹿种群遗传多样性与年均降水量呈显著的正相关,这表明适应于干旱环境的塔里木马鹿随着降水量的增加,可能食物也增多,这对塔里木马鹿种群遗传多样性有利[15]。塔里木马鹿种群遗传多样性与采样点人口呈显著的负相关,塔里木河中下游大面积垦荒,在马鹿栖息地除了马鹿以外的畜牧数量的增加尤其是人类活动的频繁,很大程度地影响塔里木马鹿的生存。本研究所选择的年度塔里木马鹿分布区域内畜牧数量、耕地面积、人类活动不断增加导致遗传多样性的下降。虽然人为因素不能直接影响马鹿遗传多样性的变化,但是它造成的各类后果必然会直接影响马鹿种群数量。这与艾尼瓦尔等[21]研究结果相一致。 天山马鹿种群遗传多样性与环境因子的RDA分析可知(图2),天山马鹿种群遗传多样性与海拔和年均降水量呈显著的正相关;与年均气温和人口呈显著的负相关。此与塔里木马鹿的结果相反,这可能与马鹿生存环境有关。天山马鹿主要分布于高海拔、雨水较多的区域,因此这种特殊的环境使马鹿具备适应这种环境的能力而继续生存。同样塔里木马鹿适应于半干旱少雨环境中,因此出现了马鹿对同一个环境因子的反应有所不同的现象。随着海拔和纬度的升高,相对气温和气压下降,湿度升高,随着海拔的升高天山马鹿种群遗传多样性均趋向于增高,因此年均降水量和气温与天山马鹿种群遗传多样性呈显著的正相关。与人口呈显著的负相关,天山马鹿的采样点(小渠子、白石头、寒气沟)基本上是风景优美的旅游景点区附近,所以人类活动是影响天山马鹿遗传多样性的因素之一[22]。 无论是塔里木马鹿还是天山马鹿,影响马鹿种群遗传多样性的环境因子基本相同。但是年均气温与塔里木马鹿种群遗传多样性呈正相关,而与天山马鹿种群遗传多样性呈显著的负相关,这说明马鹿不同生境中受不同的环境因子的影响。这结果与郝岗平等[23]的研究结果相一致。可能原因是自然选择可以导致不同生境生存的物种遗传多样性的影响模式不同,即选择压力对不同区域的作用也不同[24]。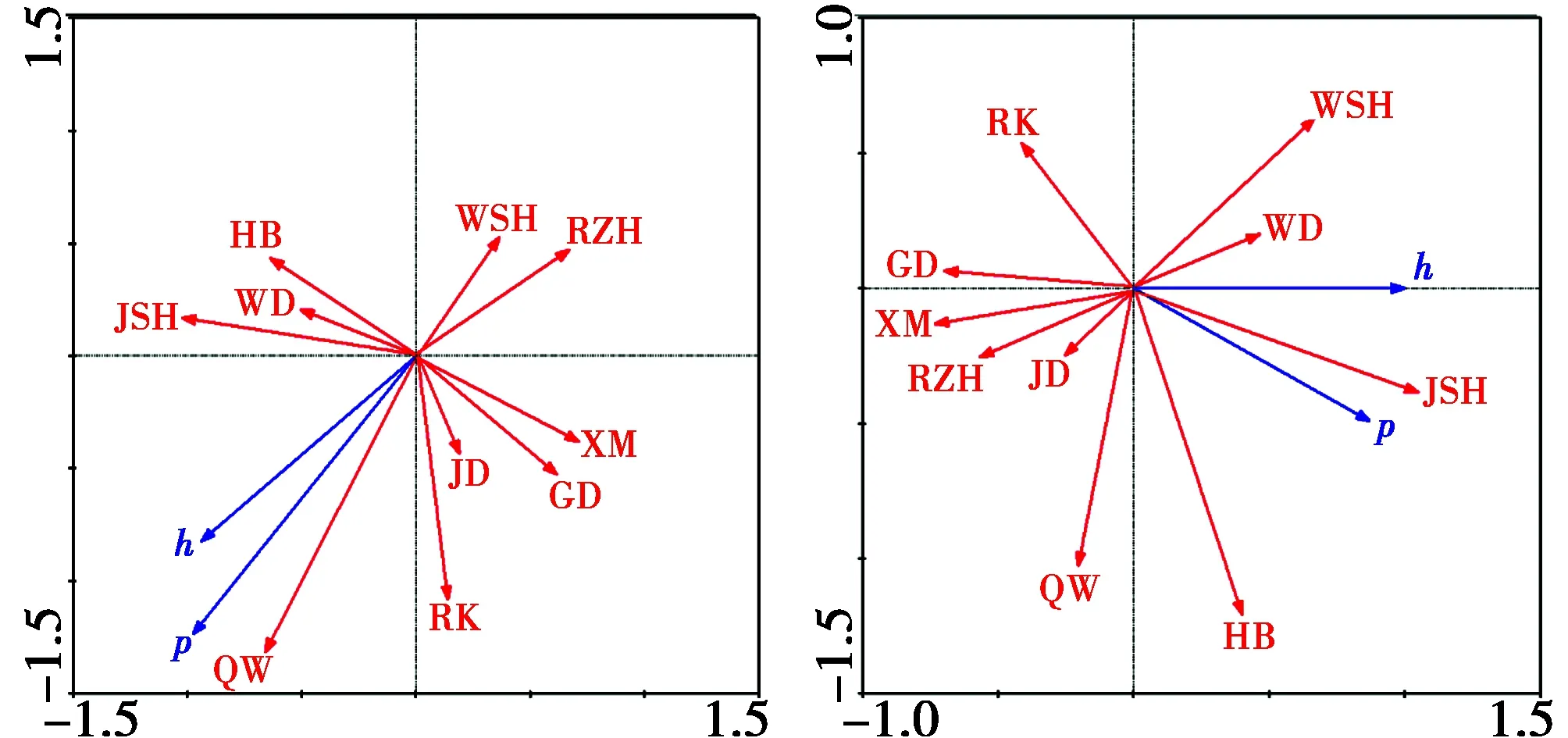
3 讨论
3.1 塔里木马鹿种群遗传多样性
3.2 环境因子对马鹿种群遗传多样的影响
3.3 环境因子对塔里木马鹿种群遗传多样的影响

