灯盏花素联合奥美拉唑治疗急性胰腺炎55例临床观察*
胡 静,孙少华,潘朝辉,李 晓,高伟芳,张 莉
(河北省石家庄市第一医院消化内科,河北 石家庄 050011)
急性胰腺炎(AP)为临床常见急腹症,临床常表现为腹痛、恶心、呕吐、黄疸、脱水、发热等,发展迅速、病情多变[1]。近年来,AP的发病率有逐年增高趋势,病死率达10%[2]。AP患者常伴有不同程度的肠道黏膜屏障受损,导致肠道细菌移位,加重病情,故改善肠道黏膜屏障功能对于AP的治疗具有重要意义[3]。灯盏花素为活血化瘀类药物,具有改善微循环、扩张微血管、抗凋亡等多种作用[4]。奥美拉唑为质子泵抑制剂,能抑制胃蛋白酶分泌,改善胃黏膜血流量[5]。本研究中观察了灯盏花素联合奥美拉唑治疗AP的临床疗效,现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合中华医学会消化病学分会胰腺疾病学组《中国急性胰腺炎诊治指南(草案)》诊断标准[6],即临床表现为急性起病的持续性腹痛,影像学检查显示胰腺有形态上的变化,周围有液体渗出,有水肿,血清淀粉酶水平超过正常值上限的3倍;经腹部B超或腹部CT检查确诊;本研究经我院医学伦理委员会批准,患者对研究知情同意且签署知情同意书。
排除标准:肠道动力障碍性疾病;凝血功能障碍;严重心、肝、肾等疾病;妊娠期或哺乳期;精神类疾病。
病例选择与分组:选择医院2014年5月至2017年5月收治的AP患者109例,按随机数字表法分为对照组(54例)和治疗组(55例),两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。

表1 两组患者一般资料比较
1.2 方法
两组患者入组后均给予常规治疗,包括禁食禁饮、解痉镇痛、持续胃肠减压、抑制胃酸分泌、改善局部微循环、调节水电解质紊乱等。对照组患者将注射用奥美拉唑(阿斯利康制药有限公司,国药准字H20033394,规格为每支40 mg)40 mg溶于0.9%氯化钠注射液5 mL,静脉注射,每次40 mg,每日2次;治疗组患者在对照组患者治疗基础上将灯盏花素(河北神威药业有限公司,国药准字Z13020778,规格为每支20 mg)20 mg溶于5%葡萄糖注射液250 mL,静脉滴注,每日1次。两组均连续治疗14 d。
1.3 观察指标及疗效判定标准
胃肠道功能评分:计0~4分,排便正常、肠鸣音无减弱,评为0分;无自主排便、肠鸣音减弱,评为1分;服用泻药后仍无自主排便、肠鸣音减弱甚至消失,评为2分;灌肠后仍无自主排便、肠鸣音减弱甚至消失,评为3分;采取多种手段后仍无自主排便、肠鸣音消失,评为4 分[7]。
血清炎性因子水平:清晨空腹状态下抽取患者静脉血10 mL,其中5 mL用肝素抗凝,用于肠道黏膜屏障功能相关指标的检测,另外5 mL以3 000 r/min的转速分离上清液,用于血清炎性因子水平的检测。检测并比较两组治疗前后血清白细胞介素6(IL-6)、白细胞介素10(IL-10)、肿瘤坏死因子 -α(TNF-α)、C 反应蛋白(CRP)水平。采用双抗夹心酶联免疫(ELISA)法检测,试剂盒购自上海信裕生物科技有限公司,试验步骤严格按照试剂盒说明书进行操作。
肠道黏膜屏障功能相关指标:检测患者治疗前后外周血 D-乳酸、二胺氧化酶水平及尿乳果糖与甘露醇比值(L/M)。前两者水平均采用紫外分光光度计检测;尿L/M值采用高效液相色谱(HPLC)法检测。
临床疗效[8]:显效为腹痛、恶心、呕吐、黄疸、脱水、发热等临床症状明显好转,血、尿淀粉酶恢复至正常水平;有效为前述临床症状有所改善,血尿淀粉酶有下降趋势;无效为前述临床症状无改善,甚至有所加重。总有效=显效+有效。
安全性:记录并比较两组患者治疗过程中严重不良反应的发生情况。
1.4 统计学处理
采用SPSS 19.0统计学软件分析。计数资料以百分率(%)表示,行 χ2检验;计量资料以±s表示,数据正态分布,方差齐性,采用 t检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表4。两组治疗过程中均无严重不良反应发生,安全性较好。
3 讨论
AP发病机制较复杂,目前大多认为与以下几方面有关:饮酒导致Oddi括约肌痉挛,十二指肠乳头水肿,引起胰液难以排出;暴饮暴食导致乳头水肿,Oddi括约肌痉挛,胰液分泌量增加;胰腺的防御能力减弱;胆汁逆流到胰管内激活胰酶或胆道发生炎症后产生的游离胆酸、细菌毒素、非结合胆红素等扩散至胰腺,激活胰酶;肠道黏膜屏障功能受损,肠黏膜通透性增加,导致肠内内毒素和细菌移位,引发全身性炎性反应,加重病情[9]。因此,抑制胰液分泌和胰蛋白酶原的激活,改善肠道黏膜屏障功能是治疗AP的关键。

表2 两组患者临床疗效比较[例(%)]
表3 两组患者血清炎性因子水平比较(±s)

表3 两组患者血清炎性因子水平比较(±s)
注:与本组治疗前比较,*P<0.05。表4同。
组别IL-6(ng/L) IL-10(ng/L) TNF- α(ng/L) CRP(mg/L)对照组(n=54)治疗组(n=55)t值P值治疗前93.05 ±10.87 92.63 ±9.33 0.217 0.414治疗后56.20 ± 5.45*42.15 ± 4.61*14.541 0.000治疗前71.67 ± 7.15 72.03 ± 7.44 0.257 0.398治疗后52.48 ± 4.35*45.37 ± 3.50*9.410 0.000治疗前83.55 ± 9.36 83.14 ± 10.28 0.218 0.414治疗后64.39 ± 7.48*50.34 ± 6.21*10.678 0.000治疗前85.03 ± 9.62 84.89 ± 8.77 0.079 0.468治疗后55.47 ± 6.39*41.15 ± 6.08*11.988 0.000
表4 两组患者胃肠道功能相关指标比较(±s)
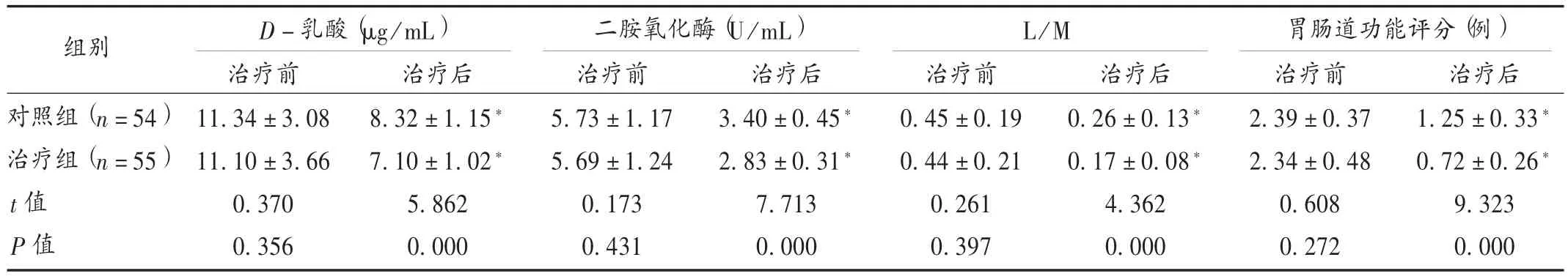
表4 两组患者胃肠道功能相关指标比较(±s)
组别D-乳酸(μg/mL) 二胺氧化酶(U/mL) L/M 胃肠道功能评分(例)对照组(n=54)治疗组(n=55)t值P值治疗前11.34 ± 3.08 11.10 ± 3.66 0.370 0.356治疗后8.32 ± 1.15*7.10 ± 1.02*5.862 0.000治疗前5.73 ± 1.17 5.69 ± 1.24 0.173 0.431治疗后3.40 ± 0.45*2.83 ± 0.31*7.713 0.000治疗前0.45 ±0.19 0.44 ±0.21 0.261 0.397治疗后0.26 ± 0.13*0.17 ± 0.08*4.362 0.000治疗前2.39 ± 0.37 2.34 ± 0.48 0.608 0.272治疗后1.25 ± 0.33*0.72 ± 0.26*9.323 0.000
奥美拉唑为质子泵抑制剂,半衰期较短,能迅速降低肠壁细胞分泌的H+,K+-ATP酶活性,从而抑制胃酸分泌,减少胰腺的外分泌[10]。灯盏花素为活血化瘀类药物,能降低血液黏度,抑制血小板聚集,扩张局部血管,增加局部血流量,改善微循环,减轻氧化应激,多角度保护组织器官,减轻胰腺损伤,从而治疗AP[11]。
本研究结果显示,治疗组总有效率显著高于对照组(P<0.05),提示灯盏花素联合奥美拉唑治疗AP临床疗效显著。这可能是由于2种药物可从不同方面协同发挥作用,故疗效较好[12]。两组治疗后胃肠道功能评分及外周血 D-乳酸、二胺氧化酶水平和尿L/M值均明显低于治疗前,且治疗组明显低于对照组(P<0.05),提示联合治疗能明显改善AP患者的肠黏膜屏障功能。D-乳酸、二胺氧化酶及尿L/M值均临床用于评估肠道黏膜屏障功能的常见指标[13]。灯盏花素能纠正缺血状态,提高组织对缺氧的耐受性,从而改善胰腺微循环,保护胰腺组织,还能促进多种生物酶和维生素的合成,提高吞噬细胞的活性,改善胃肠道功能[14]。奥美拉唑能抑制由食物等刺激导致的胃酸分泌和基础胃酸分泌,从而减轻对肠黏膜的损伤,有利于肠黏膜功能的恢复[15]。本研究结果显示,两组患者治疗后血清炎性因子水平均明显低于治疗前,且治疗组明显低于对照组(P<0.05),提示联合治疗能明显减轻AP患者的炎性反应。炎性因子会引起肠道黏膜屏障的损害,在AP的发生和发展中有重要作用[16]。灯盏花素能改善微循环,降低血清炎性因子水平,从而改善炎性反应,有助于病情改善[17]。两组治疗过程中均无严重不良反应发生,提示灯盏花素联合奥美拉唑治疗AP安全性较好。
综上所述,灯盏花素联合奥美拉唑治疗AP临床疗效显著,能明显改善肠黏膜屏障功能,减轻炎性反应,且安全性较好,值得临床推广。

