一种适用于甜菜大规模快速提取DNA的方法
闫彩燕 ,邹奕 ,吴则东 ,兴旺 ,李红侠 *
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院甜菜研究所/黑龙江大学农作物研究院,哈尔滨150080;3.中国农业科学院北方糖料作物资源与利用重点开放实验室,哈尔滨150080)
甜菜原产于地中海沿岸,是世界上第二大糖源作物,仅次于甘蔗。随着分子标记技术在甜菜育种中的广泛应用,目前甜菜的基因组全序列测定工作已经完成[1],为甜菜的遗传多样性分析、分子标记辅助育种、转基因甜菜培育等工作打下了扎实的基础[2-8]。而这些实验都需要大批量的DNA,因此如何快速高效地提取DNA成为了提高实验效率的关键,用传统方法大规模提取DNA费时费力,操作复杂等问题日益突出,因此寻找一种适用于甜菜大规模快速提取DNA的方法十分重要。目前关于各种植物DNA提取方法尝试的报道已有很多,近期的如Biswas等[9]尝试了一种不使用液氮进行植物DNA提取的方法;Dang等[10]报道了一种能从花生和其他含油种子中快速提取DNA和RNA的方法;Takakura等[11]报道了一种利用蔗糖缓冲液和玻璃纤维过滤器从植物组织中提取DNA的方法;Shi等[12]报道了一种使用滤纸、96孔板和自制无毒缓冲液相结合的高通量提取植物DNA的方法;李委等[13]报道了一种适用于辣椒的DNA快速提取技术;芮文婧等[14]报道了一种改进的番茄叶片DNA提取方法并优化了SSR反应体系。目前实验室常用的传统DNA提取方法为使用液氮冷冻样品然后进行研钵研磨,但这种方法提取的效率较低,研钵研磨较慢,而且样品容易损失,难以适应大批量DNA提取的需求。因此对于普通实验室来说,一种快速高效低成本的大批量植物DNA提取方法十分必要。经我们的实验证明利用液氮处理和震荡研磨机相结合可以快速高效地提取甜菜基因组DNA,提高甜菜分子标记辅助育种和遗传多样性分析的效率。
1 实验材料和方法
1.1 实验材料
实验中所用到的甜菜样本均来自于中国农科院甜菜研究所试验田田间取样,共取两个甜菜品种:BETA176、MA3001,每个品种取24个个体,共48个样本。
在田中取样时,取号的鲜样直接装入事先已放好一枚7 mm小钢珠的2 mL离心管中。装样之后马上将离心管放入放有多个冰袋的保温箱中,带回实验室后,马上放入-80℃冰箱中保存。
1.2 实验方法
1.2.1 DNA提取方法 将装有样品的离心管从-80℃冰箱中取出,马上放入到液氮当中,待液氮不再发出声音之后,迅速放到研磨机中以30次/s的振荡频率振荡2 min;振荡之后加入800 μL CTAB缓冲液,使用金属浴65℃干浴1 h之后置于冰箱保鲜层冷却至15℃以下;加入400 μL 24∶1的氯仿/异戊醇,上下混匀后放置5 min以上,之后使用高速离心机12 000 r/min离心10 min;取上清液400 μL,装入新的离心管中,加入400 μL异丙醇,上下混匀;放入冰箱保鲜层静置30 min以上;使用高速离心机12 000 r/min离心10 min,弃掉上清液;使用70%乙醇润洗后,放于室温下待乙醇挥发干净,加入100 μL TE缓冲液溶解DNA。
1.2.2 基因组DNA检测 本次实验中,我们使用微量分光光度计和SSR分子标记两种方法检测。微量分光光度计只需1 μL DNA原液即可检测出DNA浓度和OD260/280比值。SSR分子标记检测时,将所得DNA原液稀释为10 ng/μL后,使用两种INDEL引物扩增,PCR体系和程序来自于文献[15],检测方法采用银染法[16]。
2 结果与分析
2.1 微量分光光度计检测结果
微量分光光度计检测样品DNA的浓度和OD260/280,结果见表1。结果证明使用该方法提取出的DNA浓度较高,OD260/280的比值在1.84~2.02之间,纯度较好,达到实验预期。
2.2 INDEL扩增产物电泳结果
利用两个INDEL引物对两个品种共48个样品的DNA进行PCR扩增,扩增后使用浓度为8%的PAGE胶进行快速银染,所得结果见图1、图2。从图1、图2可知,该种新的DNA提取方法所得DNA可用于甜菜INDEL分子标记。
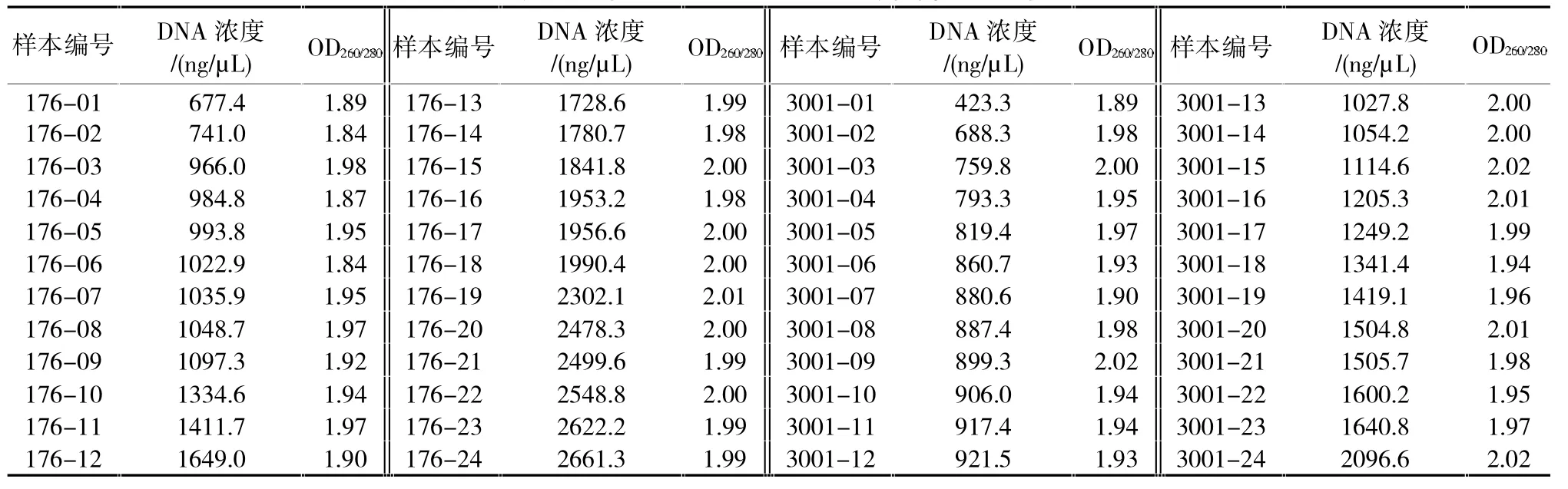
表1 样品DNA紫外分光光度计检测结果
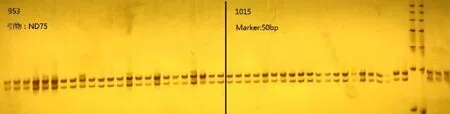
图1 引物ND75对甜菜样本的PCR扩增结果

图2 引物ND229对甜菜样本的PCR扩增结果
3 结论
文中所述的甜菜DNA提取方法主要改进之处在于使用振荡研磨机和钢珠代替了手工研磨钵研磨,将甜菜样品直接放于离心管中,研磨后直接加入CTAB,减少了样品的损失。极大地节省了人力和时间,提高了整个实验约30%的效率,并且所得DNA在浓度与纯度检测和PCR扩增中表现良好。因为影响DNA提取效果的两个主要因素为样品研磨是否精细和实验过程样品应避免反复冻融[17]。本方法利用振荡研磨机的高速振荡和钢珠的配合可保证样品研磨的精细度,同时也最大程度地避免了样品的反复冻融。随着分子标记技术的广泛应用,大规模多数量的DNA提取已成为实验室常态,在这种情况下,本方法可为植物基因组DNA的提取提供一种新的思路和途径。

