PSMD7基因在人食管鳞癌组织中的表达及影响癌细胞增殖、凋亡的机制研究
张进忠,石 科,2,郭 丹,杨 亮,闫秀明
1.河南医学高等专科学校生物化学教研室,河南 郑州 451191;
2.郑州大学细胞生物研究室,河南 郑州450008
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是一个高度复杂的维持蛋白质平衡和细胞活性的体系,通过选择性周转目标底物来调节细胞内许多蛋白的稳定,因此UPS参与细胞的多种功能[1],如细胞的增殖、凋亡、血管生成和运动,以及肿瘤的发生、发展[2]。
19S蛋白酶体中有4个去泛素化酶亚基,其中26S蛋白酶体非ATP酶调节亚基7(26S proteasome non-ATPase regulatory subunit 7,PSMD7)和26S蛋白酶体非ATP酶调节亚基14(26S proteasome non-ATPase regulatory subunit 14,PSMD14)是JAMM家族的去泛素化酶,位于19S蛋白酶体中[3]。对完整的19S蛋白酶体组织结构学分析表明,在组成盖子亚复合体的9个亚基中,PSMD7位于中央核心部位,同时和其他4个亚基相结合[4],说明PSMD7在形成19S蛋白酶体结构中起重要作用。PSMD7作为组成19S蛋白酶体结构中的核心成员是否参与肿瘤的发生、发展,以及其具体的分子机制尚不清楚。前期工作中,我们已经证实了PSMD7在食管鳞癌细胞EC9706和Eca109中呈高表达[5]。因此,本研究通过实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白质印迹法(Western blot)检测食管鳞癌及其癌旁正常组织标本中PSMD7的mRNA及蛋白表达情况。在食管鳞癌细胞TE-1中,用慢病毒介导的RNA干扰技术下调PSMD7的表达,观察细胞增殖及凋亡的变化,建立PSMD7表达量与肿瘤恶性程度之间的关系,为进一步确定PSMD7作为肿瘤治疗的靶点提供依据。
1 材料和方法
1.1 材料
1.1.1 主要试剂
TRIzol购自美国Invitrogen公司,RNA逆转录试剂盒和SYBR Green购自宝生物工程(大连)有限公司,蛋白提取试剂盒购自美国Solarbio公司,鼠抗人PSMD7单克隆抗体、鼠抗人GAPDH单克隆抗体和免疫组织化学SP试剂盒购自美国Santa Cruz Biotechnology公司,Western blot相关试剂和JC-1线粒体膜电位检测试剂盒购自美国Solarbio公司,CCK-8试剂盒购自美国Beyotime Inst Biotech公司,Annexin V-APC/7-AAD凋亡检测试剂盒购自美国KeyGEN Biotech公司,细胞质和线粒体蛋白质提取试剂盒购自生工生物工程(上海)股份有限公司。
1.1.2 标本来源
本研究所采用的30例标本均采自河南医学高等专科学校附属医院2016—2017年间未经放疗和化疗的食管鳞癌手术患者,其中男性17例,女性13 例,年龄35~72岁(平均52.4岁)。手术后立即将新鲜标本进行液氮冻存,每例标本均取癌组织及其癌旁组织(距原发灶边缘5 cm以上)。所有标本均经病理学检查确诊为食管鳞状细胞癌。
1.2 方法
1.2.1 RTFQ-PCR检测PSMD7的基因表达
采用TRIzol提取组织标本的总RNA,mRNA逆转录试剂盒合成cDNA,分别用PSMD7和GAPDH进行RTFQ-PCR检测。PSMD7引物:上游5’-CTGTCGTGAGCTGAGATC-3’;下游5’-TCTCAGATTCAAGTGATC-3’。GAPDH引物:上游5’-AGGTGAAGGTCGGAGTCA-3’;下游5’-AGGGGTCATTGATGGCAACA-3’。反应体系20 μL,在实时荧光定量PCR仪器ABI Q7上设置如下反应条件:94 ℃预变性10 min,94 ℃变性15 s,60 ℃退火延伸32 s,共30个循环,采用2-ΔΔCt法计算基因相对表达量。
1.2.2 Western blot检测PSMD7蛋白水平
提取临床食管鳞癌和癌旁正常食管组织标本的蛋白质,或离心收集细胞并提取总蛋白。检测细胞质中Cyt C的表达时,首先用细胞质蛋白提取试剂盒提取细胞质总蛋白,二辛可酸法(bicinchonininc acid,BCA)法测定蛋白浓度,每个标本取20 μg蛋白进行SDS-PAGE,电泳结束后进行湿转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜上,用5%脱脂奶粉对膜进行4 ℃过夜封闭,然后将膜与一抗(PSMD7单克隆抗体,1∶1 000;GAPDH单克隆抗体,1∶2 000;Cyt C单克隆抗体,1∶2 000;cleaved caspase 3单克隆抗体,1∶2 000;cleaved caspase 9单克隆抗体,1∶2 000;PARP单克隆抗体,1∶2 000;Bax单克隆抗体,1∶2 000;Bcl-2单克隆抗体,1∶2 000)4 ℃温育过夜,用TBST洗膜3次,每次5 min。再与辣根过氧化物酶标记的二抗(1∶3 000)室温下温育1 h,TBST洗膜3次,每次5 min,用ECL发光液进行显影,计算相对灰度值表示蛋白的相对水平。
1.2.3 慢病毒介导的shRNA干扰PSMD7的表达与细胞增殖能力和凋亡的检测
本研究设计4条动力学参数较优的RNA干扰靶点,采用Scramble序列(5’-TTCTCCGAA CGTGTCACGT-3’)作为阴性对照(negative control,NC)。采用HEK-293T细胞进行慢病毒包装,收集病毒后用polybrene感染人食管鳞癌细胞系TE-1,转染72 h后用RTFQ-PCR和Western blot检测PSMD7的表达量。选择效率最高的RNA干扰靶点进行后续实验(表1)。
将干扰PSMD7表达慢病毒(PSMD7-LV-shRNA)和阴性对照慢病毒(NC-LV-shRNA)感染食管鳞癌细胞TE-1,然后用嘌呤霉素(puromycin)筛选阳性感染细胞,将细胞接种在96孔板上,培养至融合度达80%~90%,每孔加入10 µL CCK-8溶液,放入培养箱中继续培养,4 h后用酶标仪检测450 nm处的吸光度(D)值,计算抑制PSMD7表达后TE-1增殖能力的变化。
将慢病毒干扰的阳性细胞接种在6孔板上,培养至融合度达80%~90%,胰酶消化后加入Annexin Ⅴ-PE和7-AAD对细胞进行双染,采用流式细胞术测定细胞的凋亡情况。
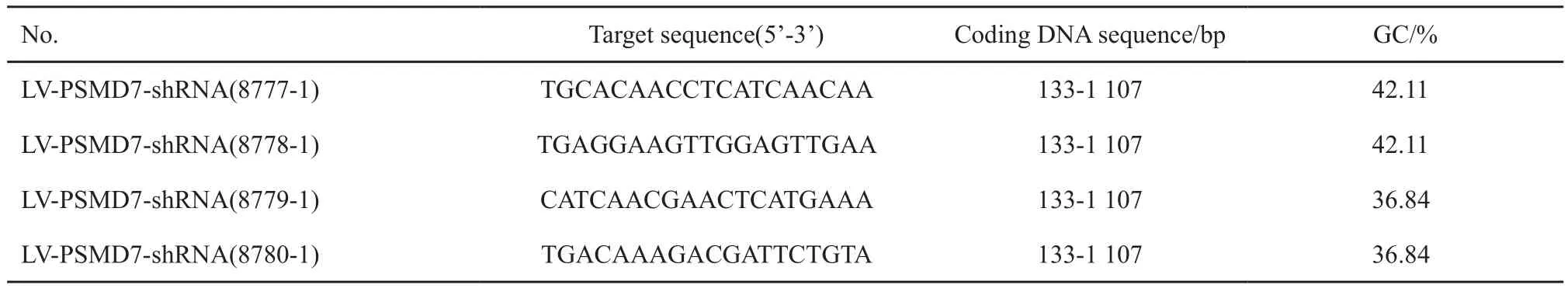
表 1 PSMD7 shRNA靶点序列Tab. 1 Targeting sequence of PSMD7 shRNA
1.2.4 细胞线粒体膜电位的测定
采用JC-1线粒体膜电位检测试剂盒检测未感染组、对照组和干扰组的线粒体膜电位。具体方法参照说明书,收集细胞,加入JC-1溶液混匀后置37 ℃、CO2体积分数为5%的培养箱中培养15 min之后离心,离心速率为10 000×g,离心5 min收集细胞,加入2 mL膜电位检测缓冲溶液,混匀后离心弃上清液,再加入1 mL 膜电位检测缓冲溶液混匀,采用流式细胞术进行分析。红色荧光标记正常细胞线粒体,表示膜电位正常,绿色荧光标记凋亡细胞线粒体,表示膜电位降低。
1.2.5 统计学处理
采用SPSS 19.0软件进行统计学分析,其中两组之间的比较,每个样本数据用x±s表示,采用t检验分析,PSMD7蛋白表达和临床病理因素的相关性采用Spearman分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PSMD7在食管鳞癌组织中的表达
30例临床食管鳞癌和癌旁正常食管组织标本中PSMD7的mRNA表达量见图1A,73.3%(22/30)的标本中PSMD7的mRNA呈现高表达,且PSMD7 mRNA在食管鳞癌和癌旁正常食管组织标本中的表达差异有统计学意义(P<0.05),说明大多数食管鳞癌组织中PSMD7的mRNA表达增高。
采用Western blot对食管鳞癌标本中PSMD7蛋白的表达进行检测,结果显示,70%(21/30)的食管鳞癌标本中PSMD7蛋白呈高表达,与癌旁正常组织相比,PSMD7在食管鳞癌组织中的表达显著升高(P<0.05,图1B)。PSMD7蛋白的高表达与淋巴结转移呈正相关(P<0.05),而与肿瘤分化程度和TNM分期无关(P>0.05,表2)。
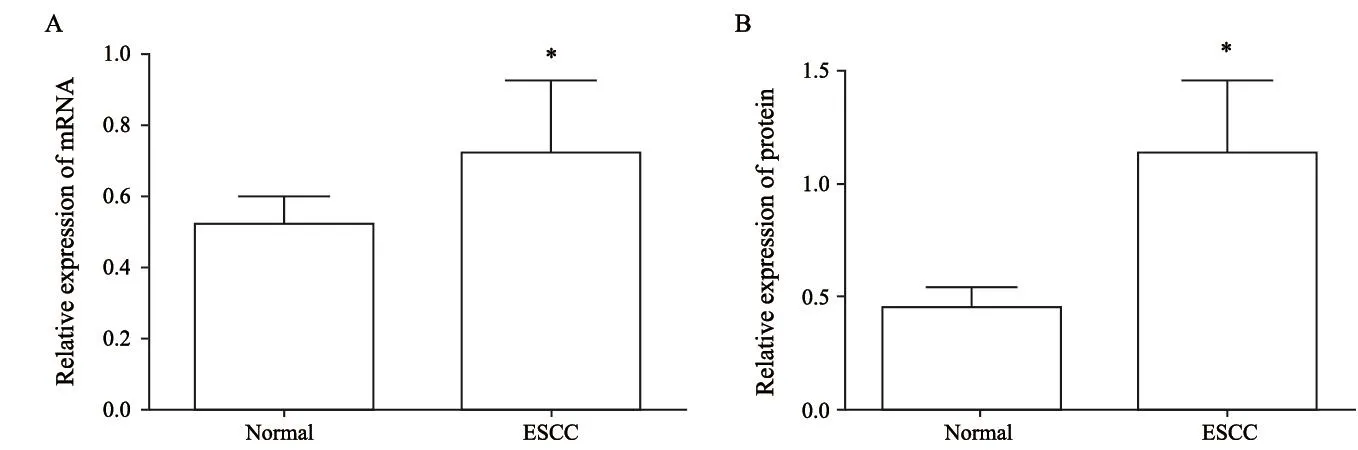
图 1 食管鳞癌组织中PSMD7的表达Fig. 1 Expression of PSMD7 in esophageal squamous cell carcinoma (ESCC) and paracancerous tissues
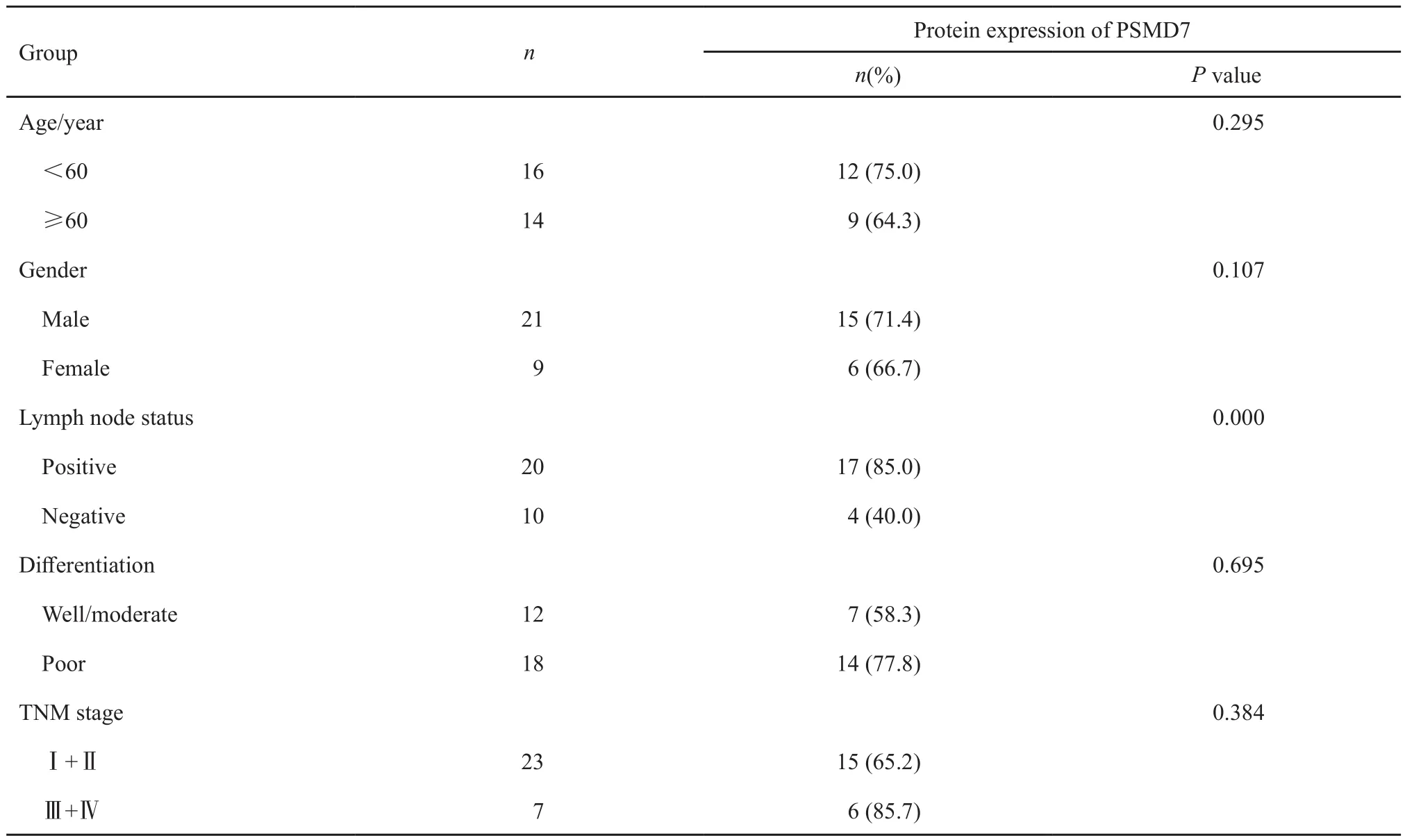
表 2 PSMD7蛋白表达与食管鳞癌组织临床病理特征的相关性Tab. 2 The correlation of PSMD7 expression and ESCC clinical pathological characteristics
2.2 PSMD7表达水平对人食管鳞癌细胞系TE-1增殖能力和凋亡的影响
将PSMD7-LV-shRNA和NC-LV-shRNA感染人食管鳞癌细胞系TE-1后,用puromycin筛选阳性感染细胞(图2A~D)。设计的4种RNA慢病毒干扰序列都能显著降低PSMD7在TE-1中的表达,其中LV-3的敲减效率最高(图2E),因此选取LV-3进行后续实验。Western blot检测结果显示,筛选的PSMD7-LV-shRNA可以显著降低TE-1细胞中PSMD7蛋白的表达(图2F、G)。
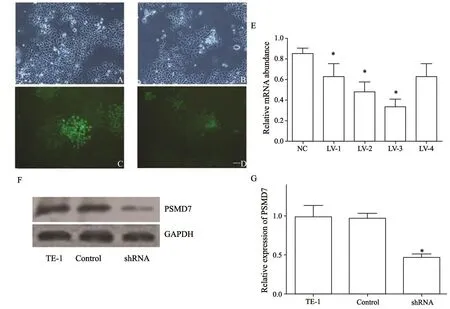
图 2 慢病毒干扰TE-1细胞中PSMD7的表达Fig. 2 Lentiviral-mediated RNAi suppressed mRNA expression of PSMD7 in TE-1 cells
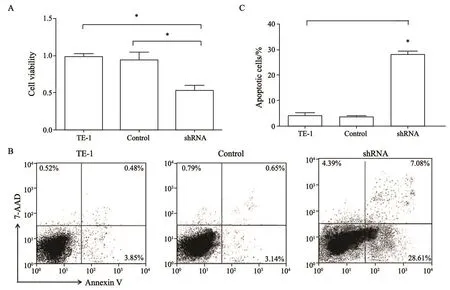
图 3 干扰TE-1细胞中PSMD7的表达抑制细胞增殖并促进细胞凋亡Fig. 3 Cell proliferation was decreased and apopotosis was induced when PSMD7 expression was inhibited in TE-1 cells
通过CCK-8方法检测干扰PSMD7的表达后TE-1细胞增殖能力的变化,结果显示,PSMD7干扰组的细胞增殖能力显著低于对照组(图3A),说明抑制PSMD7的表达可以降低TE-1细胞的增殖能力。流式细胞术检测细胞凋亡结果发现,PSMD7干扰组的细胞凋亡率为28.1%(3次取平均值),显著高于对照组和未转染组(图3B和3C),说明抑制PSMD7的表达可以诱导TE-1细胞的凋亡。
2.3 干扰PSMD7的表达对TE-1细胞线粒体膜电位和Cyt C的影响
细胞线粒体膜电位测定结果显示(图4A),未处理组TE-1细胞和对照组细胞的绿色荧光的比例为2.8%和3.1%,而PSMD7干扰组为37.5%,说明在TE-1细胞中抑制PSMD7的表达后线粒体的膜电位显著降低。我们用Western blot进一步检测了细胞质中Cyt C的表达,结果显示,与未处理组TE-1细胞和对照组相比,shRNA组细胞质中Cyt C的表达量显著升高(图4B和4C),说明抑制PSMD7的表达增加了线粒体膜的通透性,促进Cyt C从线粒体进入细胞质,表明PSMD7可能通过线粒体途径诱导TE-1细胞凋亡。

图 4 干扰PSMD7的表达对TE-1细胞线粒体膜电位和Cyt C的影响Fig. 4 Effects of PSMD7 inhibition on mitochondrial membrane potential and Cyt C expression in TE-1 cells
2.4 干扰PSMD7的表达对凋亡相关蛋白表达的影响
抑制PSMD7的表达后,我们检测了促细胞凋亡蛋白caspase-3、caspase-9和PARP的活性降解产物的表达,结果显示,与对照组相比,干扰组中cleaved caspase-3和cleaved caspase-9的表达显著增高,其中cleaved caspase-3增加2.3倍,cleaved caspase-9增加2.0倍(图5A和5B)。此外,我们检测了凋亡标志物PARP的表达和裂解情况,PSMD7干扰组的PARP发生裂解,而未转染组和对照组未见PARP的裂解(图5C)。
促凋亡因子Bax和抗凋亡因子Bcl-2在细胞内的表达水平与线粒体膜的敏感性密切相关[6]。我们的研究表明,在TE-1细胞中抑制PSMD7的表达使线粒体膜电位增高,膜通透性增强,Cyt C从线粒体释放进入细胞质,我们进一步检测了这些变化是否影响Bax和Bcl-2在细胞内的表达。结果显示(图6),干扰PSMD7的表达后Bax的表达增高,Bcl-2的表达下降,与对照组相比,Bax/Bcl-2的比值增加了1倍左右,说明抑制PSMD7通过线粒体依赖的方式诱导细胞凋亡。
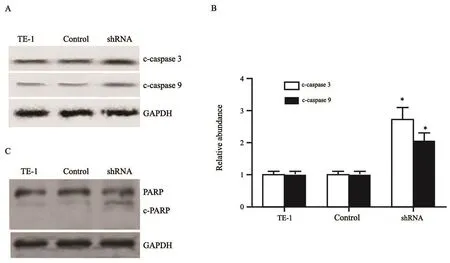
图 5 干扰PSMD7的表达对凋亡相关蛋白表达的影响Fig. 5 Effects of PSMD7 inhibition on the expression of apopotosis-related protein in TE-1
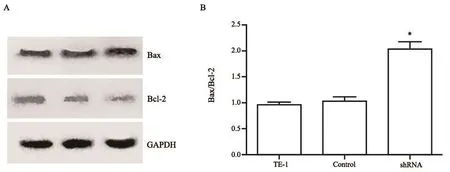
图 6 干扰PSMD7的表达对Bax和Bcl-2表达的影响Fig. 6 Effects of PSMD7 inhibition on the expressions of Bax and Bcl-2 in TE-1
2.5 Caspase抑制剂对PSMD7诱导TE-1细胞凋亡的影响
本研究采用Caspase抑制剂z-VAD-fmk处理TE-1细胞抑制Caspase的活性,结果显示(图7),z-VAD-fmk使干扰组的细胞活力从53%增加至84%,而抑制PSMD7引起的凋亡细胞从25.5%降为15.2%,差异有统计学意义(P<0.05),进一步说明抑制PSMD7的表达诱导的细胞凋亡是通过线粒体依赖的方式进行的。
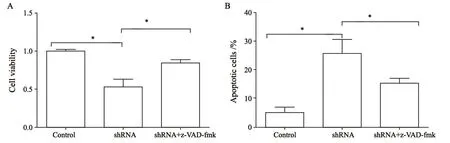
图 7 Caspase抑制剂对PSMD7诱导TE-1细胞增殖和凋亡的影响Fig. 7 Effect of caspase inhibitor on cell proliferation and induction of apopotosis after PSMD7 inhibition in TE-1 cells
3 讨 论
20S蛋白酶体的抑制剂硼替佐米被用来治疗多发性骨髓瘤和淋巴瘤,但易产生耐药,且对实体瘤的治疗效果差[7]。研究显示,19S蛋白酶体中的去泛素化酶参与肿瘤的发生、发展并可以作为肿瘤治疗的靶点,如一些去泛素化酶对肿瘤细胞活力是必需的,通过改变凋亡因子的表达来促进细胞的生存,它们的表达和肿瘤的恶性程度相关[8]。在本研究的前期工作中,我们已经证实PSMD7在食管鳞癌细胞EC9706和Eca109中高表达,且定位发生改变。慢病毒介导的shRNA干扰PSMD7的表达可以降低食管鳞癌细胞的蛋白酶体活性,使泛素化蛋白在细胞内发生聚集[5]。本研究以临床采集的肿瘤标本为研究对象,发现73.3%的标本中PSMD7的mRNA呈高表达,70%的标本中PSMD7蛋白呈高表达,并且其高表达与淋巴结转移呈正相关,而与肿瘤的分化程度和TNM分期无关。这些结果表明PSMD7的过表达在食管癌发生、发展中可能起着重要的作用,因此我们对PSMD7在食管癌发生、发展中的作用机制进行了深入的研究。
研究显示,shRNA干扰PSMD7的表达增加了依赖泛素的GFP报告基因的荧光强度,并导致细胞死亡,和蛋白酶体抑制剂MG132处理细胞得到的结果类似[9]。本研究用慢病毒介导的RNA干扰来抑制TE-1细胞中PSMD7的表达,发现使细胞的增殖能力下降并且诱导了细胞的凋亡,这些现象和蛋白酶体抑制剂的作用类似。对PSMD7的结构分析显示,JAMM结构域是一个非金属的无等位酶活性的结构[10],说明PSMD7可能不直接水解多泛素化蛋白链。然而PSMD7却同时和其他4个亚基相结合,并位于中央核心部位[4],说明PSMD7在形成19S蛋白酶体lid结构中起重要作用。因此抑制PSMD7的表达有可能影响19S蛋白酶体的组装,并影响其识别和水解多泛素化链的功能。我们的前期研究已表明,抑制食管鳞癌细胞中PSMD7的表达使细胞内泛素化蛋白增加,泛素的荧光增强,并且蛋白酶体的活性降低[5],说明PSMD7参与维持蛋白酶体的正常功能,因此在TE-1细胞中抑制PSMD7的表达得到了类似抑制蛋白酶体活性的结果。
线粒体是细胞的能量工厂,是参与细胞凋亡的重要细胞器,在凋亡早期即出现结构和功能的改变。在外界因子的刺激下,细胞内首先会发生线粒体膜通透性增加,体现在膜电位下降,使Cyt C释放进入细胞质,激活一系列caspase级联反应,从而引起细胞核发生凋亡。促凋亡因子Bax可以插入线粒体外膜上诱发线粒体导致的细胞凋亡,抗凋亡因子Bcl-2通过稳定线粒体膜电位的方式使细胞避免进入凋亡通路[11]。本研究抑制PSMD7的表达后观察到细胞增殖能力下降并诱导细胞凋亡,接着我们研究了这种凋亡是否通过线粒体依赖的方式进行。结果发现,抑制PSMD7的表达后TE-1细胞的线粒体膜电位显著降低,细胞质中Cyt C的表达量显著升高,说明抑制PSMD7的表达增加了线粒体膜的通透性,并促进Cyt C从线粒体进入细胞质。此外,PSMD7干扰组中cleaved caspase-3和cleaved caspase-9的表达显著增高,凋亡标志物PARP发生裂解,而未转染组和对照组未见PARP的裂解。干扰PSMD7的表达后,Bax的表达增高,Bcl-2的表达下降,与对照组相比,Bax/Bcl-2的比值增加了1倍,说明PSMD7通过线粒体途径诱导TE-1细胞凋亡。Caspase抑制剂z-VAD-fmk使干扰组的细胞活力恢复,而抑制细胞的凋亡,进一步说明抑制PSMD7的表达诱导的细胞凋亡是通过线粒体依赖的方式进行的。
本实验结果表明,PSMD7在食管鳞癌标本中呈高表达,参与了食管癌的发生、发展。进一步的机制研究表明,抑制PSMD7使TE-1细胞的增殖能力下降,并诱导细胞凋亡,其机制是以线粒体依赖的方式进行的。本研究为进一步确定PSMD7作为食管鳞癌治疗的靶点提供了依据。

