多花黄精组培育苗技术
陈龙胜, 董先茹, 蔡群兴, 刘玉军, 陈瑞瑞
(1.安徽省科学技术研究院,安徽合肥 230031; 2.安徽省应用技术研究院,安徽合肥 230088; 3.安徽农业大学,安徽合肥 230036)
多花黄精(PolygonatumcyrtonemaHua)别称九华黄精,系百合科黄精属多年生草本植物。黄精以根状茎入药,集药用、食用、观赏和美容价值于一身,在研制新药和开发保健品方面具有广阔应用前景[1-3]。多花黄精喜生于缓坡、杂草丛或林下荫地,种质资源分布较广。
九华山地区所产多花黄精品质上佳,有着悠久的历史文化渊源,“九华黄精”已经成为国家地理标志产品。随着九华山旅游产业的快速发展,野生黄精因市场需求量增加而遭大量采挖,使其野生种质资源愈来愈少,生态平衡受到破坏。目前,当地人工栽培主要采用根茎进行无性繁殖,但该方法繁殖系数低,根茎用种量大,既提高了成本,又限制了多花黄精的种植规模,且多代根茎繁殖后会造成病毒的积累和种质的退化[4]。因而,利用植物组织培养技术建立多花黄精快速繁殖体系是生产黄精种苗的有效途径。目前,多华黄精的研究主要集中在其成分测定[5-6]、药理作用[7]、育苗技术[8-11]以及传统人工栽培[12]等方面,而由于种子具有严重的休眠特性,关于种子组织培养方面的研究内容鲜见报道。本试验主要研究打破黄精种子休眠技术,并通过快繁培养扩大种苗规模,进一步进行生根培养诱导生根,最后炼苗完成植株再生全过程,旨在为多花黄精种苗工厂化生产提供科学依据,实现短期内繁殖大量种苗的目的。
1 材料与方法
1.1 材料
2013年10月13日在安徽省青阳县陵阳镇分流村黄精种植试验基地,选取生长健壮、无病虫害的优质黄精单株,收集成熟的果实。果实使用塑料袋密封发酵10 d后,人工搓洗出种子(图1)。
1.2 方法
1.2.1 多花黄精种子休眠的打破 将搓洗后得到的多花黄精种子,用多菌灵浸泡消毒8 h后,再用不同的激素组合浸泡 2 h 打破休眠,设以下处理:(1)300 mg/L GA3+300 mg/L KT;(2)300 mg/L GA3+300 mg/L ZT;(3)300 mg/L GA3+300 mg/L 2-ip;(4)300 mg/L GA3+300 mg/L BA,另设1组无菌去离子水处理组为对照,处理完成后,按种子河沙体积比1 ∶3的比例混匀后,调节湿度至30%,25 ℃条件下催芽,每个处理100粒种子,3次重复,45 d后开始统计种子发芽率和污染率。
1.2.2 组培种芽消毒 催芽完成后,选取生长基本一致、芽长约0.5 cm的多花黄精种芽(图2)作为外植体,使用洗洁精溶液淘洗3遍,流水冲洗4 h,无菌条件下分别使用以下方法做消毒处理:(1)75%乙醇30 s+0.1%氯化汞5 min;(2)75%乙醇 30 s+0.1%氯化汞10 min;(3)75%乙醇30 s+0.1%氯化汞 15 min;(4)75%乙醇+0.1%氯化汞5 min+第2天重复处理1次;(5)75%乙醇+0.1%氯化汞10 min+第2天重复处理1次。消毒完成后,无菌水洗5遍。接种于MS培养基中,每个处理100粒种子,3次重复,于温度25 ℃、16 h光照、光照度1 200 lx条件下培养,7 d后统计污染率,同时进一步观察种芽生长情况(图3)。
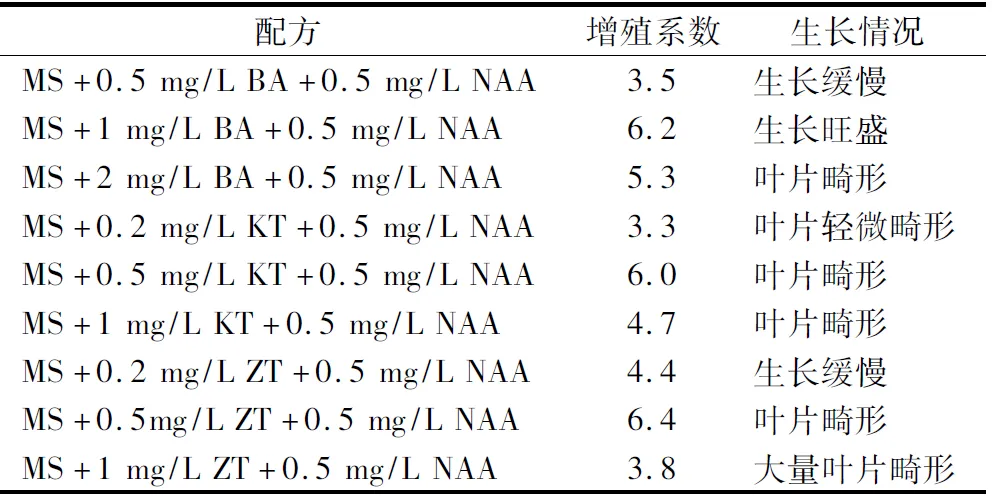
1.2.3 快繁培养 将多花黄精芽在无菌条件下接种入各预先配制的快繁培养基中,快繁培养基设以下处理:(1)MS+0.5 mg/L BA+0.5 mg/L NAA;(2)MS+1 mg/L BA+0.5 mg/L NAA;(3)MS+2 mg/L BA+0.5 mg/L NAA;(4)MS+0.2 mg/L KT+0.5 mg/L NAA;(5)MS+0.5 mg/L KT+0.5 mg/L NAA;(6)MS+1 mg/L KT+0.5 mg/L NAA;(7)MS+0.2 mg/L ZT+0.5 mg/L NAA;(8)MS+0.5 mg/L ZT+0.5 mg/L NAA;(9)MS+1 mg/L ZT+0.5 mg/L NAA;接种完成后,放入温度25 ℃、16 h光照、光照度1 200 lx条件下培养,45 d后统计观察快繁情况(图4)。
1.2.4 生根培养 将快繁后的无菌苗分株,转接入预先配制的生根培养基中,培养基设以下处理:(1)MS+1 mg/L NAA+0.1% AC;(2)MS+2 mg/L NAA+0.1% AC;(3)MS+3 mg/L NAA+0.1% AC; (4)MS+1 mg/L IBA+0.1% AC;(5)MS+2 mg/L IBA+0.1% AC;(6)MS+3 mg/L IBA+0.1% AC;(7)MS+1 mg/L BA+2 mg/L NAA+0.1% AC;(8)MS+1 mg/L BA+2 mg/L IBA+0.1% AC;放入温度 25 ℃、16 h光照、光照度1 200 lx条件下培养,45 d后统计观察生根情况(图5)。
1.2.5 炼苗 待无菌苗在瓶中完成生根,打开瓶盖3 d,使无菌苗初步适应外界环境,使用营养土、蛭石、沙不同的比例配制生根移栽基质,将无菌苗洗净移栽入基质中,每天喷水,保持足够湿度,45 d后统计种苗存活情况(图5)。




2 结果与分析
2.1 不同激素处理对种子休眠的影响
研究发现,在不使用激素的情况下,多花黄精种子的发芽率很低,只有约9.3%,且发芽时间长,发芽不整齐(表1)。这说明多花黄精种子具有较强的休眠性,因而自然条件下多花黄精种子无法用于大量繁殖种苗;不同浓度的激素结合GA3可以有效打破多花黄精种子的休眠,最合适的浓度为300 mg/L GA3+300 mg/L 2-ip的激素处理,其发芽率达到91.7%,基本完成了对种子休眠的打破(表1)。
2.2 种芽消毒方式
研究发现,氯化汞处理时间从5 min提高到15 min,染菌率从68.6%降低到9.3%,但是对种苗的毒害作用也逐渐变大,单独处理的效果并不理想。而使用低剂量、重复次数可以减少对种苗的毒害作用,使用75%乙醇30 s+0.1%氯化汞 5 min+ 第2天重复的处理,可以使种苗的污染率控制在 11.6%,且对种芽伤害最低,种芽在4 d后就可变绿,展出真叶,综合来看,使用75%乙醇30 s+0.1%氯化汞5 min+第2天重复是较为合适的消毒处理方法(表2)。

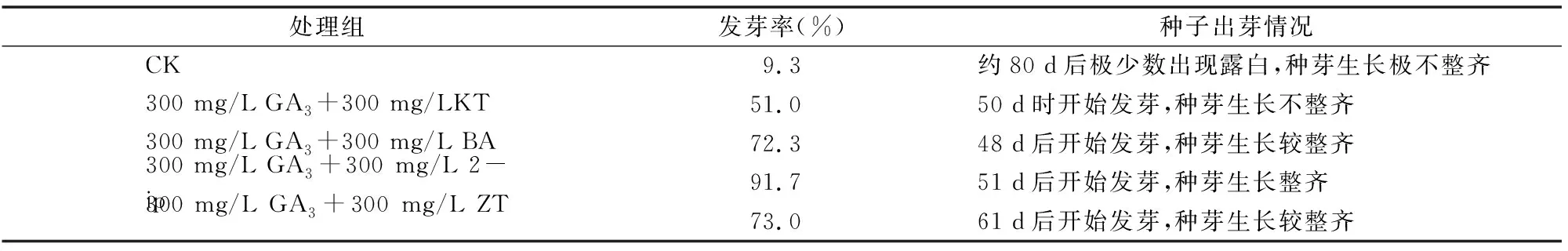
表1 不同激素处理对种子休眠的影响
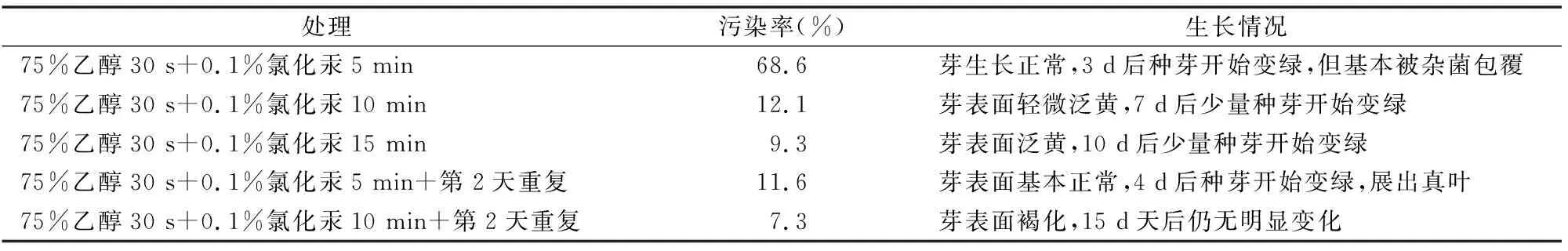
表2 种芽消毒方式对种苗生长的影响
2.3 激素对组培苗快繁的影响
研究发现,将成苗的黄精组培苗转接入不同的快繁培养基中后,黄精种芽组培苗对KT和ZT较敏感,其增殖系数要高于同浓度的BA,但会出现大量畸形叶,即使使用浓度较低仍有较多畸形叶片出现(表3)。因此,使用BA要比KT和ZT更适用于多花黄精种苗,结合增殖系数和组培苗生长情况,最适宜的快繁培养基为:S+1 mg/L BA+0.5 mg/L NAA,此时可以达到较好的增殖系数和组培苗正常的生长。
2.4 激素对组培苗生根的影响
将快繁后的种苗分株接入不同的生根培养基中后发现,NAA对多花黄精组培苗生根效果要好于IBA,而加入少量BA虽然对老叶片发黄有一定抑制作用,但会降低根长和生根数(表4)。因此,综合生根效果和经济性,适宜的生根配方为:MS+2 mg/L NAA+0.1%AC,在此配方下的生根数达到 5.5条,根长达到4.1 cm。
2.5 移栽基质对组培苗炼苗的影响
选取生根基本一致的组培苗进行炼苗处理,依次栽种入不同移栽基质,发现沙比蛭石更适合作为多花黄精炼苗基质,而同时加入沙、蛭石和单独使用沙对种苗存活和生长并无明显差距(表5)。因此,结合植株存活率和经济性,在大规模炼苗生产中应选择泥炭 ∶沙=2 ∶1的移栽基质配方,存活率达到83%以上,能够达到移栽种植多花黄精组培苗的要求。
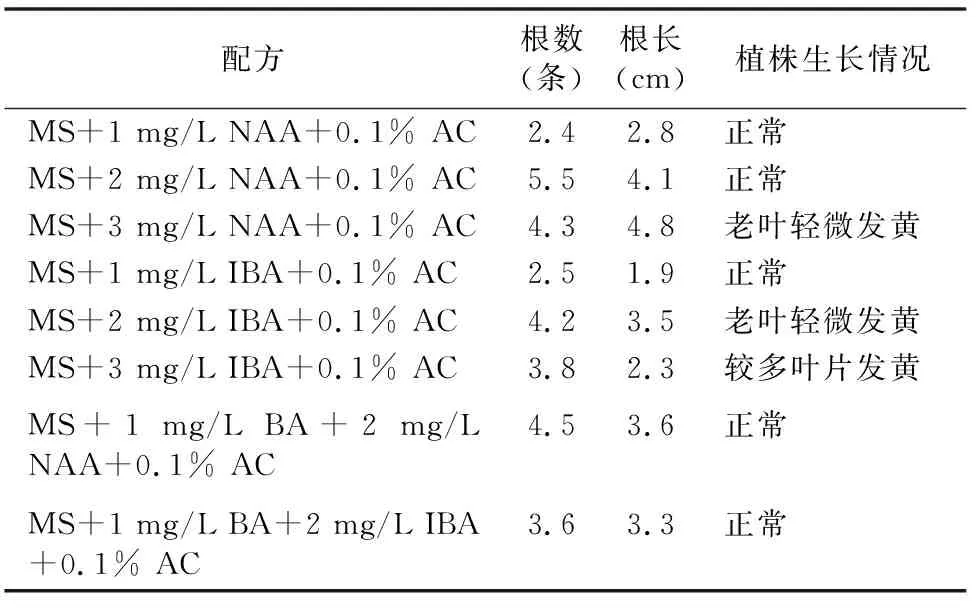
表4 黄精组培苗生根情况
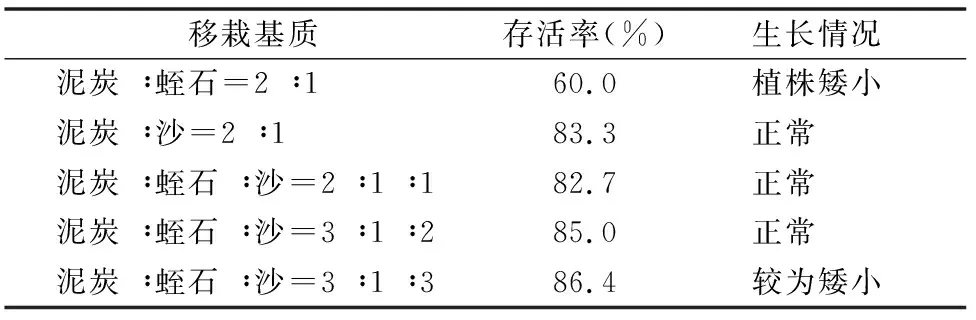
表5 黄精组培苗炼苗情况
3 结论
本研究表明,多花黄精种子在未处理的自然条件下,发芽率仅为9.3%,不适合直接进行育苗。而以300 mg/L GA3+300 mg/L 2-ip的激素处理,其发芽率达到91.7%,达到了大规模育苗的要求,是打破多花黄精种子休眠的最佳方式;最佳外植体处理方法75%乙醇30 s+0.1%氯化汞5 min后并在第2天重复的处理;优选的增殖培养基为MS+1 mg/L BA+0.5 mg/L NAA,生根培养基为MS+2 mg/L NAA+0.1% AC;炼苗移栽基质以泥炭 ∶沙=2 ∶1最佳,成活率可达83%以上。本试验结果将为多花黄精规模化种子育苗、组培育苗和中下游产业开发提供一定技术基础。

