乳腺实性乳头状癌的超声诊断
张韵华,刘利民,夏罕生,俞 清,袁海霞
复旦大学附属中山医院超声科,上海市影像医学研究所,上海 200032
乳腺实性乳头状癌(solid papillary carcinoma,SPC)是一种少见的特殊类型的乳腺乳头状病变,包括原位癌及浸润性癌,以往未被独立分类,2012版世界卫生组织(World Health Organization,WHO)乳腺肿瘤分类中正式将其独立命名[1]。目前,SPC的超声表现多为个例报道[2-6],未见系列报道。本研究分析了18例经手术后病理学检查证实的SPC患者的超声及病理资料,报道如下。
1 资料和方法
1.1 一般资料
收集复旦大学附属中山医院2011年1月—2016年6月经手术后病理学检查证实的乳腺SPC患者18例,其中右乳12例,左乳6例。患者均为女性,年龄41~83岁,平均年龄(67.2±11.6)岁。肿块大小4~38 mm,平均17.12 mm。12例扪及乳腺肿块,7例出现乳头溢液或溢血。
18例乳腺SPC中,10例为原位癌,4例为原位癌伴局灶微小浸润,4例为浸润性癌,其中2例伴黏液腺癌。免疫组织化学分析显示14个肿块SyN阳性,13个肿块CHG阳性,1个肿块CHG阴性。
1.2 仪器与方法
所有患者均行灰阶及彩色多普勒超声检查,10例行超声弹性成像,3例行超声引导下穿刺活检。使用Hitachi EUB8500、Philips iU22超声诊断仪,探头频率7.5~13.0 MHz。患者仰卧位,首先多切面扫查,记录肿块部位、大小、形态、边界、包膜、内部和后方回声及有无钙化;然后用彩色多普勒血流成像(Color Doppler flow imaging,CDFI)观察肿瘤内部及周围血供,血流程度采取Adler半定量分析[7];最后进入弹性模式,获得实时弹性成像图像,弹性评分采用5分法[8]。
2 结 果
18例患者超声均检出病灶。肿块呈导管内病变或实性病变,其中单发导管内病变4例(图1),病灶大小4~13 mm,平均7.75 mm;多发导管内病灶5例(图2),病灶大小22~38 mm,平均30.40 mm;单发实性肿块9例(图3),病灶大小5~29 mm,平均为12.44 mm。
乳腺SPC的超声表现见表1。83.33%(15/18)肿块呈低回声,11.11%(2/18)呈中等回声,5.56%(1/18)为囊实性团块;61.11%(11/18)肿块形态不规则,38.89%(7/18)呈圆形或卵圆形;38.89%(7/18)肿块后方回声增强,16.67%(3/18)后方回声衰减;55.56%(10/18)肿块内见细小钙化。77.78%(14/18)肿块见中等至丰富彩色血流信号(图2),22.22%(4/18)见少量或无血流信号。肿块血流的阻力指数为0.49~0.84,平均为0.69。5例原位癌及2例原位癌伴微小浸润弹性超声评分为1~2分(图4),3例浸润性癌评分为4分(图5)。
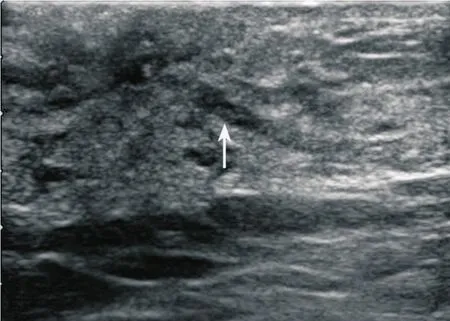
图1 乳腺原位实性乳头状癌超声表现

图2 乳腺实性乳头状癌伴局灶间质微小浸润
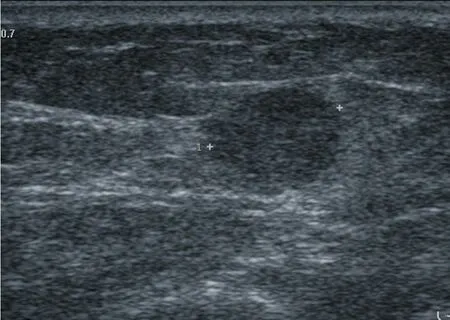
图3 乳腺实性乳头状癌伴浸润

表1 乳腺实性乳头状癌的超声表现(n)
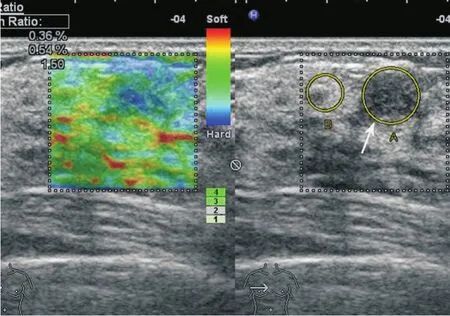
图4 乳腺原位实性乳头状癌弹性成像
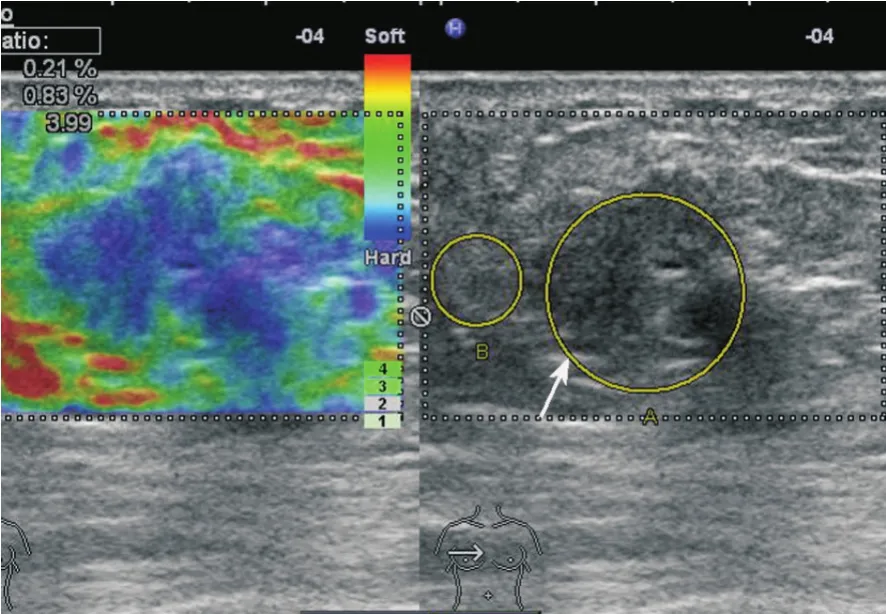
图5 乳腺实性乳头状癌伴黏液腺癌弹性成像
术前超声诊断:4例单发导管内原位癌超声诊断为导管内乳头状瘤,其中2例伴增生;5例多发导管内病灶(2例原位癌、3例原位癌伴微小浸润),4例超声诊断为恶性肿瘤,1例诊断为导管内乳头状瘤;9例单发实性病灶(4例原位癌、1例原位癌伴微小浸润、4例浸润性癌),7例超声诊断为恶性肿瘤,1例原位癌及1例原位癌伴微小浸润诊断为导管内乳头状瘤。
3 讨 论
乳腺SPC是一种少见的乳腺恶性肿瘤。以往未被独立分类,故有众多命名,包括内分泌型导管原位癌、乳头状癌实体变型、导管内乳头状癌实体变型等。2012版WHO乳腺肿瘤分类中,其被单独命名为乳腺SPC,包括原位癌及浸润性癌,归类于乳腺乳头状肿瘤[1]。乳腺SPC肿瘤细胞形态较均一,呈导管内实性片状生长,其中含有纤细的纤维血管轴心,常伴有细胞内外黏液分泌和神经内分泌分化[1-4]。SPC好发于老年女性,大多数>60岁,常见的临床表现为肿块及乳头溢液[2-4]。本组资料中,患者年龄41~83岁,平均67岁,12例患者发现乳腺肿块,7例患者发现乳头溢液或溢血,与文献报道类似。
SPC的超声表现多为个例报道。Muttarak等[5]报道了1例原位SPC,超声表现为扩张导管内见扁平状实质回声及细小钙化。Nassar[6]报道了1例SPC,灰阶超声见3个稍低回声实性团块,呈微小分叶状。Athanasiou等[9]认为,SPC可表现为实性肿块或实性为主的混合性团块,可伴有微钙化。Yoshimura等[10]报道了1例双侧乳腺SPC,右侧为囊实性团块,左侧为低回声团块。Leena等[11]报道了2例浸润性SPC,超声表现为囊实性团块,实性部分突入囊腔内。本组资料中,SPC呈两种超声表现:① 导管内型(50%),扩张导管内见实性扁平状肿块或囊实性肿块,壁上见乳头,肿块可位于一支导管内,亦可分布在相邻的数支扩张导管内;② 实性肿块型(50%),肿块完全呈实性,多数为不均质低回声,卵圆形,边界清晰,血流丰富。
SPC首先需与乳腺导管内乳头状瘤鉴别诊断。导管内乳头状瘤好发于40~50岁女性,较SPC患者发病年龄小10~20岁。导管内乳头状癌与乳头状瘤的超声鉴别诊断报道较多,SPC或导管内乳头状癌实体变型与乳头状瘤的超声鉴别诊断未见报道。导管内乳头状癌与乳头状瘤的超声表现有较多重叠,但乳头状瘤更多表现为肿块较小,距乳头较近,单发,边界光整,内部回声均匀,呈圆形或卵圆形,后方回声不变[12-18]。本组资料中,61.11%的SPC超声诊断为恶性肿瘤,超声表现为肿块较大或多发导管内充满实质回声,肿块回声不均匀,形态不规则,后方回声增强或衰减,血流丰富。本组资料中,100%的单发导管内原位SPC、20%的多发导管内原位SPC及22%的实性原位或原位伴微小浸润SPC术前超声诊断为导管内乳头状瘤。误诊原因是肿瘤为原位癌或原位癌伴微小浸润,部分周围组织亦伴导管内乳头状瘤病,肿瘤无周围组织浸润,呈良性超声表现。导管内型SPC需与乳腺导管扩张症鉴别[12]。乳腺导管扩张症为乳腺导管慢性炎性反应,导管内出血或分泌物潴留时,导管内见回声,类似SPC表现;但CDFI提示管腔内无明显彩色血流信号,与SPC表现不同。肿块型SPC需与其他良性实性肿块如乳腺病鉴别[12]。SPC的形态多不规则,回声不均匀,血流丰富,多呈恶性肿块表现。
Kim等[17]认为,原位及浸润性SPC的主要差别为原位癌多边界光整。本组资料中,原位SPC的灰阶超声表现为实性肿块、单发或多发导管内肿块,弹性超声评分为1~2分;SPC伴局灶微小浸润的灰阶超声表现为实性肿块或多发导管内肿块,弹性超声评分为1~2分;SPC伴浸润的灰阶超声均表现为实性肿块,弹性超声评分为4分。灰阶超声与超声弹性成像联合应用对SPC的浸润程度有一定提示作用。Choi等[19]报道了87例导管内乳头状病变的超声弹性成像表现,良性、不典型及恶性导管内乳头状病变的弹性评分如下,1分:16,1,0;2分:23,9,0;3分:22,8,4;4分:8,2,2。导管内乳头状癌的弹性评分均>2分,与本组资料有所不同。
总之,乳腺SPC有多种超声表现,超声有助于多发导管内病灶及实性病灶的术前良恶性鉴别诊断,灰阶超声与超声弹性成像联合应用有助于提示SPC浸润程度。

