基于枫叶的碳量子点制备及其发光性能
崔 博,郑静霞,刘兴华,贾虎生,杨永珍,刘旭光
(太原理工大学 a.新材料界面科学与工程教育部重点实验室,b.材料科学与工程学院,c.新材料工程技术研究中心,太原 030024)
碳量子点(carbon quantum dots,CQDs)是平均粒径小于10 nm,表面富含羟基、羰基等基团,且具有荧光性能的准零维碳纳米粒子。CQDs不但保持了碳材料本身的绿色环保、原料广泛、易修饰、制备成本低等优良性能,同时又具备发光波长可调、光稳定性好、色饱和强度高、双光子吸收面积大等独有优势,因而在光电器件领域和生物探针、光催化、细胞成像、化学传感等领域展现出广泛的应用前景[1-3]。
目前,合成CQDs所用的碳源大部分是含碳结构的前驱体(如碳纳米管[4]、石墨[5]和活性炭[6])或者一些传统的化学药品(如柠檬酸及柠檬酸盐[7-8]、碳水化合物[9-10])。然而在近几年里,生物质废料逐渐成为合成CQDs的碳源。对这些生物质原料的合理利用不仅可以达到研究者对合成产物的要求,还能起到改善环境、节约资源的效果。2013年,QIN et al[11]将低成本的柳树皮进行水热处理得到了粒径为1~4 nm的CQDs,并将其应用于光催化。2015年,DUBEY et al[12]将大豆作为碳源,采用一步水热法合成了CQDs,并将其应用于成像。2016年,TYAGI et al[13]将柠檬皮作为碳源,合成了荧光量子产率为14%的CQDs,并将其应用于传感器和光催化。因此可以看出,日常生活中的原料及废弃物能够为CQDs的合成提供丰富的碳源选择。
枫叶是一种常见的生物质材料,富含C、H、O等元素,具有绿色无毒、环境友好等优点,且成本几乎为零。因此本文以秋天的落叶——枫叶作为碳源,采用简单有效的一步水热法进行热解处理得到CQDs,并对其进行形貌结构和光学性质的表征分析。
1 实验部分
1.1 实验试剂与设备仪器
实验原料:枫叶(太原理工大学校园采集);去离子水H2O(实验室自制);硫酸奎宁(C20H24N2O2)2·H2SO4·2H2O(国药集团化学试剂有限公司);无水乙醇C2H5OH(天津光复科技发展有限公司)。
制备设备:电热鼓风干燥箱(GZX-9140MBE);高压水热反应釜(100 mL);微量移液器(WKYIV-250);电子天平(BS223S);超声波清洗器(KQ-300DE);暗箱三用紫外分析仪(ZF-20D);聚醚砜膜(0.22 μm);透析袋一次性无菌注射器(5 mL).
表征仪器:用透射电子显微镜(TEM,JEOL JEM-2010)进行形貌分析;用荧光光谱仪(PL,HORIBA Jobin Yvon FluoroMax-4)和紫外可见分光光度计(UV-Vis,HitachiU-3900)进行光学性能分析;用X射线光电子能谱仪(Kratos AXIS ULTRA DLD)进行元素分析;用傅里叶变换红外光谱仪(FTIR,BRUKERTENSOR 27)进行表面官能团分析。用瞬态荧光磷光光谱仪(Edinburgh FLS980)测量荧光寿命;用暗箱三用紫外分析仪(ZF-20D)观察在紫外灯照射下的发光性能;用元素分析仪(VARIO EL CUBE)分析元素组成。
1.2 CQDs的制备
CQDs采用水热法合成。水热法一般是指将水作为反应溶剂,将反应原料密闭于压力反应釜中,通过高温高压合成产物的化学合成方法。该方法操作简便、安全性高,密闭的反应体系能够防止原料对空气敏感产生副反应,同时能有效阻止有害于环境的气体挥发,制备的产物粒子纯度高、分散性好。其具体的制备过程如下。
首先,将枫叶用去离子水和乙醇清洗数遍以除去枫叶上的灰尘和杂质。将清洗后的枫叶置于培养皿中,并将培养皿放于烘箱中(烘箱温度80 ℃),得到干燥的枫叶。将充分干燥的枫叶进行破碎处理,进一步进行研磨得到枫叶粉末,以备使用。称取0.5 g的枫叶粉末置于100 mL的反应釜中,并加入30 mL的去离子水。将密封的反应釜置于烘箱中,在水热体系下,通过脱水、聚合和碳化合成CQDs.参考生物质为碳源的实验条件[14],选择合成温度为200 ℃,合成时间为3 h.合成结束后,将冷却至室温的溶液置于离心管中进行离心,以除去离心管底部的固体,离心机转速为10 000 r/min,重复操作3次。将收集的上清液采用0.22 μm聚醚砜膜过滤以除去溶液中的大颗粒,提纯后的溶液(纯度高达99.0%)即CQDs溶液。将CQDs溶液通过冷冻干燥得到固体粉末,以便进行后续表征。其实验流程图如图1所示。
2 结果与讨论
2.1 CQDs的结构与形貌
为了将产物与原料对比,采用元素分析仪对枫叶和CQDs的元素成分进行了定量分析。如表1所示,CQDs与枫叶相比,C含量明显下降,而N含量有所增加。
通过CQDs的FTIR光谱图来研究其表面所存在的官能团。如图2所示,枫叶和CQDs分别在3 422 cm-1和3 325 cm-1处的吸收带属于O—H的伸缩振动。位于2 922 cm-1和2 941 cm-1处的吸收峰是由于枫叶和CQDs中C—H的伸缩振动引起。

图1 基于枫叶合成的CQDs及其性能测试Fig.1 Synthesis of maple leaf-based CQDs and their performance testing

表1 枫叶和CQDs的元素组成(质量分数)Table 1 Element contents of maple leaf and CQDs %

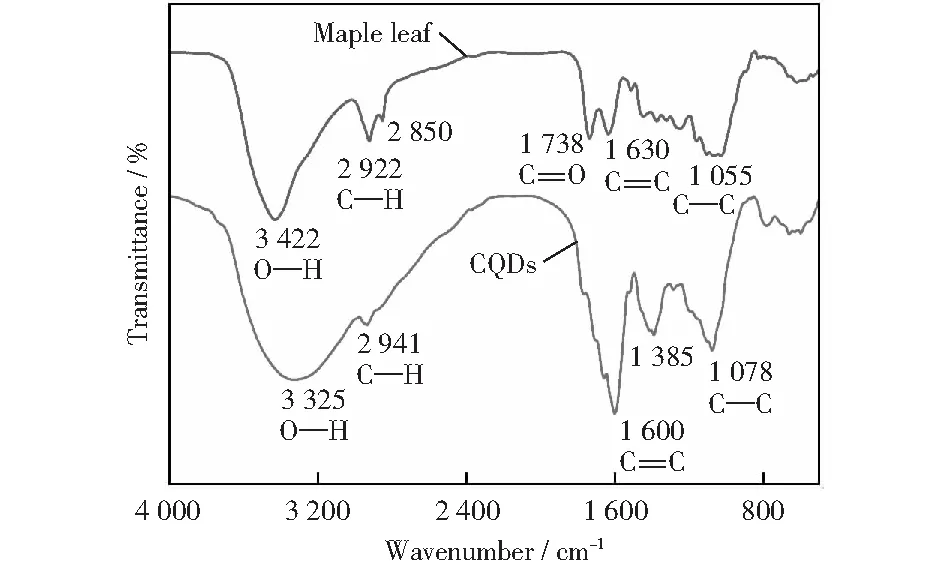
图2 枫叶和CQDs的FTIR谱图Fig.2 FTIR spectra of the maple leaf and CQDs


图3 CQDs,C1s,N1s,O1s的XPS谱图Fig.3 XPS spectra of CQDs, C1s, N1s and O1s
从以上实验结果得到CQDs的表面组成之后,通过TEM对CQDs的形貌和结构进行了表征。从图4中的TEM图像可以看出,CQDs为类球形,其直径约6.0 nm,没有发生明显的团聚现象。

图4 CQDs的TEM图像Fig.4 TEM image of CQDs
通过XRD测试分析了CQDs的晶相结构。如图5所示,从XRD图中可以看出,在衍射角2θ=22.0°处有一个宽的衍射峰,说明CQDs是无定形结构。

图5 CQDs的XRD图Fig.5 XRD pattern of the CQDs

图6 CQDs的TG曲线图(氮气气氛)Fig.6 TG curve of CQDs(N2 atmosphere)
在氮气气氛下,通过TG分析对CQDs的热稳定性进行了考察。从图6中可以看出,CQDs在200 ℃时质量衰减约10%;当温度升至900 ℃时,CQDs的质量呈现出大幅度的减少,大约衰减70%.质量的减少可能是由于CQDs表面亲水性官能团的分解。
2.2 CQDs的光学性质


图7 CQDs的UV-vis吸收光谱Fig.7 UV-vis absorption spectrum of the CQDs aqueous solution

图8 CQDs的荧光激发光谱Fig.8 Excitation spectrum of the CQDs aqueous solution


图9 不同激发波长下CQDs的PL谱图Fig.9 PL spectra of CQDs under different excitation wavelength
CQDs的荧光量子产率(QY,quantum yield)测定:以二水合硫酸奎宁为标准物质(溶剂为0.1 mol/L的稀硫酸,标准QY值为54%),采用相对法来测定。
首先,采用UV-Vis测量标准物溶液和CQDs溶液在360 nm处的吸光度A(为避免内滤效应对样品吸收的影响,将A值控制在0.1以下)。分别取4个不同吸光度下的标准物溶液和CQDs溶液,然后采用稳态荧光光谱仪测量其在360 nm激发波长下的PL光谱。计算并记录发射波长范围在380~700 nm内的荧光积分强度值。分别以吸光度为横坐标,荧光积分强度为纵坐标,作图计算,得出斜率。再根据公式(1)计算得到CQDs的QY:
Qc=Qst(kc/kst)(ηc/ηst)2.
(1)
式中:Q为QY的量符号;k为斜率;η为溶液的折射率;下标st表示标准物;下标c表示CQDs.
对所制备的CQDs采用时间分辨荧光衰减测试了其荧光寿命,如图10所示。图10显示该CQDs衰减曲线可拟合为双指数函数,其拟合方程如下:
Y(t)=α1exp(-t/τ1)+α2exp(-t/τ2) .
(2)
式中:Y(t)是单个指数衰减强度的总和;α1和α2分别为衰减时间τ1和τ2对衰减影响的比例系数。CQDs的平均寿命可由公式(3)计算:
(3)
由公式(3)计算得出该CQDs的平均寿命为4.73 ns.
为了考察所合成CQDs的荧光稳定性,将CQDs置于不同浓度的NaCl溶液中,考察溶液的荧光强度变化。如图11所示,当NaCl浓度由0 mol/L增加至2.0 mol/L,CQDs的荧光峰位置没有发生偏移,且最大发射峰(λ=438 nm)强度没有明显的变化。这说明在高离子强度环境下,该CQDs表现出高的荧光稳定性,可用于分析检测和生物标记。
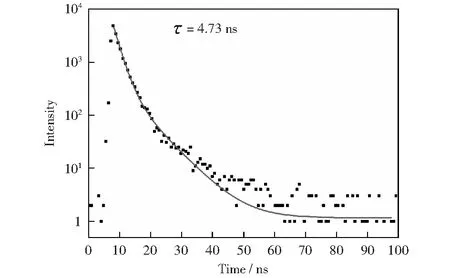
图10 CQDs的荧光衰减谱图及其拟合曲线Fig.10 Fluorescence-decay and fitting curves of the CQDs

图11 CQDs置于不同浓度NaCl溶液的PL谱图Fig.11 PL spectra of CQDs in different concentration of NaCl solution
3 结论


