凝血酶敏感蛋白1参与糖脂代谢调节的研究进展
白金运,高 鑫
复旦大学附属中山医院内分泌及代谢科,复旦大学代谢疾病研究所,上海 200032
凝血酶敏感蛋白(thrombospondins, TSP)是一种可以介导多种生物学过程的细胞外基质蛋白,作为细胞外的结构物质,可传递一系列信号,介导细胞与细胞、细胞与细胞基质的相互作用[1-2]。TSP家族包含凝血酶敏感蛋白1~5。凝血酶敏感蛋白1(thrombospondin-1, TSP-1)是该家族中最早发现的蛋白。近年来,人们对TSP-1的生物学特性和功能研究较多,TSP-1与糖脂代谢的关系也是目前研究的热点之一。
1 凝血酶敏感蛋白1的发现与生物学特点
1971年,Baenziger等[3]采用凝血酶刺激完整的人血小板后,通过聚丙烯酰胺凝胶电泳对比发现,一条相对分子质量(Mw)为190 000的蛋白条带在凝血酶处理后消失,研究人员推测这可能是由于该条带所代表的蛋白被凝血酶水解,并因此命名为凝血酶敏感蛋白(thrombin-sensitive protein, TSP)。结合该研究团队之前的发现,凝血酶会引起甘油进入血小板后细胞膜磷脂酰丝氨酸双层结构的增加,Baenziger等推测这种凝血酶敏感蛋白可能参与了凝血酶促进血小板磷脂合成的过程。
随后的研究[4]揭示了TSP-1是具有多种功能域的同源三聚体糖蛋白,分子量约为450 kDa,其单体亚单位分子量为140 kDa。编码TSP-1的基因THBS-1位于第15号染色体的q11-qter位点。TSP-1的空间结构是由3条通过二硫键链接的多肽链构成的,在细胞外分为不同的功能区域。氨基端是肝素结合位点,介导TSP-1蛋白的迁移和摄取,同时介导细胞的黏附和趋化。原胶原区参与抑制血管新生,随后是3段重复序列(Ⅰ型、Ⅱ型、Ⅲ型),参与细胞黏附、迁移、生长和血管新生[5]。最后是羧基端,参与调节细胞黏附、迁移、血小板聚集和一氧化氮(NO)信号(图1)。
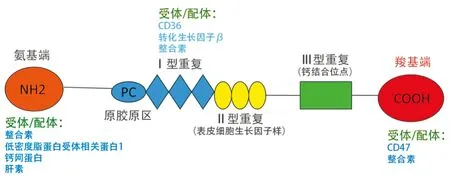
图1 TSP-1的结构和相关受体/配体
2 TSP-1受体与作用机制
TSP-1的受体最早由Asch等[4]在1987年发现,研究人员发现1种叫作OKM5的单克隆抗体可以抑制TSP-1与激活的血小板之间的结合,进一步采用免疫沉淀确定了1种分子量为88 kDa可以与OKM5结合的糖蛋白,可能是TSP-1的膜受体。结合文献报道[6-7],已知OKM5可以与分子量大小约为90 kDa的糖蛋白Ⅳ(GPⅣ)(即CD36)结合,并且GPⅣ的抗体也可以抑制TSP-1与激活的血小板之间的结合。因此,研究人员推测GPⅣ是TSP-1的膜受体。随后1992年的研究[8]采用CD36的正义或反义cDNA特异性敲低CD36后研究TSP-1的作用,证实了GPⅣ(CD36)是TSP-1的膜受体。
CD36是1种广泛表达于多种细胞表面的清道夫受体,具有脂肪酸转位酶的作用,TSP-1可以诱导CD36的二聚化[9]。CD36存在于多种细胞表面,如内皮细胞、血管平滑肌细胞、脂肪细胞、巨噬细胞、小管上皮细胞和肾小球足细胞[10-11]。Leung等[12]研究发现CD36与TSP-1的Ⅰ型重复区结合,激活p38丝裂原活化蛋白激酶(MAPK)通路,诱导内皮细胞的凋亡,负向调节血管再生(图2)。

图2 CD36介导TSP-1抗血管新生作用示意图
VEGFR2:血管内皮生长因子2;VEGF:血管内皮生长因子;TSR:凝血酶敏感蛋白Ⅰ型重复区;Fyn:原癌基因蛋白酪氨酸激酶;p38 KAP kinase:p38促分裂素原活化蛋白激酶
在肾足细胞中,TSP-1结合CD36可以激活p38-MAPK通路,诱导肾足细胞的凋亡;另外,游离脂肪酸(free fatty acid, FFA)通过与CD36的FFA结合位点(p127-279)[13]结合,导致足细胞MAPK通路激活,进而刺激TSP-1的表达,TSP-1分泌到细胞外基质中,与CD36的TSP-1结合位点(p93-110)[14]结合诱导足细胞凋亡和功能紊乱[15]。巨噬细胞中,TSP-1结合CD36可以导致巨噬细胞激活[16]。TSP-1还可以通过调节细胞因子的表达发挥对脂肪细胞的代谢调控作用。研究[17]发现TSP-1是转化生长因子β(transforming growth factor-β, TGF-β)的关键激活物质,可能是通过CD36受体介导这一信号,使得TGF-β的信号通路易化,这一作用不仅存在于脂肪细胞中,还存在于非脂肪细胞中。升高的TSP-1可以激活TGF-β[18],激活的TGF-β进一步刺激肾脏系膜细胞产生大量细胞外基质蛋白如Ⅳ型胶原,导致肾脏纤维化。另外,TSP-1通过CD36途径参与肿瘤转移及炎症反应。
CD47表达在内皮细胞、平滑肌细胞、上皮细胞、中性粒细胞、红细胞和软骨细胞等上。CD47被TSP-1的羧基端激活后抑制细胞环鸟甘酸(cGMP)的产生(图3)[19]。NO介导可溶性鸟苷酸环化酶(soluble guanylate cyclase, sGC)的激活进而增加细胞内cGMP水平(NO-sGC-cGMP通路),这一机制发生在动脉平滑肌细胞、血小板或炎性细胞中,具有促血管舒张、血小板解凝集的作用。TSP-1可以通过结合CD36或CD47受体抑制上述作用。其中,TSP1-CD36信号通路是抑制内皮细胞NO-sSC信号的充分条件,TSP-1或TSP-1类似物如ABT-510结合CD36后,抑制了CD36的脂肪酸转运活性,并抑制NO的生成[20]。但TSP-1通过CD36受体对NO-sGC-cGMP信号通路的抑制作用需要CD47受体的存在[21]:CD36-/-的肌肉组织块和内皮细胞对TSP-1介导的NO-sGC-cGMP通路抑制作用仍然存在,而TSP-1的这一抑制作用在CD47-/-的组织块中不再发生,并且CD47-/-的内皮细胞sGC和cGMP的水平升高。因此,CD47是TSP-1发挥对NO-sGC-cGMP通路抑制作用的必要条件。
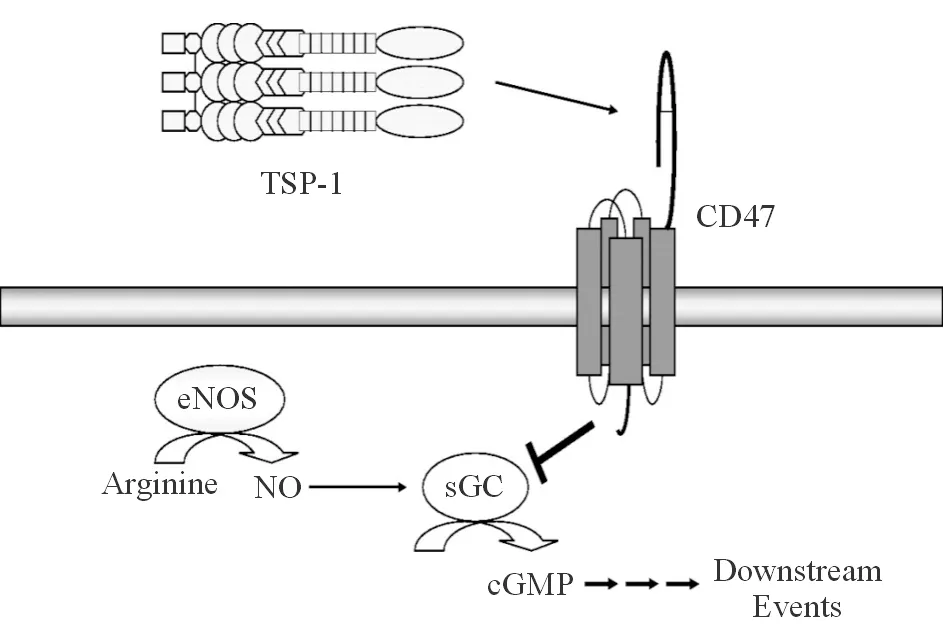
图3 CD47介导TSP-1抑制NO依赖性环鸟苷酸生成
Arginine:精氨酸;eNOS:内皮型一氧化氮合酶;NO:一氧化氮;sGC:可溶性鸟苷酸环化酶;cGMP:环鸟甘酸
3 TSP-1与糖脂代谢
TSP-1可以与细胞表面一系列的受体结合,包括上述介绍的CD36、CD47,还有蛋白聚糖、整合蛋白等,并且可以结合蛋白酶生长因子和多种生物活性分子,参与多种细胞活动,如组织修复中的止血、细胞黏附、迁移、增殖凋亡、细胞外基质的表达和重组、调节生长因子活性和细胞骨架重组[5,22]。目前关于TSP-1的研究主要集中在新生血管的形成、细胞纤维化与凋亡、癌症发生发展以及对细胞质微环境的影响等领域。近年来,TSP-1在代谢性疾病中的作用逐渐引起了学者们的兴趣。如在肥胖和糖尿病模型中TSP-1的表达明显上调[23],其表达水平与炎症活动及代谢紊乱程度相关联,是脂肪细胞核巨噬细胞导致脂肪组织炎症的重要纽带。目前,关于TSP-1在糖脂代谢领域的研究还处于表型研究阶段,并且还存在一些相互矛盾的结果;另外TSP-1参与糖脂代谢的作用机制还缺乏深入的研究,其通路是否与上述TSP-1在肿瘤转移、炎症反应、血管新生中的CD36下游或CD47下游信号途径相关还需要更多的研究。本文将就目前TSP-1在糖脂代谢领域的研究工作做一总结,并初步提出可能涉及的机制研究方向。
3.1 TSP-1对脂质代谢的影响 短期高脂喂养(45% HFD,3周)小鼠可以检测循环中的TSP-1表达量明显上升,而TSP-1基因(即Thbs1基因)敲除(Thbs1-null)小鼠高脂喂养不再出现显著的体质量增加和脂肪细胞肥大。高胰岛素-正葡萄糖钳夹实验显示:Thbs1-null小鼠不再出现高脂诱导的胰岛素抵抗。组织特异性葡萄糖摄取试验进一步发现Thbs1-null小鼠的胰岛素敏感的表型主要由骨骼肌细胞介导[24]。有趣的是,在高脂喂养的Thbs1-null小鼠皮下脂肪组织中还发现与解偶联蛋白1(uncoupling protein 1, UCP1)阳性的棕色脂肪类似的结构,这可能也是其代谢改善的一个利好因素。
另一项长期高脂喂养研究[25]提供了不尽相同的结果,Kong等用60%的高脂饮食喂养小鼠5个月后发现,与对照组相比,高脂组小鼠性腺周围组织TSP-1表达显著增高,TSP-1的表达主要存在于脂肪间质中;并且未分化的3T3-L1前脂肪细胞的TSP-1的表达量高于已分化的脂肪细胞,除了脂肪细胞之外,脂肪组织的血管细胞、巨噬细胞、内皮细胞、平滑肌细胞和成纤维细胞都可以高表达TSP-1。与野生型小鼠相比,高脂喂养的Thbs1-null小鼠血清游离脂肪酸和三酰甘油水平显著上升,这提示TSP-1可能参与了脂质的摄取过程,但在前文短期高脂喂养研究[24]中未发现Thbs1-null对血清脂质浓度的影响。
3.2 TSP-1对胰岛素敏感性的影响 Thbs1-null小鼠高胰岛素-正葡萄糖钳夹实验显示Thbs1-null小鼠不再出现高脂诱导的胰岛素抵抗,组织特异性葡萄糖摄取试验进一步提示Thbs1-null小鼠的胰岛素敏感的表型主要由骨骼肌细胞介导[24]。有研究[26]采用重组的TSP-1蛋白作用于培养的C2C12肌小管细胞,发现TSP-1可以激活c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)、p38及IKK信号通路并呈剂量依赖性关系,上述激活的信号通路可以诱导胰岛素受体底物1(insulin receptor substance 1, IRS1)Ser636/639位点丝氨酸磷酸化从而抑制胰岛素信号通路,这与TSP-1处理可以降低胰岛素依赖的Akt磷酸化水平的结果相符,证明了在肌肉细胞中TSP-1通过以上信号途径诱导了胰岛素抵抗的产生。然而,在HepG2肝癌细胞中,TSP-1仅能激活JNK与p38,并未引起IKK的激活,也未能引起IRS1丝氨酸磷酸化的增加。然而,在年老的Thbs1-null小鼠(小鼠龄大于1年)中,研究[27]发现TSP-1缺失的小鼠胰岛血管增多,葡萄糖耐量试验显示胰岛β细胞功能受损,与野生型小鼠相比,胰岛β分泌的胰岛素仅为野生型的15%。
3.3 TSP-1在非酒精性脂肪肝中的作用 成年肝脏中,生理状态下TSP-1可检测的表达很低或检测不出表达[28]。有研究[29]将肝内各细胞分离检测发现,TSP-1在肝窦血管内皮细胞中有表达,染色示TSP-1在肝窦周围(Disse腔)形成细小弯曲的纤维状结构;肝星状细胞分离培养7 d后也可以大量表达TSP-1,并且表达出的TSP-1在细胞周围沉积为纤维性的基质;生理状态分离的肝细胞未检测出TSP-1表达。在病理状态下,如先天性肝纤维化患者的肝细胞可以检测TSP-1的表达量增高,肝星状细胞TSP-1的分泌量更高。在体外构建的非酒精性脂肪肝模型中,游离脂肪酸处理肝细胞增加细胞内脂质沉积,同时促炎细胞因子和TSP-1的表达增多[30]。在局部肝切除的小鼠模型中,酒精处理的大鼠、四氯化碳或3,5-二乙氧羧基-1,4-二氢可力丁诱导的小鼠肝纤维化模型中肝星状细胞可以表达TSP-1。另外,酒精性肝硬化、非酒精性脂肪性肝炎相关的肝硬化或其他肝纤维化患者均可以检测出TSP-1的上调[31-32]。
3.4 TSP-1在糖脂代谢领域的研究前景 虽然TSP-1与胰岛素抵抗及脂肪肝的关系已有一定数量的文献报道,但是TSP-1如何参与这一过程的具体机制还缺乏研究。TSP-1参与糖脂代谢是否通过TSP-1的受体如CD36、CD47介导,相互作用的位点是否具有特异性,作用后如何与经典的糖代谢、脂代谢的通路产生Crosstalk等问题还需进一步探究。例如,在非酒精性脂肪肝的发病机制中,肝细胞的脂肪酸摄取、脂质生成、β氧化及三酰甘油以极低密度脂蛋白转运的失衡是始动因素[33-35],TSP-1在以上哪一环节发挥何种作用还缺乏深入的研究。其中多种关键信号如固醇调节元件结合蛋白1c(sterol regulating element binding protein 1c, SREBP-1c)、乙酰辅酶A羧化酶2(acetyl-CoA carboxylase 2, ACC2)、肉毒碱棕榈酰基转移酶1(carnitine palmitoyl transferase 1, CPT-1)及腺苷酸活化蛋白激酶(AMP activated protein kinase, AMPK)等与TSP-1的关系尚缺乏研究。如何阐明TSP-1在肝细胞脂质沉积中的具体机制,还需要通过研究确定以上这些关键信号通路是否参与了TSP-1影响肝细胞脂代谢的过程和通过何种受体介导,解决这些问题可为非酒精性脂肪肝的发病机制研究提供新的方向。
4 小 结
综上所述,TSP-1是具有多种功能的细胞外基质蛋白,肥胖及糖尿病可伴随TSP-1的表达上调。脂肪组织中TSP-1的表达可介导脂肪组织炎症反应,并影响组织对脂肪酸的摄取。并且,TSP-1在肝脏疾病,如非酒精性脂肪性肝病的发病机制中发挥作用。作为细胞外基质蛋白,TSP-1是通过特定的功能结构域发挥其调节作用。因此,基于多肽特异性结合位点研究小分子类似物或抑制剂,可进一步揭示TSP-1参与糖脂代谢的细胞和分子机制,并为肥胖、糖尿病及糖尿病并发症提供新的治疗手段。

