草鱼呼肠孤病毒AH528株全基因组特征及进化分析*
吴明林 李海洋 江 河 何吉祥 侯冠军 蒋阳阳
草鱼呼肠孤病毒AH528株全基因组特征及进化分析*
吴明林 李海洋 江 河 何吉祥①侯冠军 蒋阳阳
(安徽省农业科学院水产研究所 合肥 230031)
草鱼出血病是由草鱼呼肠孤病毒(Grass carp reovirus, GCRV)引起的严重危害1~2龄草鱼的一种传染性疾病。本研究从安徽合肥地区患典型草鱼出血病的病鱼组织中分离到1株新的GCRV致病株,暂命名为GCRV-AH528。鱼体人工感染实验结果显示,实验鱼出现典型的出血病症状:体背发黑,鳍基部、腹部、口腔、鳃丝、肠道充血发红。全基因组特征分析显示,GCRV-AH528由11个双链RNA节段组成,节段大小在1027~3925 bp之间,AT平均含量为50.2%,GC平均含量为49.8%。与其他GCRVⅡ型毒株相比,L1节段在701~702位置缺少3个核苷酸(TAT),少编码1个酪氨基;M4节段出现突变,含2个开放阅读框,编码2个非结构蛋白NS9和NS69。所有节段两端均含有6 bp保守的末端核苷酸序列5¢-GUAAU/CUUU/GCAUC-3¢;另除L1、M6节段外,其余9个节段均在编码区两侧发现5~9 bp的颠倒互补序列。GCRV-AH528与其他呼肠孤病毒核苷酸平均相似度在37.1%~98.1%之间;编码蛋白平均相似度在24.3%~98.3%之间。基于VP1蛋白的聚类分析结果显示,该病毒属于水生呼肠孤病毒属,在氨基酸水平上与典型株GCRV-873株的进化关系较远。本研究结果表明,该毒株为一株新的草鱼呼肠孤病毒Ⅱ型致病株。
草鱼出血病;草鱼呼肠孤病毒;VP1蛋白;水生呼肠孤病毒
草鱼()是中国淡水养殖的主要品种之一,除西藏、青海零星养殖外,在我国各地均有较大规模的养殖。中国渔业统计年鉴显示,2015年我国淡水鱼类养殖产量为3062.27万t,其中,草鱼的养殖产量为567.62万t,为我国所有养殖鱼类之首(农业部渔业渔政管理局, 2016)。草鱼养殖为保障我国农产品市场供给和人民生活水平的提高做出了重要贡献。然而,草鱼也是水产养殖动物中病害最为多发的一种鱼类,主要病害包括草鱼出血病、肠炎病、赤皮病、烂鳃病等(程文超等, 2016)。在感染草鱼的所有病原中,由草鱼呼肠孤病毒(Grass carp reovirus, GCRV)感染引起的草鱼出血病是草鱼养殖中最为常见的疾病,成为我国淡水水产养殖中最为突出的问题之一,于2008年被农业部规定为水生动物二类疫病。据不完全统计,我国每年由草鱼出血病导致的经济损失在10亿元以上(Liang, 2014; Rodger, 2016)。
GCRV是中国分离的第一种鱼类病毒,属于呼肠孤病毒科、水生呼肠孤病毒属,其变异性强,不同地区存在不同的毒株(Fan, 2013; 郝贵杰等, 2011; 刘永奎等, 2011)。GCRV毒株的地域差异性给该病的防治带来巨大困难。不同分离株在毒力水平、细胞培养特性、免疫抗原性和对草鱼的致病力等方面都具有较大的差异性(Fan, 2013; 柯丽华等, 1990; 张超等, 2010)。GCRV不同分离株的基因组均由11个节段组成,按分子量大小可分为3组,即较大节段(L1、L2和L3)、中等节段(M4、M5和M6)和较小节段(S7、S8、S9、S10和S11)(张超等, 2010)。研究表明,分节段的双链RNA病毒,易于发生抗原变异及遗传变异(Jiang, 2009; 黄毅昌等, 2016)。根据现有的分离株序列信息进行核苷酸序列与氨基酸序列比对以及构建系统进化树分析,GCRV至少存在3种基因型,按照基因序列差异分为I型(代表株GCRV-873)、Ⅱ型(代表株GCRV HZ08)和Ⅲ型(代表株GCRV104) (Wang, 2012)。
本研究通过对采集自安徽合肥的发病草鱼样品进行病毒分离纯化,获得1株GCRV致病株,暂定名为GCRV-AH528。通过人工感染实验、核酸分析、序列测定、进化分析等方法对该毒株进行研究,解析草鱼出血病的分子流行病学特征,为该病害的防治提供基础资料。
1 材料与方法
1.1 实验材料
Trizol、DNA聚合酶、pMD™18-T Vector、DNA Marker购自TaKaRa公司;青霉素、链霉素购自碧云天;T4 RNA ligase购自Promega公司;引物、琼脂粉、LB培养基购自生工生物工程(上海)股份有限公司;琼脂糖凝胶DNA回收试剂盒购自TIANGEN;PCR仪为ABI Veriti 96孔;超微量分光光度计为Quawell Q5000。
1.2 样品的采集与处理
发病草鱼采集自安徽合肥,临床症状表现为鱼体变黑,鳍基部、鳃盖、鳃丝、眼眶、口腔和肠道充血发红,肛门红肿。收集病鱼的肝、肾、脾和肠组织,用无菌剪刀剪碎,加入10倍体积含双抗(100 IU/ml青霉素、100 mg/ml链霉素)的磷酸缓冲盐溶液(PBS)。在冰浴下研磨成组织匀浆液,将组织匀浆液转移至50 ml离心管中,在–80℃冷冻后于室温再融化,反复冻融3次。随后在4℃、8000 r/min离心30 min,上清液经0.22 μm滤器除菌后,置于–80℃保存备用。
1.3 人工感染实验
将体重为(100±20) g的健康草鱼随机分成2组,每组30尾。实验鱼饲养水温保持在(28±1)℃,每天投喂3次,投喂量占鱼体重的3%~4%。实验组通过腹鳍注射上述制备的病料组织悬液(0.5 ml/尾),对照组注射等量的PBS。
1.4 病毒细胞培养
草鱼肾脏组织细胞系(CIK)在塑料培养瓶中传代培养,至细胞长成单层后,吸出培养基。每瓶接种0.5 ml病毒悬液,28℃吸附1 h,每隔15~20 min轻微晃动培养瓶以便均匀吸附。吸附结束后,吸出多余的组织匀浆滤液,加入含2%血清的DMEM细胞培养基,显微镜下观察细胞增殖情况。病毒传代时,将病毒细胞培养物反复冻融2次,继续按上述接种方法传代培养。病样组织匀浆液接种CIK后,连续观察7 d,没有出现明显的细胞病变(CPE),盲传至第8代,连续观察仍未出现明显的CPE。
1.5 病毒基因组提纯与克隆
将含病毒的细胞培养物,–80℃至室温反复冻融2次,4℃、4000 r/min离心30 min,上清液0.22 μm滤器过滤,滤液20000 r/min、4℃离心2 h,弃上清液,沉淀用超纯水重悬后提纯病毒(Qiu, 2001)。Trizol法提取病毒RNA后,采用加接头引物的RT-PCR法扩增病毒基因组节段(Attoui, 2000)。首先在核酸的3¢端连接接头引物A(5¢-PO4-AGGTCTCGTAGACCGTGCACC-NH2-3¢),然后利用A的互补引物B(5¢-GGTGCACGGTCTACGAGACCT-3¢)反转录,最后利用B进行PCR扩增。PCR产物经1%的琼脂糖凝胶回收后,与pMD™18-T载体连接过夜,连接产物转化感受态DH5α,挑选阳性克隆委托生工生物工程(上海)股份有限公司测序。
1.6 序列分析
应用Lasergene数据包中的SeqMan程序对核苷酸序列进行拼接(Burland, 1999);使用NCBI的ORFfinder推测开放阅读框(http://www.ncbi.nlm.nih.gov/gorf/gorf. html);用ExPASy在线完成蛋白质理化特性分析(http://web.expasy.org/protparam/)。使用Motif Scan进行蛋白基序的分析(http://myhits.isb-sib.ch/cgi-bin/motif_ scan);用蛋白质分析软件Antheprot中的GOR I method对蛋白序列进行二级结构预测(Deléage, 2001)。应用Lasergene数据包MegAlign模块中的ClustalW对呼肠孤病毒核苷酸及其氨基酸序列进行同源性分析(Burland, 1999)。根据Neighbor-Joining(NJ)法,用MEGA软件构建进化树(Tamura, 2013)。
2 结果
2.1 人工感染实验
人工感染实验结果表明,GCRV-AH528对草鱼具有较强的毒力。草鱼被攻毒后,出现典型的出血病症状:体色发黑,鳍基部、腹部、口腔、鳃丝和肠道充血发红(图1)。
2.2 GCRV-AH528全基因组序列特征
GCRV-AH528全基因组由11个双链RNA组成,核苷酸序列长度在1027~3925 bp之间(登录号:KR180368-KR180378),序列两端含保守的核苷酸序列5¢-GUAAU/CU···UU/GCAUC-3¢。GCRV-AH528的11个节段AT含量为48.42%~54.23%,平均AT含量为50.20%;GC含量为45.77%~51.58%,平均GC含量为49.80%,AT含量略大于GC含量。进一步比较分析发现,除L1、M6节段外,其他9个节段均在编码区两侧发现5~9 bp的颠倒互补序列(表1)。所有节段中,M4节段含有2个终止密码子,编码2个蛋白,其余10个节段均编码1个蛋白。
2.3 L组节段核苷酸序列分析及编码的蛋白功能预测
GCRV-AH528 L1节段全长3925 bp,编码1个含1293个氨基酸的VP1结构蛋白,该蛋白与鸟苷酸转移酶/甲基转移酶同源,属于呼肠孤病毒L2超家族。GCRV-AH528 L1与其他呼肠孤病毒相似节段的核苷酸、氨基酸同源性分别为37.1%~98.6%、24.2%~98.6%。
GCRV-AH528 L2节段全长3867 bp,编码1个含1272个氨基酸的VP2结构蛋白,该蛋白为RNA依赖性RNA聚合酶(RdRp)。GCRV-AH528 L2具有呼肠孤病毒科RdRp的3个保守基序:motif I(IKACDASITPD YFLS)位于591~605氨基酸;motif Ⅱ(SG)位于687~ 688氨基酸;motif Ⅲ(GDD)位于738~740氨基酸。GCRV-AH528 L2与其他呼肠孤病毒相似节段的核苷酸、氨基酸同源性分别为46.2%~98.5%、43.3%~98.2%。

图1 草鱼出血病典型症状
A:体色发黑;B:腹部出血;C:口腔充血;D:鳃丝红肿;E: 肠道出血
A: Blackened dorsum; B: Abdominal bleeding; C: Oral cavity hyperemia; D: Red and swollen gill; E:Intestine hemorrhage
表1 GCRV-AH528全基因组序列特征

Tab.1 Characteristics of GCRV-AH528 genome segments
GCRV-AH528 L3节段全长3753 bp,编码1个含1232个氨基酸的内壳体蛋白VP3,该蛋白具有解旋酶及NTP酶的功能。序列分析发现,GCRV-AH528 VP3有1个保守的锌指结构域(Cys-His-Cys-His),位于氨基的第137~158位(CKVCLLEFDSLDKLQYHQALAH)。GCRV-AH528 L3与其他呼肠孤病毒相似节段的核苷酸、氨基酸同源性分别为40.1%~98.4%、29.9%~99.3%(表2和表3)。
表2 GCRV-AH528与其他呼肠孤病毒同源蛋白比较

Tab.2 Comparison of homologous proteins encoded by GCRV-AH528 and other reovirus
草鱼呼肠孤病毒AH528(GCRV-AH528):AMR58955.1-AMR58965.1;草鱼呼肠孤病毒873(GCRV-873):AAG10435.1- AAG10437.1,AAM92735.1-AAM92743.1;草鱼呼肠孤病毒104(GCRV104):AFG73672.1-AFG73681.1,ADM25848.3;美国草鱼呼肠孤病毒(AGCRV):YP_001837094.1-YP_001837105.1;哺乳动物呼肠孤病毒(MRV):ABP48913.1-ABP48922.1;禽呼肠孤病毒(ARV):YP_004226521.1-YP_004226530.1
表3 GCRV-AH528与其他呼肠孤病毒核苷酸及氨基酸相似度比较(%)
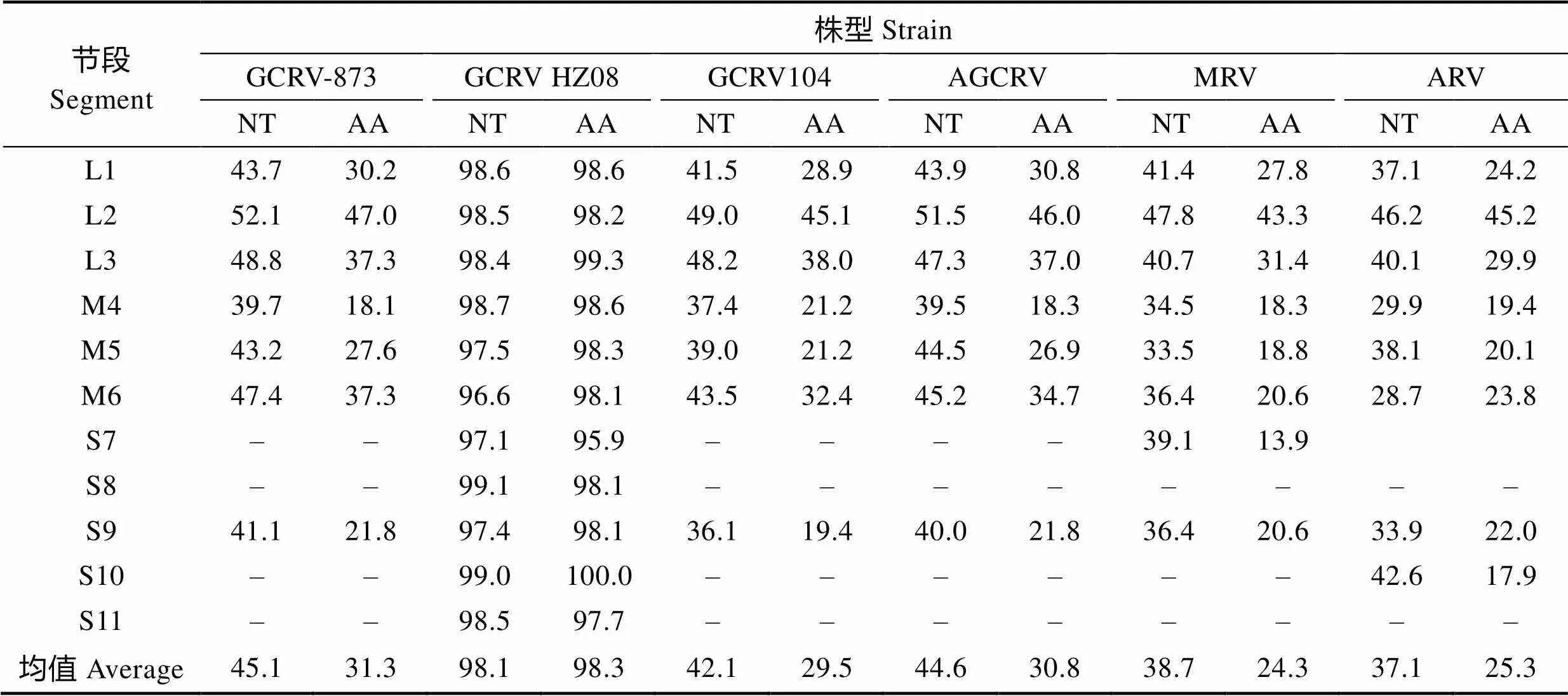
Tab.3 Comparison of nucleotide and amino acid sequence identity between GCRV-AH528 and other reovirus(%)
草鱼呼肠孤病毒873(GCRV-873):AH009795.2,AF403390.1-AF403397.1,AAG10435.1-AAG10437.1,AAM92735.1- AAM92743.1;草鱼呼肠孤病毒HZ08(GCRV HZ08):GQ896334.1-GQ8963337.1,GU350742.1-GU350748.1,ADJ75335.1- ADJ75345.1;草鱼呼肠孤病毒104(GCRV104):JN967629.1-JN967639.1,AFG73672.1-AFG73681.1,ADM25848.3;美国草鱼呼肠孤病毒(AGCRV):NC_010584.1-NC_010594.1,YP_001837094.1-YP_001837105.1;哺乳动物呼肠孤病毒(MRV):EF494435.1-EF494444.1,ABP48913.1-ABP48922.1;禽呼肠孤病毒(ARV):NC_015126.1-NC_015135.1,YP_004226521.1- YP_004226530.1;核苷酸:NT;氨基酸:AA
2.4 M组节段核苷酸序列分析及编码的蛋白功能预测
GCRV-AH528 M4节段全长2265 bp,含2个开放阅读框,编码2个非结构蛋白NS9(76个氨基酸)、NS69 (624个氨基酸),2个蛋白由46 bp的非编码区间隔。GCRV-AH528 M4与其他呼肠孤病毒相似节段的核苷酸、氨基酸同源性分别为29.9%~98.7%、18.1%~98.6%。
GCRV-AH528 M5节段全长2230 bp,编码1个含726个氨基酸的VP5蛋白,该蛋白属于呼肠孤病毒微管相关蛋白Mu-2超家族。GCRV-AH528 M5与其他呼肠孤病毒相似节段的核苷酸、氨基酸同源性分别为33.5%~97.5%、18.8%~98.3%。
GCRV-AH528 M6节段全长2028 bp,编码1个含650个氨基酸的VP4蛋白,属于呼肠孤病毒主要结构蛋白位于Asn 42和Pro 43。GCRV-AH528 M6与其他呼肠孤病毒相似节段的核苷酸、氨基酸同源性分别为28.7%~96.6%、20.6%~98.1% (表2和表3)。
2.5 S组节段核苷酸序列分析及编码的蛋白功能预测
GCRV-AH528 S7节段全长1604 bp,编码1个含512个氨基酸的VP56蛋白,该蛋白与水生呼肠孤病毒无同源性蛋白,但与哺乳动物呼肠孤病毒(MRV) Sigma 1和人腺病毒(Human adenovirus)fiber具有同源性。
GCRV-AH528 S8和S11节段分别编码VP41(361个氨基酸)和VP35(310个氨基酸)蛋白,2个蛋白与其他呼肠孤病毒无同源性蛋白。
GCRV-AH528 S9节段全长1320 bp,编码1个含418个氨基酸的VP6蛋白,该蛋白属于呼肠孤病毒科Sigma1/Sigma2超家族。GCRV-AH528 S9与其他呼肠孤病毒相似节段的核苷酸、氨基酸同源性分别在33.9%~97.4%、19.4%~98.1%。
GCRV-AH528 S10节段全长1124 bp,编码1个含345个氨基酸的NS38蛋白,该蛋白有1个保守的结构域,属于PolyG-pol超家族,具有poly(C)依赖的poly(G)聚合酶活性。GCRV-AH528 S10与ARV sigma NS的核苷酸、氨基酸同源性分别为42.6%、17.9% (表2和表3)。
2.6 GCRV-AH528与其他呼肠孤病毒典型株基因组特征比较
水生呼肠孤病毒有11个节段,而正呼肠孤病毒仅有10个节段,2个属的病毒编码7个同源性蛋白,同源蛋白平均相似度为24.3%~98.3%(表3)。进一步分析显示,2个属的病毒5¢末端序列相差较大,但3¢末端序列较保守,存在共同的序列UCAUC-3¢(表4)。
表4 呼肠孤病毒保守末端序列比较

Tab.4 Comparison of conserved terminal nucleotide sequences
2.7 GCRV-AH528系统进化分析
在GenBank数据库中搜索与GCRV-AH528 VP1蛋白具有同源性的序列,构建系统进化树(图2)。研究结果表明,VP1同源性蛋白至少分布于2个属,分别为水生呼肠孤病毒属和正呼肠孤病毒属。GCRV- AH528株与水生呼肠孤病毒聚为一簇,为草鱼呼肠孤病毒Ⅱ型株中的1个成员。
3 讨论
3.1 草鱼出血病流行病学特征
近年来,草鱼的高密度养殖造成其病害频发,细菌、寄生虫等引起的疾病较易控制,但由GCRV引起的草鱼出血病较难治疗。草鱼出血病疫情主要有以下流行病学特征:发病鱼主要为1~2龄草鱼,5~11月均有发病,同一渔场内的鱼塘相互感染,发病时呈急性大规模死亡,2~3 d内可死亡养殖草鱼总量的30%左右。水质较差的鱼塘还容易造成多种病原菌的继发感染,从而加重疫情,如出现烂鳃、赤皮、肠炎等。调查还发现,季节交替阶段、昼夜温差大的气候天气,特别是大雨后水温在回温过程中,病害较易发生。从攻毒实验可以看出,本研究获得的病毒使当年草鱼种出现典型的出血病症状,可见GCRV-AH528具有极强的致病性。以VP1蛋白为基础构建系统进化树,GCRV-AH528株与水生呼肠孤病毒聚为一簇,进一步聚类于GCRV-Ⅱ型株,与GCRV-I型(GCRV-873)、GCRV-Ⅲ型(GCRV104)在内的其他水生呼肠孤病毒属于不同的分支,距离较远。GCRV-AH528株与GCRV-873株、GCRV104株存在较大差异,却与近来发现的浙江湖州地区的HZ08株、湖北省的GCRV-109株具有极高的同源性(Pei, 2014),这不仅证明了草鱼呼肠孤病毒基因组的多样性分布,还从一定程度上说明GCRV-Ⅱ型株是近年来的主要流行毒株。
3.2 呼肠孤病毒基因多样性分析
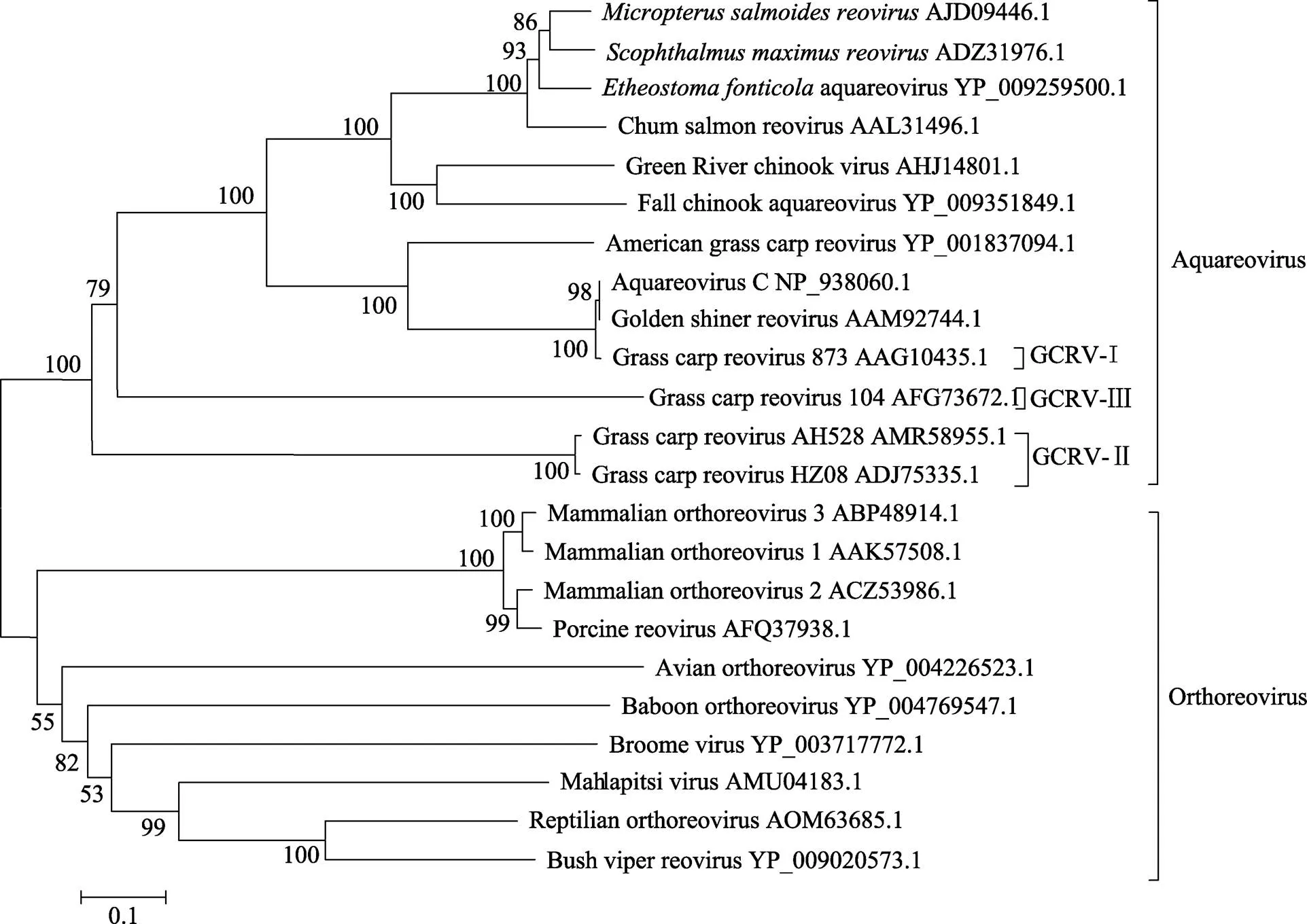
图2 基于VP1构建的系统进化树
呼肠孤病毒末端结构在病毒组装与功能识别方面发挥极其重要的作用,也是鉴别呼肠孤病毒的重要依据。GCRV相同基因型的毒株其末端特征基本一致,但不同基因型的毒株之间存在个别碱基的差别(Fan, 2013; 柯丽华等, 1990; 张超等, 2010)。GCRV-AH528基因组在5¢和3¢末端含有特异的保守序列和短的节段特异的颠倒互补序列。Anzola等(1987)推测末端保守序列是病毒基因组的信号区域,而颠倒互补序列为病毒基因组某一节段的信号序列。与其他Ⅱ型GCRV相比,本实验室分离的GCRV- AH528毒株L1节段编码区在701~702位置缺少3个核苷酸,少编码1个氨基酸;M4节段在253~255、2174~2176位置均出现终止密码子UAG,因此,M4节段存在2个开放阅读框,编码2个蛋白。研究结果充分说明,在进化过程中,GCRV毒株在一定程度上发生碱基的缺失或突变,导致核苷酸编码区发生变化,编码的蛋白发生差异,可见,GCRV存在较强的变异性。
不同类型、不同来源的呼肠孤病毒,其基因组序列、功能蛋白序列存在一定程度的差异。水生呼肠孤病毒均含有11个节段,而正呼肠孤病毒仅含有10个节段,这2个属的病毒基因组各个节段分子量有较大差异,但基因组总分子量相差不大(曾令兵等, 1991)。另对这2个属病毒编码的蛋白分析表明,它们之间仅7种蛋白存在同源性,可见呼肠孤病毒不同属之间存在一定的差异。序列相似度分析表明,GCRV-AH528与正呼肠孤病毒核苷酸、氨基酸的同源性低于水生呼肠孤病毒。但进一步研究发现,GCRV-AH528与GCRV-I型(GCRV-873)、GCRV-Ⅲ型(GCRV104)仅存在7种同源性蛋白,却与MRV、ARV存在8种同源性蛋白。GCRV-AH528 S7、S10节段编码的VP56、NS38蛋白与水生呼肠孤病毒无同源性蛋白,但分别与MRV Sigma 1蛋白、ARV sigma NS蛋白存在同源性序列,暗示GCRV-AH528在进化上比GCRV-873更趋于正呼肠孤病毒。
4 结论
本研究从分子生物学角度对GCRV-AH528新毒株进行鉴定,为安徽合肥地区草鱼出血病的防治提供了理论依据,同时,为免疫工作的开展提供了基础性的参考资料。在实际生产中应及早对该病病原进行检测,尽早预防和治疗。
Anzola JV, Xu ZK, Asamizu TSegment-specific inverted repeats found adjacent to conserved terminal sequences in wound tumor virus genome and defective interfering RNAs. Proceedings of the National Academy of Sciences of the United States of America, 1987, 84(23): 8301–8305
Attoui H, Billoir F, Cantaloube JFStrategies for the sequence determination of viral dsRNA genomes. Journal of Virological Methods, 2000, 89(1–2): 147–158
Burland TG. DNASTAR’s lasergene sequence analysis software. Humana Press, 1999, 71–91
Cheng WC, Zhou Y, Li WWAnalysis of old and new three diseases in grass carp. Ocean and Fishery, 2016(4): 68–70 [程文超, 周亚, 李万文等. 草鱼老三病与新三病的分析. 海洋与渔业, 2016(4): 68–70]
Deléage G, Combet C, Blanchet CANTHEPROT: An integrated protein sequence analysis software with client/server capabilities. Computers in Biology and Medicine, 2001, 31(4): 259–267
Fishery Bureau of Department of Agriculture. China yearbook of fishery statistics. Beijing: China Agriculture Press, 2016 [农业部渔业渔政管理局. 中国渔业统计年鉴. 北京: 中国农业出版社, 2016]
Fan YD, Rao S, Zeng LBIdentification and genomic characterization of a novel fish reovirus, Hubei grass carp disease reovirus, isolated in 2009 in China. Journal of General Virology, 2013, 94(10): 2266–2277
Hao GJ, Shen JY, Pan XYIsolation and identification of a strain of Grass carp reovirus in Huzhou. Progress in Fishery Sciences, 2011, 32(1): 47–52 [郝贵杰, 沈锦玉, 潘晓艺等. 草鱼呼肠孤病毒湖州分离株的分离及鉴定. 渔业科学进展, 2011, 32(1): 47–52]
Huang YC, Lei Y, Yang YTMolecular epidemiology of hemorrhage disease of grass carp and the diversity research of GCRV. Journal of Anhui Agricultural Sciences, 2016, 44(11): 120–125, 153 [黄毅昌, 雷燕, 杨玉滔等. 草鱼出血病分子流行病学及GCRV多样性研究. 安徽农业科学, 2016, 44(11): 120–125, 153]
Jiang YL. Hemorrhagic disease of grass carp: Status of outbreaks, diagnosis, surveillance, and research. Israeli Journal of Aquaculture-Bamidgeh, 2009, 61(3): 188–197
Ke LH, Fang Q, Cai YQ. Characteristics of a novel isolate of grass carp hemorrhagic virus. Acta Hydrobiologica Sinica, 1990, 14(2): 153–159 [柯丽华, 方勤, 蔡宜权. 一株新的草鱼出血病病毒分离物的特性. 水生生物学报, 1990, 14(2): 153–159]
Liang HR, Li YG, Zeng WWPathogenicity and tissue distribution of grass carp reovirus after intraperitoneal administration. Virology Journal, 2014, 11(1): 1–8
Liu YK, Wang Q, Zeng WWIsolation and identification of grass carp reovirus strain JX-0902. Journal of Fishery Sciences of China, 2011, 18(5): 1077–1083 [刘永奎, 王庆, 曾伟伟等. 草鱼呼肠孤病毒JX-0902株的分离和鉴定. 中国水产科学, 2011, 18(5): 1077–1083]
Pei C, Ke F, Chen ZYComplete genome sequence and comparative analysis of grass carp reovirus strain 109 (GCReV-109) with other grass carp reovirus strains reveals no significant correlation with regional distribution. Archives of Virology, 2014, 159(9): 2435–2440
Qiu T, Lu RH, Zhang JMolecular characterization and expression of the M6 gene of grass carp hemorrhage virus (GCHV), an aquareovirus. Archives of Virology, 2001, 146(7): 1391–1397
Rodger HD. Fish disease causing economic impact in global aquaculture. In: Adams A (Ed.), Fish Vaccines. Springer, Basel, 2016, 1–34
Tamura K, Stecher G, Peterson DMEGA6: Molecular evolutionary genetics analysis Version 6.0. Molecular Biology and Evolution, 2013, 30(12): 2725–2729
Wang Q, Zeng WW, Liu CComplete genome sequence of a reovirus isolated from grass carp, indicating different genotypes of GCRV in China. Journal of Virology, 2012, 86(22): 12466
Zeng LB, Zuo WG. Genome SDS-PAGE analysis and nucleic acid identification of grass carp hemorrhage virus strain 854. Freshwater Fisheries, 1991(5): 17–19 [曾令兵, 左文功. 草鱼出血病病毒854株基因组SDS-PAGE分析及其核酸类型鉴定. 淡水渔业, 1991(5): 17–19]
Zhang C, Wang Q, Shi CBIsolation and identification of a grass carp reovirus isolate GCRV HZ08. Journal of Fishery Sciences of China, 2010, 17(6): 1257–1263 [张超, 王庆, 石存斌等. 草鱼呼肠孤病毒HZ08株的分离与鉴定. 中国水产科学, 2010, 17(6): 1257–1263]
Genomic Characterization and Phylogenetic Analysis of Grass Carp Reovirus AH528 Strain
WU Minglin, LI Haiyang, JIANG He, HE Jixiang①, HOU Guanjun, JIANG Yangyang
(Fisheries Research Institute, Anhui Academy of Agricultural Sciences, Hefei 230031)
Grass carp haemorrhage is anepidemicdisease, which is caused by grass carp reovirus (GCRV). Grass carp fingerlings and yearlings are vulnerable to GCRV. A virulent reovirus, tentatively named GCRV-AH528, was isolated from a diseased grass carp exhibiting typical hemorrhage symptoms in Hefei, Anhui Province. Intraperitoneal injection with the virus suspension led to hemorrhage similar to the observed clinical symptoms of blackened dorsum and hemorrhage around the mouth cavity, gill, intestine, belly, and base of the fin ray. The GCRV-AH528 genome contained 11 double-stranded RNA segments ranging from 1027 to 3925 bp, and its averagecontent of AT and GC was 50.2% and 49.8%, respectively. Compared with registered GCRV Ⅱstrains, the GCRV-AH528 L1 segment had lost three continuous nucleotides (TAT) at nt 701~702, leading to the loss of a tyrosine, and the M4 segment mutated two ORFs encoding two non-structural proteins (NS9 and NS69). All segments had 6 bp-conserved terminal nucleotides 5'-GUAAU/CUUU/GCAUC-3'. Except for the L1 and M6 segments,the two ends inthe coding region of the other nine segments existed at 5~9 bp short specific inverted complementary sequences. GCRV-AH528 showed 37.1%~98.1% nucleotide and 24.3%~98.3% AA sequence identities with other reovirus. A phylogenetic tree based on VP1 protein revealed that GCRV-AH528 clustered with members of the genus Aquareovirus and was far from GCRV-873. These results indicated that the GCRV-AH528 isolate was a new GCRV Ⅱtype virulent strain.
Grass carp haemorrhage disease;Grass carp reovirus; VP1 protein; Aquareovirus
* 安徽省农业科学院学科建设项目(17A0515)、现代农业产业技术体系(CARS-46)、国家星火计划项目(2015GA710004)和安徽省农业科学院科技创新团队(13C0506)共同资助 [This work was supported by the Subjects Construction Fund of Anhui Academy of Agricultural Sciences (17A0515), the Earmarked Fund for China Agriculture Research System (CARS-46), China SparkProgram (2015GA710004), and the Scientific and Technological Innovation Fund of Anhui Academy of Agricultural Sciences (13C0506)]. 吴明林, E-mail: flyinghu2017@qq.com
何吉祥,副研究员,E-mail: flyinghu2008@foxmail.com
HE Jixiang, E-mail: flyinghu2008@foxmail.com
2017-07-12,
2017-07-27
10.19663/j.issn2095-9869.20170712001
吴明林, 李海洋, 江河, 何吉祥, 侯冠军, 蒋阳阳. 草鱼呼肠孤病毒AH528株全基因组特征及进化分析. 渔业科学进展, 2018, 39(5): 36–43Wu ML, Li HY, Jiang H, He JX, Hou GJ, Jiang YY. Genomic characterization and phylogenetic analysis of grass carp reovirus AH528 strain. Progress in Fishery Sciences, 2018, 39(5): 36–43
S941
A
2095-9869(2018)05-0036-08
(编辑 冯小花)

